FORMULACIONES FARMACEUTICAS PARA LA LIBERACION PROLONGADA DE PRINCIPIOS(S) ACTIVO(S) ASI COMO SUS APLICACIONES, PARTICULARMENTE TERAPEUTICAS.
Formulación farmacéutica líquida para la liberación prolongada de principio(s) activo(s) -PA-,
comprendiendo esta formulación al menos un principio activo PA, preferentemente en solución acuosa, y una suspensión coloidal, acuosa, de baja viscosidad, a base de partículas submicrónicas de polímero (PO) biodegradable, hidrosoluble y portador de grupos hidrófobos (GH), siendo dichas partículas asociadas de manera no covalente con dicho principio activo (PA),
Caracterizada porque:
? medio de dispersión de la suspensión está esencialmente constituido por agua,
? concentración en [PO] está fijada a un valor suficientemente elevado de manera que dicha formulación farmacéutica sea apta para ser inyectada por vía parenteral y para formar después in vivo un depósito gelificado, esta formación de depósito gelificado:
- siendo, por un lado, al menos en parte provocada por al menos una proteína fisiológica presente in vivo,
- y permitiendo, por otro lado, prolongar y controlar la duración de liberación del PA in vivo, más allá de 24 h después de la administración,
? líquida en las condiciones de inyección,
? es asimismo líquida a la temperatura y/o al pH fisiológicos, y/o en presencia:
* de electrolito fisiológico en concentración fisiológica,
* y/o de al menos un tensoactivo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2004/050603.
Solicitante: FLAMEL TECHNOLOGIE, SOCIETE ANONYME.
Nacionalidad solicitante: Francia.
Dirección: 33, AVENUE GEORGES LEVY, PARC CLUB DU MOULIN A VENT,69200 VENISSIEUX.
Inventor/es: MEYRUEIX, REMI, NICOLAS, FLORENCE, SOULA, OLIVIER, POULIQUEN,GAUTHIER.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- A61K47/42 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Proteínas; Polipéptidos; Sus productos de degradación; Sus derivados, p. ej. albúmina, gelatina or zeína (oligopéptidos que contienen hasta cinco aminoácidos A61K 47/18; poliaminoácidos A61K 47/34).
- A61K47/48R2T
- A61K51/12E
- A61K9/00M5D
Clasificación PCT:
- A61K38/20 A61K 38/00 […] › Interleuquinas.
- A61K38/21 A61K 38/00 […] › Interferones.
- A61K47/42 A61K 47/00 […] › Proteínas; Polipéptidos; Sus productos de degradación; Sus derivados, p. ej. albúmina, gelatina or zeína (oligopéptidos que contienen hasta cinco aminoácidos A61K 47/18; poliaminoácidos A61K 47/34).
- A61K9/14 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
Clasificación antigua:
- A61K38/20 A61K 38/00 […] › Interleuquinas.
- A61K38/21 A61K 38/00 […] › Interferones.
- A61K47/42 A61K 47/00 […] › Proteínas; Polipéptidos; Sus productos de degradación; Sus derivados, p. ej. albúmina, gelatina or zeína (oligopéptidos que contienen hasta cinco aminoácidos A61K 47/18; poliaminoácidos A61K 47/34).
- A61K9/14 A61K 9/00 […] › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
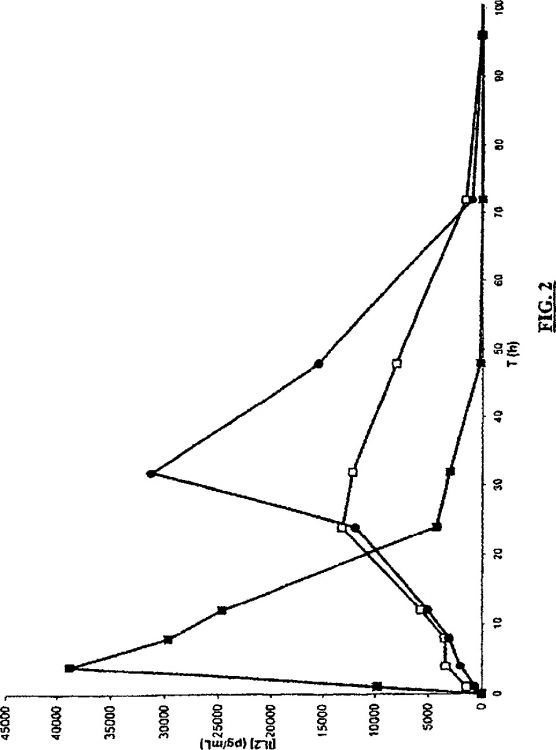
Fragmento de la descripción:
Formulaciones farmacéuticas para la liberación prolongada de principio(s) activo(s) así como sus aplicaciones, particularmente terapéuticas.
La presente invención se refiere a nuevas formulaciones farmacéuticas a base de suspensiones coloidales acuosas estables y fluidas para la liberación prolongada de principio(s) activo(s), en particular proteínica(s) y peptídica(s), así como a las aplicaciones, en particular terapéuticas, de estas formulaciones.
Estas formulaciones farmacéuticas activas se refieren tanto a la terapéutica humana como veterinaria.
En el campo de la liberación prolongada de los principios activos farmacéuticos, en particular de proteínas terapéuticas, existe una necesidad, en muchos casos, de reproducir lo mejor posible en el paciente una concentración plasmática en proteína o en péptido próxima al valor observado en el sujeto sano.
Este objetivo se enfrenta a la baja duración de vida de las proteínas en el plasma, lo que conduce a inyectar de manera repetitiva la proteína terapéutica. La concentración plasmática en proteína terapéutica presenta entonces un perfil "en diente de sierra" caracterizado por picos de concentración elevada y mínimos de concentración muy baja. Los picos de concentración, muy superiores a la concentración basal en el sujeto sano, tienen efectos nocivos muy marcados debido a la toxicidad elevada de las proteínas terapéuticas tales como la interleucina IL2. Por otra parte, los mínimos de concentración son inferiores a la concentración necesaria para tener un efecto terapéutico, lo que conlleva una mala cobertura terapéutica del paciente y efectos secundarios graves a largo plazo.
Asimismo, para reproducir en el paciente una concentración plasmática en proteína terapéutica próxima al valor ideal para el tratamiento del paciente, es importante que la formulación farmacéutica considerada permita liberar la proteína terapéutica con una duración prolongada, para limitar las variaciones de concentración plasmática a lo largo del tiempo.
Por otro lado, esta formulación activa debe preferentemente satisfacer a las características deseadas siguientes, ya conocido por los expertos en la técnica:
Para intentar alcanzar estos objetivos, ya se han propuesto varios enfoques en la técnica anterior.
En el primer enfoque, la proteína terapéutica nativa es modificada mediante injerto covalente de una o más cadenas de polímero o también mediante injerto covalente de una proteína tal como la albúmina sérica humana (HSA). La proteína así modificada tiene una menor afinidad para sus receptores y su término medio de vida en la circulación general aumenta considerablemente. La amplitud de la variación de concentración entre los picos y los huecos de concentración plasmática en proteína está así considerablemente reducida. De esta manera, la compañía Shering Plough comercializa con el nombre VIRAFÉRON® PEG un interferón alfa 2b modificado químicamente mediante injerto de una cadena de polietilenglicol de masa 12 kD. Esta modificación química se traduce por un aumento del término medio de vida en el paciente de 6,8 a 33 horas. Esta conducta de modificación química de la proteína terapéutica presenta, de manera general, dos inconvenientes mayores. En primer lugar, la modificación irreversible de la proteína que, no siendo ya una proteína humana, puede conducir a largo plazo a problemas de toxicidad y de inmunogenicidad. El segundo inconveniente proviene de la pérdida parcial de bioactividad de la proteína terapéutica modificada.
En un segundo enfoque, se ha propuesto aumentar la duración de acción gracias a formulaciones que comprenden al menos un polímero y un principio activo, líquidos a temperatura y atmósfera ambientes, inyectables y que se vuelven más viscosos después de la inyección, por ejemplo, bajo el efecto de un cambio de pH y/o de temperatura.
De esta manera, en este registro, la patente US-B-6 143 314 divulga una solución orgánica de polímero de liberación controlada de PA, que forma un implante sólido después de la inyección. Esta solución comprende:
Después de la inyección, (B) se dispersa o se disipa en los fluidos fisiológicos. (A) forma un implante encapsulante (C) que no está relacionado de manera covalente con (A) ni con (D), y que se libera entonces lentamente in vivo.
El principal inconveniente de esta técnica es usar un disolvente orgánico (B), potencialmente desnaturalizante para el PA (C) (por ejemplo proteínas terapéuticas) y tóxico para el paciente. Además, la hidrólisis in vivo del polímero (A) genera un ácido que puede conducir a problemas de tolerancia local.
Las solicitudes PCT WO-A-99/18142 y WO-A-00118821 se refieren a disoluciones acuosas de polímeros que contienen un PA en forma disuelta o coloidal, que son administrables a animales de sangre caliente, particularmente mediante inyección y que forman un depósito de PA (por ejemplo insulina) gelificado in vivo, debido a que la temperatura fisiológica es superior a su temperatura de gelificación. El gel así formado libera el PA de manera prolongada. Estos polímeros biodegradables particulares son unos tribloques ABA o BAB con A = poliláctico-coglicólico (PLAGA) o poliláctico (PLA) y B = polietilenglicol. Las temperaturas de transformación líquida
La solicitud PCT WO-A-98/11874 describe formulaciones farmacéuticas que comprenden un principio activo lipófilo, un polímero gelificante (Gelrite® = goma gellan desacetilada o etilhidroxicelulosa) y un tensoactivo. La interacción polímero/tensoactivo y eventualmente, tratándose del polímero Gelrite®, la única presencia de electrólitos tales como iones Ca++ en concentración fisiológica conduce a la formación de un gel constituido por un agregado de polímero/tensoactivo, al que se enlaza de manera no covalente el principio activo lipófilo. Esta formulación está destinada a una administración local en un órgano diana (el ojo, por ejemplo). La asociación de agregado/principio activo que se forma in situ permite la lenta liberación del principio activo en el órgano diana.
Un tercer enfoque realizado para intentar prolongar la duración de acción de una proteína conservando al mismo tiempo su bioactividad, fue usar una proteína terapéutica no desnaturalizada e incorporarla en microesferas o implantes a base de polímeros biocompatibles. Este enfoque está en particular ilustrado por la patente US-B-6 500 448 y la solicitud US-A-2003/0133980 que describen una composición de liberación prolongada de una hormona humana de crecimiento (hGH) en la que la proteína hormonal, previamente...
Reivindicaciones:
1. Formulación farmacéutica líquida para la liberación prolongada de principio(s) activo(s) -PA-, comprendiendo esta formulación al menos un principio activo PA, preferentemente en solución acuosa, y una suspensión coloidal, acuosa, de baja viscosidad, a base de partículas submicrónicas de polímero (PO) biodegradable, hidrosoluble y portador de grupos hidrófobos (GH), siendo dichas partículas asociadas de manera no covalente con dicho principio activo (PA),
Caracterizada porque:
2. Formulación farmacéutica líquida para la liberación prolongada de principio(s) activo(s) -PA-, siendo esta formulación:
caracterizada porque su concentración en [PO] está fijada a un valor suficientemente elevado para permitir la formación de depósito gelificado in vitro, en presencia de al menos una proteína.
3. Formulación, según cualquiera de las reivindicaciones anteriores, caracterizada porque su concentración en [PO] es tal que:
representando C1 la concentración de "gelificación inducida" de las partículas de PO tal como se mide en un ensayo GI.
4. Formulación, según cualquiera de las reivindicaciones anteriores, caracterizada porque su viscosidad es inferior o igual a 5 Pa.s.
5. Formulación, según cualquiera de las reivindicaciones anteriores, caracterizada porque los polímeros modificados hidrófobos PO se seleccionan del grupo que comprende: poliaminoácios, polisacáridos preferentemente en el subgrupo que comprende pululanos y/o quitosanos y/o mucopolisacáridos, gelatinas, o sus mezclas.
6. Formulación, según cualquiera de las reivindicaciones anteriores, caracterizada porque los grupos hidrófobos (GH) se sitúan lateralmente en la cadena.
7. Formulación, según cualquiera de las reivindicaciones anteriores, caracterizada porque el polímero (PO) es un poliaminoácido formado por unidades de ácido aspártico y/o unidades de ácido glutámico, siendo al menos una parte de estas unidades portadora de injertos que comprenden al menos un grupo hidrófobo (GH).
8. Formulación, según la reivindicación 7, caracterizado porque el (los) PO se ha definido(n) mediante la fórmula general (I) siguiente:
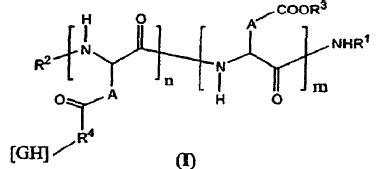
en la que:
9. Formulación, según la reivindicación 7, caracterizada porque el (o los) PO responde(n) a una de las fórmulas generales (II), (III) y (IV) siguientes:
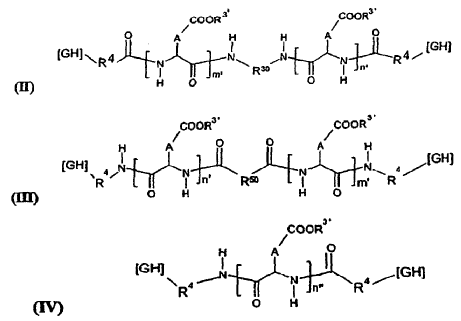
en las que:
10. Formulación, según la reivindicación 8 ó 9, caracterizada porque los grupos GH del PO representan cada uno independientemente entre sí un radical monovalente de fórmula siguiente:
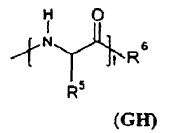
en la que:
11. Formulación, según la reivindicación 10, caracterizada porque todo o parte de los radicales hidrófobos R6 de los PO se eligen de manera independiente del grupo de radicales que comprende:
12. Formulación, según la reivindicación 10 u 11, caracterizada porque el radical hidrófobo R6 del injerto del PO procede de un precursor alcohólico elegido del grupo que comprende: el octanol, el dodecanol, el tetradecanol, el hexadecanol, el octadecanol, el oleilalcohol, el tocoferol o el colesterol.
13. Formulación, según la reivindicación 7, caracterizada porque el PO está constituido por un homopolímero de alfa-L-glutamato o de ácido alfa-L-glutámico.
14. Formulación, según la reivindicación 7, caracterizada porque el PO está constituido por un homopolímero de alfa-L-aspartato o de ácido alfa-L-aspártico.
15. Formulación, según la reivindicación 7, caracterizada porque el PO está constituido por un copolímero de alfa-L-aspartato/alfa-L-glutamato o de ácido alfa-L-aspártico/alfa-L-glutámico.
16. Formulación, según la reivindicación 15, caracterizada porque en el PO la distribución de las unidades de ácido aspártico y/o de ácido glutámico portadoras de injertos que comprenden al menos un motivo GH es tal que el polímero así constituido es aleatorio, o bien de tipo bloque o bien de tipo multibloque.
17. Formulación, según la reivindicación 1, caracterizada porque la masa molar del PO se sitúa entre 2000 y 100.000 g/mol, y preferentemente entre 5000 y 40.000 g/mol.
18. Formulación, según la reivindicación 7, caracterizada porque el PO es portador de al menos un injerto de tipo polialquilenglicol unido a una unidad glutamato y/o aspartato.
19. Formulación, según la reivindicación 18, caracterizada porque el injerto de tipo polialquilenglicol es de fórmula (V) siguiente:
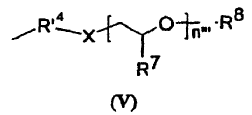
en la que:
20. Formulación, según la reivindicación 18 ó 19, caracterizada porque el polialquilenglicol es un polietilenglicol.
21. Formulación, según cualquiera de las reivindicaciones 18 a 20, caracterizada porque el porcentaje molar de injerto del polialquilenglicol varía de 1 a 30%.
22. Formulación, según cualquiera de las reivindicaciones anteriores, caracterizada porque el PA es una proteína, una glicoproteína, una proteína enlazada a una o más cadenas polialquilenglicol [preferentemente polietilenglicol (PEG): "proteína-PEGilada"], un polisacárido, un liposacárido, un oligonucleótido, un polinucleótido o un péptido,
preferentemente seleccionada entre las hemoglobinas, los citocromos, las albúminas, los interferones, las citocinas, los antígenos, los anticuerpos, la eritropoietina, la insulina, las hormonas de crecimiento, los factores VIII y IX, las interleucinas, o sus mezclas, los factores estimulantes de la hematopoiesis.
23. Formulación, según cualquiera de las reivindicaciones 1 a 21, caracterizada porque el principio activo es una "pequeña" molécula orgánica hidrófoba, hidrofílica o anfifílica.
24. Formulación, según cualquiera de las reivindicaciones 1 a 22, caracterizada porque su fracción másica en PA no asociado a las partículas submicrónicas [PA no asociado] en % en peso es tal que:
25. Formulación, según cualquiera de las reivindicaciones anteriores, caracterizada porque es inyectable por vía parenteral, subcutánea, intramuscular, intradérmica, intraperitoneal, intracerebral o en un tumor.
26. Formulación, según cualquiera de las reivindicaciones anteriores, caracterizada porque se destina a la preparación de medicamentos, en particular para la administración parenteral, subcutánea, intramuscular, intradérmica, intraperitoneal, intracerebral o en un tumor, incluso por vía oral, nasal, vaginal u ocular.
27. Procedimiento de preparación de medicamentos, en particular para la administración parenteral, subcutánea, intramuscular, intradérmica, intraperitoneal, intracerebral o en un tumor, incluso por vía oral, nasal, vaginal u ocular, caracterizado porque consiste esencialmente en realizar al menos una formulación, según cualquiera de las reivindicaciones 1 a 26.
28. Producto derivado, caracterizado porque comprende unas partículas submicrónicas, formadas por asociaciones no covalentes PO/PA tales como se han definido en la reivindicación 1, y porque se obtiene a partir de la formulación según cualquiera de las reivindicaciones 1 a 26.
29. Producto derivado, según la reivindicación 28, caracterizado porque está constituido por un polvo o por un gel.
30. Procedimiento de preparación de la formulación, según cualquiera de las reivindicaciones 1 a 26, caracterizado porque consiste esencialmente:
31. Procedimiento, según la reivindicación 30, caracterizado porque el (o los) PA está(n) en forma de suspensión o de solución acuosa para la mezcla con la suspensión coloidal de nanopartículas de PO.
32. Procedimiento de preparación de la formulación, según cualquiera de las reivindicaciones 1 a 26, caracterizado porque consiste esencialmente:
33. Procedimiento de preparación de la formulación, según cualquiera de las reivindicaciones 1 a 26, caracterizado porque consiste esencialmente:
34. Procedimiento de preparación de un polvo derivado de la formulación, según cualquiera de las reivindicaciones 1 a 26, caracterizado porque dicho polvo se obtiene mediante secado de la formulación, según cualquiera de las reivindicaciones 1 a 26.
Patentes similares o relacionadas:
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Marcador molecular para células madre cancerosas, del 29 de Abril de 2020, de Sapporo Medical University: Un péptido seleccionado del grupo que consiste en: DNAJB8 : AFMEAFSSF (SEQ ID NO: 71); DNAJB8 : AYRKLALRW (SEQ ID NO: 68); y DNAJB8 : […]
Variantes de clorotoxina, conjugados y métodos para su utilización, del 8 de Abril de 2020, de FRED HUTCHINSON CANCER RESEARCH CENTER: Conjugado de clorotoxina que comprende un péptido de clorotoxina acoplado covalentemente a un marcador fluorescente seleccionado del grupo que consiste […]
Composición que contiene coenzima Q10, del 25 de Marzo de 2020, de KANEKA CORPORATION: Una composición que contiene coenzima Q10, que comprende 1-70% en peso de coenzima Q10 (A), 15-94% en peso de caseína (B) y al menos 5% en peso de un sacárido […]
Composiciones y métodos para la embolización viral, del 19 de Febrero de 2020, de Sillajen, Inc: Una composición que comprende un virus oncolítico Poxviridae o Herpesviridae y una micropartícula biocompatible o un agente de gel de polímero […]
Cápsulas blandas llenas de líquido, del 12 de Febrero de 2020, de Patheon Softgels Inc: Una composición farmacéutica que comprende una forma de dosificación blanda que comprende un revestimiento que encapsula una matriz líquida, […]
Partículas que contienen un factor de crecimiento y usos de las mismas, del 8 de Enero de 2020, de INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE: Partícula que contiene al menos un polisacárido reticulado covalentemente y al menos un factor de crecimiento, comprendiendo además dicha […]
Un polipéptido de dímero CCL20 bloqueado modificado por ingeniería, del 8 de Enero de 2020, de The Medical College of Wisconsin, Inc: Un polipéptido de dímero CCL20 bloqueado, en donde el dímero comprende dos monómeros unidos covalentemente entre sí, en donde los dos monómeros […]