EXTRACTO DE MATERIAL VEGETAL DEL GÉNERO CROCUS L. CON ALTA ACTIVIDAD BIOINSECTICIDA.
Extracto de material vegetal del género Crocus L. con alta actividad bioinsecticida.
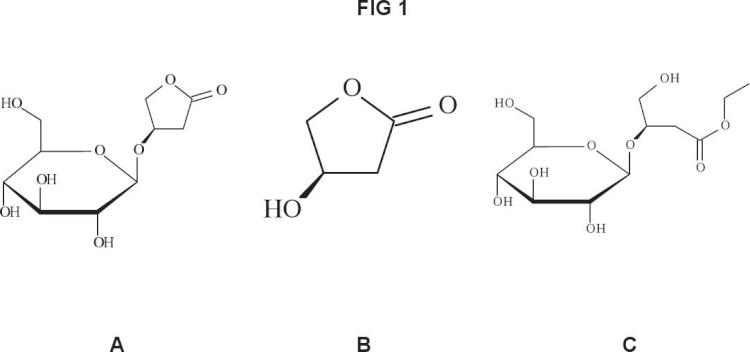
Las plagas de insectos fitófagos afectan una gran variedad de cultivos y tienen especial relevancia en sistemas agrícolas sostenibles donde los productos de síntesis están restringidos. La presente invención reivindica un extracto alcohólico de material vegetal del género Crocus L. con alta actividad bioinsecticida, que se caracteriza por comprender 3-O-β-D-glucopiranosil-(3R)-hidroxibutanolida, por ser fácilmente obtenible y por estar exento de problemas de toxicidad. La invención también reivindica el procedimiento de obtención del extracto; una composición fitosanitaria que lo comprende; el uso como bioinsecticida del extracto, de la composición fitosanitaria y de compuestos presentes en el extracto que se identifican por primera vez con actividad bioinsecticida; así como un método de control de plagas de insectos.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201430622.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC).
Nacionalidad solicitante: España.
Inventor/es: GONZALEZ COLOMA, AZUCENA, REINA ARTILES,MATÍAS, LACRET PIMIENTA,Rodney Roland, NIEUEWENHUIJS-BERBEE,Alleta, SANTANA MERIDAS,Omar.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A01N43/16 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01N CONSERVACION DE CUERPOS HUMANOS O ANIMALES O DE VEGETALES O DE PARTES DE ELLOS (conservación de alimentos o productos alimenticios A23 ); BIOCIDAS, p. ej. EN TANTO QUE SEAN DESINFECTANTES, PESTICIDAS O HERBICIDAS (preparaciones de uso médico, dental o para el aseo que eliminan o previenen el crecimiento o la proliferación de organismos no deseados A61K ); PRODUCTOS QUE ATRAEN O REPELEN A LOS ANIMALES; REGULADORES DEL CRECIMIENTO DE LOS VEGETALES. › A01N 43/00 Biocidas, productos que atraen o repelen a los animales perjudiciales, o reguladores del crecimiento de los vegetales, que contienen compuestos heterocíclicos (que contienen anhídridos cíclicos, imidas cíclicas A01N 37/00; que contienen compuestos de fórmula , que no tienen más que un heterociclo en los que m≥1 y n≥0 y es una pirrolidina, una piperidina, una morfolina, una tiomorfolina, una piperazina o una polimetilenoimina, no sustituida o sustituida por un alcoilo, que tiene al menos cuatro grupos CH 2 A01N 33/00 - A01N 41/12; que contienen ácidos ciclopropanocarbhoxílicos o sus derivados, p. ej. ésteres con heterociclos, A01N 53/00). › con oxígeno como heteroátomo del ciclo.
PDF original: ES-2552708_A1.pdf
Patentes similares o relacionadas:
Uso de oligómeros de alginato para reforzar los efectos de agentes antifúngicos, del 18 de Marzo de 2020, de ALGIPHARMA AS: Un método in vitro para combatir la colonización de un sitio con un hongo, que no está en una biopelícula, comprendiendo dicho método poner […]
Composición que comprende quitosano, glucosamina y aminoácidos para uso agrícola, del 18 de Marzo de 2020, de Agrinos AS: Una composición que comprende HYTd, en la que dicho HYTd comprende la fracción líquida obtenida de la fermentación de HYTb e HYTc con HQE activado (designación […]
Composición que contiene monocaprilato de sorbitano y piroctona olamina, del 19 de Febrero de 2020, de CLARIANT INTERNATIONAL LTD.: Uso de monocaprilato de sorbitano para la mejora de la eficacia antibacteriana de piroctona olamina.
Composiciones y métodos para mejorar el crecimiento vegetal, del 4 de Diciembre de 2019, de FMC CORPORATION: Una composición que comprende: a) bifentrina; b) al menos un promotor del crecimiento vegetal seleccionado del grupo que consiste en lipo-quito-oligosacáridos […]
Composiciones de biopesticida que comprenden polioles solubles en agua, del 27 de Noviembre de 2019, de Mustgrow Biologics Corp: Una composición líquida que comprende un precursor de biopesticida inactivo y menos de 0,5 % (p/p) de productos de degradación de glucosinolato, […]
Materiales recubiertos con bioflavonoides, del 6 de Noviembre de 2019, de Citrox Biosciences Limited: Un material polimérico sintético que tiene un recubrimiento con bioflavonoides, comprendiendo el contenido de bioflavonoides del recubrimiento al menos naringina y neohesperidina, […]
Composición que comprende una sustancia atrayente de artrópodos dañinos formada a partir de componentes de origen vegetal y análogos de los mismos, del 11 de Septiembre de 2019, de KYOYU AGRI CO., LTD.: Una composición para atraer sinérgicamente artrópodos nocivos que comprende una combinación de panisaldehído y nicotinato etílico.
Agentes potenciadores para proteger las plantas contra infecciones fúngicas, del 21 de Agosto de 2019, de UNIVERSITE D'ANGERS: Un método para prevenir, controlar o tratar una infección fúngica en un órgano de la planta que comprende aplicar a dicho órgano de la planta una composición que comprende un […]