Composición para inhibir la expresión de un gen diana.
Una composición que comprende un liposoma con ARN encapsulado,
en el que el ARN comprende unasecuencia que consiste en de 15 a 30 nucleótidos contiguos de un ARNm del gen diana y una secuenciacomplementaria a la secuencia, y el ARN tiene una acción de supresión de la expresión del gen diana que usa elARN de interferencia ( ANRi), y el liposoma comprende:
partículas complejas que comprenden como componentes constituyentes:
(i) una partícula principal que comprende un lípido catiónico y
(ii) el ARN, yuna membrana lipídica para recubrimiento de las partículas complejas y la membrana lipídica contiene,como componentes constituyentes, un lípido neutro y un derivado lipídico, un derivado de ácido graso oun derivado de hidrocarburo alifático, de una sustancia hidrosoluble,
en la que el derivado lipídico, el derivado de ácido graso o el derivado de hidrocarburo alifático de unasustancia hidrosoluble se selecciona del grupo que consiste en un lípido de polietileno glicolado, un ésterde ácido graso de polietilenglicolsorbitano, un éster de ácido graso de polietilenglicol, un lípidopoliglicerolado y un éster de ácido graso de poliglicerol, en el que el liposoma es capaz de alcanzar untejido o un órgano que incluye un sitio de expresión del gen diana y tiene un tamaño que permite laadministración intravenosa.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2005/019526.
Solicitante: KYOWA HAKKO KIRIN CO., LTD..
Nacionalidad solicitante: Japón.
Dirección: 1-6-1, OHTEMACHI, CHIYODA-KU TOKYO 100-8185 JAPON.
Inventor/es: KATO, YASUKI, YAMAUCHI,MASAHIRO, TOTTORI,Tsuneaki, ISHIHARA,Atsushi, YAGI,Nobuhiro.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/713 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Acidos nucleicos u oligonucleótidos con estructura en doble hélice.
- A61K47/44 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Aceites, grasas o ceras previstas en dos o más grupos de A61K 47/02 - A61K 47/42; Aceites naturales o aceites naturales modificados, grasas o ceras, p. ej. aceite de ricino, aceite de ricino polietoxilado, cera Montana, lignito, goma laca, colofonía, cera de abeja o lanolina (glicéridos sintéticos, p. ej. triglicéridos de cadena mediana, A61K 47/14).
- A61K9/127 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Liposomas.
- C12N15/113 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Acidos nucleicos no codificantes que modulan la expresión de genes, p.ej. oligonucleótidos antisentido.
PDF original: ES-2386549_T3.pdf
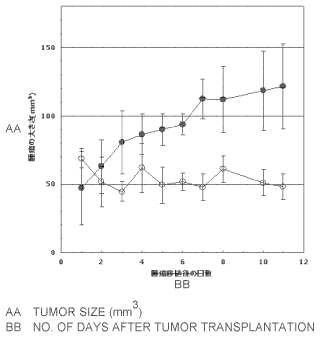
Fragmento de la descripción:
Composición para inhibir la expresión de un gen diana
Campo de la técnica
La presente invención se refiere a una composición para suprimir la expresión de un gen diana y similares.
Técnica anterior
Como procedimiento para suprimir la expresión de un gen diana se conocen, por ejemplo, un procedimiento que usa ARN de interferencia (en lo sucesivo en el presente documento ARNi) y similares, y, específicamente, se ha comunicado un fenómeno en el que cuando se introduce un ARN bicatenario que tiene una secuencia idéntica a la de un gen diana en Nematoda, la expresión del gen diana se suprime específicamente (véase "Nature", Vol. 391, No. 6669, pág. 806-811, 1998) . Además, se ha descubierto que, incluso cuando se introduce en Drosophila un ARN bicatenario con una longitud de 21 a 23 nucleótidos en lugar de un ARN bicatenario largo, se suprime la expresión de un gen diana. Esto se denomina ARN corto de interferencia (ARNsi) (véase la publicación internacional nº WO 01/75164) .
En el caso de las células de mamífero, cuando se introdujo un ARN bicatenario largo se produjo apoptosis como resultado de las funciones del mecanismo de defensa del virus y, por tanto, no se pudo suprimir la expresión de un gen específico. No obstante, se ha descubierto que cuando se usa ARNsi que tiene una longitud de 20 a 29 nucleótidos, dicha reacción no se produce y que se puede suprimir la expresión de un gen específico. Entre otros, el ARNsi que tiene de 21 a 25 nucleótidos tiene un gran efecto de supresión de la expresión ("Nature", Vol. 411, No. 6836, pág. 494-498, 2001; "Nature Reviews Genetics", Vol. 3, No. 10, pág. 737-747, 2002; "Molecular Cell", (USA) Vol. 10, No. 3, pág. 549-561, 2002; "Nature Biotechnology", (USA) Vol. 20, No. 5, pág. 497-500, 2002) . Además, también se ha notificado que no solo un ARN bicatenario, sino también un ARN monocatenario que tiene una estructura en horquilla como resultado de hibridación intramolecular, exhibe ARNi, como con ARNsi (véase "Proceedings of the National Academy of Sciences of the United States of America", Vol. 99, No. 9, pág. 6047-6052, 2002) .
Con frecuencia el ARNi se ha verificado también en pruebas in vivo. Se ha notificado el efecto del ARNi usando ARNsi con una longitud de 50 pb o menos sobre fetos de animales (véase el documento de Patente 1) y el efecto de lo mismo sobre ratones adultos (véase el documento de Patente 2) . Además, cuando el ARNsi se administra por vía intravenosa en un feto de ratón, se ha descubierto el efecto de suprimir la expresión de un gen específico en varios órganos, como el riñón, el bazo, el pulmón, el páncreas y el hígado (véase el documento no de patente 1) . Adicionalmente se ha informado que cuando el ARNsi se administra directamente en células cerebrales, también se suprime la expresión de un gen específico (véase el documento no de patente 2) .
En el documento patente 1 y en los documentos no de patente 1 y 2, la administración in vivo de ARNsi se lleva a cabo mediante administración local o administración sistémica usando un procedimiento de infusión de una gran cantidad de una solución de ARNsi de una vez, lo que se denomina procedimiento hidrodinámico. El ARNsi es inestable en la sangre y dicho procedimiento de administración se selecciona con el fin de evitar su degradación en la sangre. No obstante, mediante la administración local, el ARNsi se puede liberar solo en las cercanías del área administrada, por lo que la eficiencia de la supresión de la expresión es, por lo general, extremadamente baja. El documento no de patente 3 divulga sistemas con base de liposomas/lípidos catiónicos formulados en diferentes proporciones molares del lípido poliamina con base de colesterol catiónico N1-colesteriloxicarbonil-3, 7-diazanonano1, 9-diamina y el lípido colaborador neutro dioleoil-L-a-fosfatidiletanolamina. Los resultados del estudio muestran sistemas con base de liposomas/lípidos catiónicos disponibles investigados median en una regulación por disminución inespecífica significativa del contenido proteico celular total a dosis óptimas para un silenciamiento e inactivación máximos de genes específicos. Por otro lado, en el procedimiento hidrodinámico, el tejido diana está generalmente limitado al hígado.
Es decir, con e fin de suprimir la expresión de un gen diana, se ha exigido el desarrollo de un procedimiento de liberar de forma eficiente un ARN capaz de suprimir la expresión del gen diana a un tejido diana mediante la administración sistémica.
Por otro lado, como medio de liberar un ácido nucleico en una célula se conoce un procedimiento de uso de liposomas catiónicos o polímeros catiónicos. No obstante, mediante el procedimiento, antes de llevar a cabo la administración intravenosa de liposomas catiónicos o polímeros catiónicos que comprenden un ácido nucleico, el ácido nucleico se elimina rápidamente de la sangre y cuando un tejido diana no es el hígado o los pulmones, por ejemplo cuando es un lugar donde hay un tumor o similar, el ácido nucleico no se puede liberar en el tejido diana y, por tanto, todavía no se ha hecho posible la expresión de una acción suficiente. De acuerdo con esto, se ha comunicado un liposoma de encapsulación de ácido nucleico (liposoma que encapsula un ácido nucleico en su interior) con lo que se solucionó el problema de la eliminación rápida de un ácido nucleico de la sangre (véanse los documentos de patente 3 a 6 y el documento no de patente 4) . En el documento de patente 3, como procedimiento de producir liposomas que comprende un ácido nucleico o similar, se ha comunicado, por ejemplo, un procedimiento de producir un liposoma de encapsulación de ODN mediante la disolución de un lípido catiónico en cloroformo con
antelación, de añadir al mismo una solución acuosa de oligodesoxinucleótido (ODN) y metanol y mezclar y centrifugar la mezcla transfiriendo de este modo un complejo del lípido catiónico y ODN a una capa de cloroformo y, después, extraer la capa de cloroformo, añadir un polietilenfosfolípido glicolado, un lípido neutro y agua a la capa de cloroformo para formar una emulsión de agua en aceite (a/a) y tratar la emulsión mediante el procedimiento de 5 evaporación de fase inversa. En el documento de patente 4 y el documento no de patente 4, se ha comunicado un procedimiento de producir un liposoma de encapsulación de ODN mediante la disolución de ODN en una solución acuosa de ácido cítrico a pH 3, 8, la adición a la solución de un lípido (en etanol) , la reducción de la concentración de etanol al 20 % en v/v para preparar un liposoma de encapsulación de ODN, realizando filtración para dimensionado, eliminando el exceso de etanol mediante diálisis y, después, realizando también la diálisis de la muestra a pH 7, 5 para extraer el ODN adherido a la superficie del liposoma. En cada procedimiento se produce un liposoma de encapsulación de un ingrediente activo, tal como un ácido nucleico. El documento de patente 5 divulga un complejo de liposoma catiónico con un ácido oligonucleico, en el que el liposoma comprende 2-O- (2-dietilaminoetil) carbamoil1, 3-O-dioleoilglicerol y un fosfolípido como ingredientes principales. El liposoma divulgado en el mismo se prepara mezclando el derivado de glicerol con el fosfolípidos y, después, dispersando la mezcla en una solución acuosa
usando, opcionalmente, una máquina de dispersión emulsionante.
Por otro lado, en el documento de patente 6 se ha comunicado que el liposoma que encapsula un ingrediente activo, como un ácido nucleico, se produce mediante un procedimiento de recubrimiento de partículas finas con una membrana lipídica en un líquido. En el procedimiento, las partículas finas se recubren con una membrana lipídica reduciendo la proporción de un disolvente orgánico polar en una solución acuosa que comprende el disolvente orgánico polar en el que las partículas finas se dispersan y se disuelve un lípido. El recubrimiento se lleva a cabo en el líquido y, por ejemplo, las partículas finas recubiertas con una membrana lipídica (partículas finas recubiertas) que tienen un tamaño adecuado para las partículas finas para inyección intravenosa y similares se producen de un modo muy eficiente. Además, como ejemplo de las partículas finas, por ejemplo un complejo que comprende un fármaco hidrosoluble y un lípido catiónico y formado mediante una interacción electrostática se indica en el documento de
patente 6. Se ha comunicado que el diámetro de partícula de las partículas finas recubiertas obtenidas mediante recubrimiento... [Seguir leyendo]
Reivindicaciones:
1. Una composición que comprende un liposoma con ARN encapsulado, en el que el ARN comprende una secuencia que consiste en de 15 a 30 nucleótidos contiguos de un ARNm del gen diana y una secuencia complementaria a la secuencia, y el ARN tiene una acción de supresión de la expresión del gen diana que usa el ARN de interferencia (ANRi) , y el liposoma comprende:
partículas complejas que comprenden como componentes constituyentes:
(i) una partícula principal que comprende un lípido catiónico y
(ii) el ARN, y
una membrana lipídica para recubrimiento de las partículas complejas y la membrana lipídica contiene, como componentes constituyentes, un lípido neutro y un derivado lipídico, un derivado de ácido graso o un derivado de hidrocarburo alifático, de una sustancia hidrosoluble,
en la que el derivado lipídico, el derivado de ácido graso o el derivado de hidrocarburo alifático de una sustancia hidrosoluble se selecciona del grupo que consiste en un lípido de polietileno glicolado, un éster de ácido graso de polietilenglicolsorbitano, un éster de ácido graso de polietilenglicol, un lípido poliglicerolado y un éster de ácido graso de poliglicerol, en el que el liposoma es capaz de alcanzar un tejido o un órgano que incluye un sitio de expresión del gen diana y tiene un tamaño que permite la administración intravenosa.
2. La composición de acuerdo con la reivindicación 1, en la que el gen diana es un gen asociado con un tumor o una inflamación.
3. La composición de acuerdo con una cualquiera de las reivindicaciones 1 o 2, en la que el gen diana es un gen asociado con la angiogénesis.
4. La composición de acuerdo con la reivindicación 1, en la que el ARNm es ARNm de KLF5.
5. La composición de acuerdo con la reivindicación 1, en la que el ARNm es ARNm de KLF5 de ser humano o de ratón.
6. La composición de acuerdo con una cualquiera de las reivindicaciones 4 o 5, en la que el ARN es un ARN bicatenario, que tiene una hebra de una secuencia que consiste en de 15 a 30 nucleótidos contiguos de ARNm de KLF5 y una hebra de una secuencia complementaria a la secuencia, excepto que los 1 a 6 nucleótidos, que son iguales o diferentes, se añaden al extremo 3’ de cada una de las hebras del mismo modo o de un modo diferente.
7. La composición de acuerdo con una cualquiera de las reivindicaciones 4 o 5, en la que el ARN es un ARN que tiene una estructura en horquilla y en la que un ARN que tiene una secuencia que consiste en de 15 a 30 nucleótidos contiguos de ARNm de KLF5 está unido a un ARN que tiene una secuencia complementaria a la secuencia mediante un oligonucleótido espaciador, y de 1 a 6 nucleótidos, que son iguales o diferentes, se añaden al extremo 3’ del mismo.
8. La composición de acuerdo con una cualquiera de las reivindicaciones 4 o 5, en la que el ARN es un ARN seleccionado del grupo que consiste en los siguientes (a) a (c) :
(a) un ARN bicatenario, que tiene una hebra de una secuencia mostrada en una cualquiera de los números de ID de SEC: 2 a 16 y una hebra de una secuencia complementaria a la secuencia, excepto que de 2 a 4 miembros, que son iguales o diferentes, seleccionada de ácidos uridílicos y ácidos desoxitimidílicos, se añaden al extremo 3’ de cada una de las hebras de un modo igual o diferente:
(b) un ARN que tiene una estructura en horquilla y en el que un ARN que tiene una secuencia mostrada en uno cualquiera de los números de SEC ID: 2 a 16 está ligado a un ARN que tiene una secuencia complementaria a la secuencia a través de un oligonucleótido espaciador que tiene 2 ácidos uridílicos o ácidos desoxitimidílicos en el extremo 5’ de la misma y de 2 a 4 miembros, que son iguales o diferentes, seleccionados de ácidos uridílicos yo ácidos desoxitimidílicos se añaden al extremo 3’ de la misma; y
(c) un ARN bicatenario, que tiene una hebra de una secuencia mostrada en uno cualquiera de los números de ID de SEC: 2 a 11 y una hebra de una secuencia complementaria a la secuencia, excepto que 2 ácidos uridílicos se añaden al extremo 3’ de cada una de las hebras.
9. La composición de acuerdo con la reivindicación 1, en la que el ARNm es ARNm de bcl2.
10. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 9, en la que los componentes constituyentes de la membrana lipídica son solubles en un disolvente orgánico polar y en la que los componentes constituyentes de la membrana lipídica y las partículas complejas son dispersables en el disolvente orgánico polar.
11. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 9, en la que el liposoma que encapsula el ARN se puede obtener mediante un procedimiento de producción que incluye las etapas de:
preparar un líquido A que contiene un disolvente orgánico polar y agua, en el que los componentes constituyentes de la membrana lipídica están disueltos y las partículas complejas están dispersas y la adición de agua al líquido A o la eliminación selectiva del disolvente orgánico polar mediante destilación, evaporación, separación en membrana semipermeable o destilación fraccional del líquido A, según los cual las partículas complejas se recubren con la membrana lipídica.
12. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 9, en la que el liposoma que encapsula el ARN se puede obtener mediante un procedimiento de producción que incluye las etapas de:
preparar una dispersión de partículas complejas y una solución o una dispersión de los componentes constituyentes de la membrana lipídica y mezclar ambos líquidos para preparar el líquido F, en el que el líquido F contiene un disolvente orgánico polar y en el que los componentes constituyentes de la membrana lipídica y las partículas complejas están dispersos, por lo cual las partículas complejas son recubiertas con la membrana lipídica.
13. La composición de acuerdo con una cualquiera de las reivindicaciones 10 a 12, en la que el disolvente orgánico polar es un alcohol.
14. La composición de acuerdo con una cualquiera de las reivindicaciones 10 a 12, en la que el disolvente orgánico polar es etanol.
15. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 14, en la que el lípido catiónico es uno
o más compuestos seleccionados de cloruro de N-[1- (2, 3-dioleoilpropil) ]-N, N, N-trimetilamonio, N-[1- (2, 3-dioleoilpropil) ]-N, N-dimetilamina, cloruro de N-[1- (2, 3-dioleiloxipropil) -N, N, N-trimetilamonio, bromuro de N-[1- (2, 3ditetradeciloxipropil) ]-N, Ndimetil-N-hidroxietilamonio .
3. [N- (N’N’-dimetilaminoetil) carbamoil colesterol.
16. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 15, en la que el derivado lipídico, el derivado de ácido graso o el derivado de hidrocarburo alifático de una sustancia hidrosoluble es polietilenglicolfosfatidiletanolamina.
17. La composición de acuerdo con una cualquiera de las reivindicaciones 1 a 16, en la que el lípido neutro es fosfatidilcolina de yema de huevo.
Patentes similares o relacionadas:
Cápsulas blandas entéricas de liberación controlada de ésteres de fumarato, del 1 de Julio de 2020, de Banner Life Sciences LLC: Una composición farmacéutica oral que comprende una cápsula blanda entérica que encapsula fumarato de monometilo suspendido en una matriz líquida […]
Composiciones tópicas que comprenden un corticosteroide y un retinoide para tratar la psoriasis, del 1 de Julio de 2020, de Bausch Health Ireland Limited: Una composición farmacéutica tópica para usar en el tratamiento de la psoriasis, la composición que comprende: (a) propionato de halobetasol […]
Formulaciones farmacéuticas de estatinas y ácidos grasos omega-3 para encapsulación, del 27 de Mayo de 2020, de Catalent Ontario Limited: Una cápsula de gelatina blanda multifase para administración oral, comprendiendo la cápsula de gelatina blanda: una forma de dosificación […]
Composición de principios activos liofilizada, del 27 de Mayo de 2020, de MedSkin Solutions Dr. Suwelack AG: Cuerpo moldeado liofilizado, caracterizado porque contiene ≥ 75% en peso de ácido ascórbico, dado el caso principios activos adicionales y < […]
Método y composiciones para el tratamiento de la psoriasis, del 29 de Abril de 2020, de Anaplasi Pharmaceuticals LLC: Una composición tópica en forma de aerosol, espuma o mousse, para el uso en el tratamiento de la psoriasis, en donde la composición comprende: a) del 30 % en […]
GEL LIPIDICO NANOESTRUCTURADO, PROCEDIMIENTO DE PREPARACION Y USO, del 23 de Abril de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS: El objeto de la invención es un gel lipídico nanoestructurado formado por intercalado de láminas y vesículas y compuesto por fosfolípidos, ácidos grasos y un alto contenido […]
GEL LIPÍDICO NANOESTRUCTURADO, PROCEDIMIENTO DE PREPARACIÓN Y USO, del 17 de Abril de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Gel lipídico nanoestructurado, procedimiento de preparación y uso. El objeto de la invención es un gel lipídico nanoestructurado formado […]
Procedimiento para la fabricación de emulsiones oftálmicas de tipo aceite en agua, del 15 de Abril de 2020, de Santen SAS: Procedimiento para la fabricación de un preconcentrado de una emulsión oftálmica de tipo aceite en agua, comprendiendo dicho procedimiento una […]