Complejo de interferón beta.
Procedimiento para producir un complejo de interferón b que tiene un polietilenglicol unido de manera específica ycovalente a un residuo de lisina en las posiciones 19 ó 134 en la secuencia de aminoácidos del interferón b o en lacorrespondiente posición a las mismas en una secuencia de aminoácidos de un mutante del interferón b,
quecomprende: unir de manera específica y covalente polietilenglicol, que tiene un peso molecular de 10.000 o superiory está activado con un grupo funcional reactivo con un grupo amino, a un residuo de lisina del interferón b según laSEQ ID NO: 1 o un mutante del interferón b según la SEQ ID NO: 1 que presenta una deleción, sustitución o adiciónde uno o varios aminoácidos, en presencia, como mínimo, de un aditivo a una concentración del 1-50% en pesoseleccionado del grupo que comprende oligosacáridos que tienen 5 o menos unidades de azúcar, monosacáridos,sus correspondientes alcoholes de azúcares y alcoholes polihídricos C2-6, a pH 5,0-8,5; y extraer, después de lareacción de unión, el interferón b no reaccionado, el polietilnglicol y los subproductos mediante la utilización de unportador de intercambio iónico para purificar y concentrar el complejo de interferón b que tiene polietilenglicol unidode manera específica y covalente a un residuo de lisina en las posiciones 19 ó 134 en la secuencia de aminoácidosdel interferón b o en la correspondiente posición a las mismas en una secuencia de aminoácidos de un mutante delinterferón b, en el que el complejo interferón b mantiene una actividad del 10% o superior de la actividad antiviral delinterferón b que no se ha unido a un polietilenglicol, cuando la actividad antiviral del interferón b se determinamediante un bioensayo utilizando células FL de amniocitos humanos y el virus sindbis o el virus de la estomatitisvesicular combinados.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/JP2004/012452.
Solicitante: TORAY INDUSTRIES, INC..
Nacionalidad solicitante: Japón.
Dirección: 1-1, NIHONBASHI-MUROMACHI 2-CHOME CHUO-KU TOKYO 103-8666 JAPON.
Inventor/es: YAMASHITA, KOJI, TANIGUCHI, TADATSUGU, DR., NARUMI,HIDEKI, TSUSHIMA,YOSHIAKI, SONE,SABUROU, SATO,MIYUKI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/21 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Interferones.
- A61K47/48
- C07K14/565 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › IFN beta.
PDF original: ES-2452640_T3.pdf
Fragmento de la descripción:
Complejo de interferón beta Sector técnico La presente invención se refiere a un complejo de interferón β que tiene polietilenglicol unido de manera específica a la lisina localizada en las posiciones 19 ó 134 en la secuencia de aminoácidos del interferón β y a un procedimiento de producción del mismo.
Técnica anterior
Es conocido que los polímeros solubles en agua, tales como el polietilenglicol, cuando se unen a biomoléculas tal como se tipifica para los fármacos de proteínas, confieren utilidad clínica de varias maneras que provocan efectos, tales como una estabilidad física y térmica mejorada, resistencia a proteasa y solubilidad, así como una volumen de distribución in vivo disminuida y una retención mejorada en la sangre (véase, Inada y otros, J. Bioact and Compatible Polymers 5, 343 (1990) ; Delgado y otros, Critical Reviews in Therapeutic Drug Carrier Systems 9, 249 (1992) ; y Katre, Advanced Drug Deliver y Reviews 10, 91 (1993) ) .
Existe un conjunto de procedimientos para unir el interferón β natural o el interferón β que tiene una estructura primaria idéntica a la del interferón β natural a un polímero soluble en agua de polietilenglicol (PEG) . Por ejemplo, Katre y otros han aplicado la modificación del grupo amino de la lisina o similar a la PEGilación del interferón β (véanse, las patentes de Estados Unidos Nos. 4766106 y 4917888 y la publicación internacional No. WO87/00056) . De manera específica, han dado a conocer un conjugado obtenido mediante la unión de un polímero soluble en agua (PEG) con un peso molecular de 300 a 100.000 al interferón β recombinante o IL-2 a través de 1 a 10 residuos de lisina en la secuencia de aminoácidos del mismo. De manera alternativa, se ha dado conocer una técnica para unir PEG a un grupo amino en una linfoquina en "Chemically modified lymphokine and production thereof" (“Linfoquina modificada químicamente y producción de la misma”) (véase, publicación de la patente de Japón (Kokai) No. 60-226821A (1985) ) . Sin embargo, en realidad, el interferón β unido con PEG mediante estos procedimientos presenta una actividad de interferón β disminuida a menos del 10% y no puede ser de uso práctico.
Previamente no se ha descrito una técnica para unir selectivamente el PEG al grupo amino de una lisina particular en el interferón β. Si es posible seleccionar y modificar de manera específica una lisina que minimiza la tasa de reducción en la actividad biológica del interferón β causada por la unión a PEG, la reducción en la cantidad total de proteínas administradas como un fármaco conduce a menos efectos secundarios para los pacientes y, además, a un control de calidad más sencillo.
Por otro lado, también se conoce un procedimiento que utiliza una alquilación reductora sin implicar residuos de lisina para unir de manera selectiva un polímero soluble en agua al extremo amino terminal del interferón a través de una reacción a pH adecuado para la activación selectiva del grupo α-amino del extremo amino terminal del interferón (véase, la publicación de patente de Japón (Kokai) No. 9-25298A (1997) ) . Sin embargo, en realidad, la PEGilación del interferón β mediante este procedimiento no proporciona una monoPEGilación y provoca una PEGilación no selectiva en cualquier residuo de lisina o el extremo N terminal, dando lugar a la generación de una mezcla heterogénea sin una actividad antiviral y una actividad inhibidora del crecimiento celular suficientes.
De manera más destacada, también se conoce que el interferón β purificado unido por el extremo N terminal con PEG presenta una actividad restante (proporción con respecto a la actividad del interferón β antes de la unión) disminuida de manera drástica cuando el PEG tiene un peso molecular superior a 20.000 y carece completamente de actividad cuando el PEG tiene un peso molecular de 40.000, tal como se da a conocer por Pepinsky y otros (véase, Pepinsky y otros, The Journal of Pharmacology and Experimental Therapeutics, volumen 297, págs. 1059-1066, (2001) ) .
En cuanto al interferón α, Bailon y otros han producido interferón α monoPEGilado de manera no selectiva en el residuo de lisina con un polímero de PEG ramificado con un peso molecular de 40.000 (Bailon y otros, Bioconjugate Chem. 12, 195 (2001) ) . Sin embargo, han dado a conocer que la actividad restante del interferón α unido con PEG con un peso molecular, como máximo, de 40.000, disminuye significativamente como en el caso con el interferón β unido por el extremo N terminal con PEG, y es del 7%.
A saber, es difícil aplicar de forma directa técnicas (el número y posición del PEG unido) que se han desarrollado para la modificación de un PEG de peso molecular bajo a PEG con un peso molecular elevado. De este modo, se requiere una técnica nueva para producir un complejo de interferón β muy activo unido con PEG con un peso molecular necesario para obtener de manera suficiente efectos, tales como una vida media circulatoria in vivo prolongada y unos valores disminuidos de depuración que conducen a la utilidad como fármaco.
Tal como se ha descrito anteriormente, hasta ahora no se ha dado a conocer una selección de un residuo de lisina para modificarse para evitar la reducción en la actividad del interferón β unido con un polímero soluble en agua de peso molecular elevado ni una técnica para este objetivo. Además, no se ha dado a conocer que la unión selectiva de un polímero soluble en agua de peso molecular elevado, tal como PEG, a cualquiera de los 11 residuos de lisina presentes en el interferón β produzca un complejo de interferón β muy activo.
El documento WO 01/15736 A2 da a conocer un conjugado que muestra una actividad de interferón β y que comprende, como mínimo, un primer grupo no polipeptídico unido de forma covalente a un polipéptido interferón β.
El documento WO 01/48052 A1 da a conocer polialquilenglicoles ramificados que tienen un peso molecular que varía de 500 a 1.000.000, así como conjugados de polialquilenglicoles ramificados e interferones, tales como el interferón β.
Características de la invención Un objetivo de la presente invención es encontrar una estructura de un complejo de interferón β que no tenga deficiencias en la actividad biológica, incluso mediante la modificación con una sustancia de peso molecular elevado, tal como polietilenglicol, y dar a conocer un procedimiento para producir dicho complejo con una eficacia elevada. De manera particular, un objetivo de la presente invención es obtener un complejo de interferón β en el que se mantenga el 10% o más de la actividad del interferón β incluso mediante la unión de PEG con un peso molecular, como máximo, de 40.000.
Los presentes inventores han llevado a cabo un conjunto de estudios para conseguir los objetivos y, en consecuencia, han encontrado que un complejo de interferón β, según la reivindicación 7, logra los objetivos indicados anteriormente.
El residuo de lisina localizado en la posición 19 se ha indicado previamente como uno de los residuos de lisina que deben eliminarse cuando el PEG se une al grupo amino del interferón β (véase la publicación internacional No. WO01/15736) . Por lo tanto, este sitio de unión no puede esperarse a partir de técnicas convencionales. En cuanto al residuo de lisina localizado en la posición 134, tampoco se ha dado a conocer hasta ahora que la unión selectiva a este sitio de una sustancia modificadora con un peso molecular elevado minimice la reducción en la actividad de interferón β.
A saber, la presente invención da a conocer un procedimiento para producir un complejo de interferón β según la reivindicación 1.
El complejo de interferón β de la presente invención presenta una solubilidad en sangre, una actividad de interferón β y una estabilidad física y biológica elevadas, y es útil como fármaco en el tratamiento, la prevención y el alivio de todos los síntomas y enfermedades a los que se aplica el interferón β.
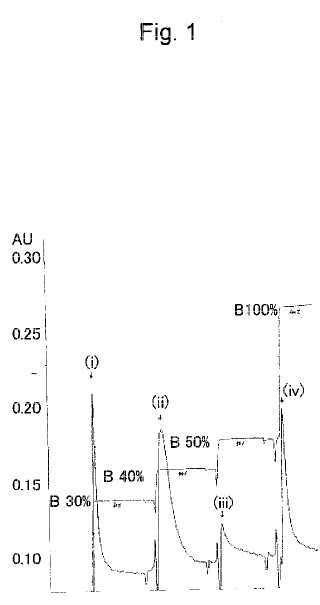
Breve descripción de los dibujos La figura 1 es un diagrama que muestra la separación y purificación en una columna Poros HS de un complejo de interferón β que tiene polietilenglicol unido al grupo amino de la lisina localizada en la posición 19. En el dibujo, la flecha superior indica la proporción de disolvente B mezclado y la flecha inferior indica la absorbancia a 280 nm;
la figura 2 es un diagrama que muestra el resultado del análisis de los componentes de los picos 1 a 4 (en el dibujo,
(i) a (iv) ) obtenidos mediante la separación y purificación... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para producir un complejo de interferón β que tiene un polietilenglicol unido de manera específica y covalente a un residuo de lisina en las posiciones 19 ó 134 en la secuencia de aminoácidos del interferón β o en la correspondiente posición a las mismas en una secuencia de aminoácidos de un mutante del interferón β, que comprende: unir de manera específica y covalente polietilenglicol, que tiene un peso molecular de 10.000 o superior y está activado con un grupo funcional reactivo con un grupo amino, a un residuo de lisina del interferón β según la SEQ ID NO: 1 o un mutante del interferón β según la SEQ ID NO: 1 que presenta una deleción, sustitución o adición de uno o varios aminoácidos, en presencia, como mínimo, de un aditivo a una concentración del 1-50% en peso seleccionado del grupo que comprende oligosacáridos que tienen 5 o menos unidades de azúcar, monosacáridos, sus correspondientes alcoholes de azúcares y alcoholes polihídricos C2-6, a pH 5, 0-8, 5; y extraer, después de la reacción de unión, el interferón β no reaccionado, el polietilnglicol y los subproductos mediante la utilización de un portador de intercambio iónico para purificar y concentrar el complejo de interferón β que tiene polietilenglicol unido de manera específica y covalente a un residuo de lisina en las posiciones 19 ó 134 en la secuencia de aminoácidos del interferón β o en la correspondiente posición a las mismas en una secuencia de aminoácidos de un mutante del interferón β, en el que el complejo interferón β mantiene una actividad del 10% o superior de la actividad antiviral del interferón β que no se ha unido a un polietilenglicol, cuando la actividad antiviral del interferón β se determina mediante un bioensayo utilizando células FL de amniocitos humanos y el virus sindbis o el virus de la estomatitis vesicular combinados.
2. Procedimiento, según la reivindicación 1, en el que el aditivo se selecciona del grupo que comprende disacáridos, monosacáridos, sus correspondientes alcoholes de azúcares y alcoholes polihídricos C2-3.
3. Procedimiento, según la reivindicación 1 ó 2, en el que el aditivo se selecciona del grupo que comprende glucosa, manitol, sorbitol, sacarosa, trehalosa, etilenglicol y glicerol.
4. Procedimiento, según cualquiera de las reivindicaciones 1 a 3, en el que el interferón β es natural o es interferón β recombinante.
5. Procedimiento, según cualquiera de las reivindicaciones 1 a 4, en el que el polietilenglicol tiene un peso molecular de 10.000 a 60.000.
6. Procedimiento, según cualquiera de las reivindicaciones 1 a 5, en el que el grupo funcional reactivo con un grupo amino tiene una estructura de éster de hidroxisuccinimida o de éster de sulfonato de nitrobenceno.
7. Complejo de interferón β, en el que el polietilenglicol que tiene un peso molecular de 10.000 o superior está unido de manera específica y covalente a un residuo de lisina en las posiciones 19 ó 134 en la secuencia de aminoácidos del interferón β según la SEQ ID NO: 1 o en la correspondiente posición a las mismas en una secuencia de aminoácidos de un mutante del interferón β según la SEQ ID NO: 1, que presenta una deleción, sustitución o adición de uno o varios aminoácidos, en el que el complejo interferón β mantiene una actividad del 10% o superior de la actividad antiviral del interferón β que no se ha unido a un polietilenglicol, cuando la actividad antiviral del interferón β se determina mediante un bioensayo utilizando células FL de amniocitos humanos y el virus sindbis o el virus de la estomatitis vesicular combinados.
8. Complejo de interferón β, según la reivindicación 7, en el que el interferón β es natural o es interferón β recombinante.
9. Complejo de interferón β, según la reivindicación 7 u 8, en el que el polietilenglicol tiene un peso molecular de
10.000 a 60.000.
10. Composición farmacéutica que comprende un complejo de interferón β, según cualquiera de las reivindicaciones 7 a 9, y un portador farmacéuticamente aceptable.
Patentes similares o relacionadas:
Derivativos del ácido siálico para la derivatización y conjugación de proteínas, del 20 de Diciembre de 2019, de LIPOXEN TECHNOLOGIES LIMITED: Un procedimiento de producción de un derivativo aldehído de un ácido siálico en el que un material de partida que tiene una unidad de ácido siálico en el […]
GELES DE QUITOSANO(A) CONTENIENDO NANOPARTICULAS METALICAS DE COBRE, PLATA Y ANTIBIOTICOS (CIPROFLOXACINO, CEFOTAXIME, GENTAMICINA Y CLOXACILINA), del 12 de Diciembre de 2019, de CARDENAS Y CIA LTDA: En la presente invención se describen geles de quitosano (poli-beta-glucosamina) con propiedades bactericidas y fungicidas en mezcla con nanopartículas […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Composiciones y métodos para la liberación dirigida de fármacos in vitro e in vivo a células de mamíferos mediante minicélulas intactas derivadas de bacterias, del 23 de Octubre de 2019, de ENGENEIC MOLECULAR DELIVERY PTY LTD: Una composición que comprende: (a) una pluralidad de minicélulas intactas derivadas de bacterias que tienen paredes celulares intactas, en donde la pluralidad […]
Moléculas con semividas prolongadas, composiciones y usos de las mismas, del 16 de Octubre de 2019, de MEDIMMUNE, LLC: Una molécula modificada que comprende una proteína o agente no de proteína y un dominio constante de IgG, en la que el dominio constante de IgG comprende un dominio CH3 humano […]
Método para la preparación de oligo etilenglicol monodisperso, del 19 de Junio de 2019, de NEKTAR THERAPEUTICS: Un método para preparar un oligo (etilenglicol) monodisperso, comprendiendo dicho método: (i) hacer reaccionar un oligo (etilenglicol) terminado […]
Construcciones de moléculas MHC y sus usos para el diagnóstico y terapia, del 29 de Mayo de 2019, de DAKO DENMARK A/S: Una construcción de moléculas MHC en forma soluble en un medio de solubilización o inmovilizada en un soporte sólido o semi-sólido, comprendiendo dicha construcción de moléculas […]
Usos terapéuticos de anticuerpos monoclonales frente al receptor de la angiotensina II tipo 1, del 17 de Mayo de 2019, de QUEEN MARY AND WESTFIELD COLLEGE: Un anticuerpo monoclonal o un fragmento del mismo que se une al péptido que consiste en la secuencia EDGIKRIQDD para su uso en el tratamiento de la proliferación […]