Células adherentes de la placenta y uso de las mismas en el tratamiento de enfermedad.
Una población de células adherentes derivadas de la placenta para el uso en el tratamiento de un defecto del músculo esquelético.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E14170266.
Solicitante: PLURISTEM LTD. .
Nacionalidad solicitante: Israel.
Dirección: MATAM BUILDING 20 31905 HAIFA ISRAEL.
Inventor/es: ABERMAN,ZAMI.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K35/50 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Placenta; Células madre de la placenta; Fluido amniótico; Amnios; Células madre del líquido amniótico.
- C12N5/073 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos embrionarios; Células o tejidos fetales.
PDF original: ES-2553712_T3.pdf
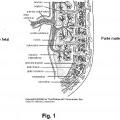


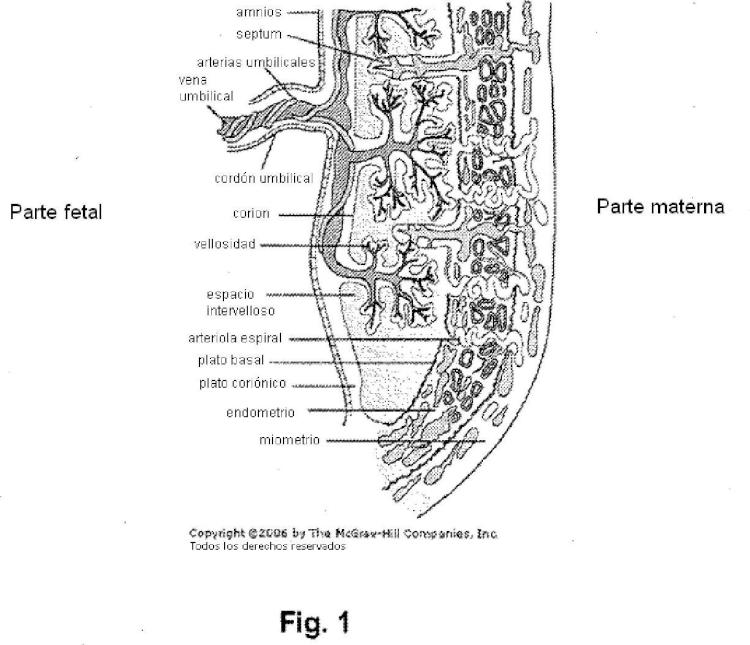
Patentes similares o relacionadas:
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Tratamiento de enfermedades, trastornos o afecciones pulmonares utilizando células placentarias, del 15 de Noviembre de 2019, de Celularity, Inc: Células madre placentarias para usar en un método para el tratamiento de una enfermedad, trastorno o afección pulmonar, en donde el método comprende la administración […]
Membrana amniótica y su uso en cicatrización de heridas y construcciones de ingeniería tisular, del 23 de Octubre de 2019, de WAKE FOREST UNIVERSITY HEALTH SCIENCES: Una composición que comprende membrana amniótica y un armazón de hidrogel que comprende un biopolímero y un polímero sintético para su uso en un […]
Supresión de tumor usando perfusato placentario humano y células asesinas naturales intermedias que provienen de placenta humana, del 16 de Julio de 2019, de Celularity, Inc: Una composición que comprende células asesinas naturales intermedias placentarias aisladas CD56+, CD16-, en donde dichas células asesinas naturales intermedias […]
Preparaciones farmacéuticas de células EPR humanas y usos de las mismas, del 5 de Junio de 2019, de Astellas Institute for Regenerative Medicine: Una composición farmacéutica que comprende: una pluralidad de células epiteliales pigmentarias de la retina (EPR); y un vehículo farmacéuticamente aceptable; […]
Supresión tumoral usando linfocitos citolíticos naturales intermedios obtenidos a partir de placenta humana y compuestos inmunomoduladores, del 22 de Mayo de 2019, de Celularity, Inc: Linfocitos citolíticos naturales aislados que comprenden linfocitos citolíticos naturales intermedios de placenta CD56+, CD16-, CD3- aislados para uso en un método […]
Preparaciones de membrana amniótica y composiciones purificadas y métodos de uso, del 17 de Mayo de 2019, de TISSUETECH, INC.: Una composición que comprende: (a) Membrana amniótica pulverizada o molida aislada de placenta congelada o previamente congelada preparada mediante pulverización […]
Poblaciones de células madre placentarias, del 30 de Abril de 2019, de Celularity, Inc: Una población de células madre de amnios-corion adherentes aisladas, en donde dichas células madre de amnios-corion expresan el gen SLC12A8 a un nivel al menos dos veces mayor […]