METODO DE ACTIVACIÓN QUÍMICA SUPERFICIAL DE UN SOPORTE SÓLIDO EN BASE SILICIO MEDIANTE ANCLAJE COVALENTE DIRECTO DE AL MENOS UNA BIOMOLÉCULA DE ÁCIDO NUCLEICO.
Método de activación química superficial de un soporte sólido en base silicio mediante anclaje covalente directo de al menos una biomolécula de ácidos nucleicos.
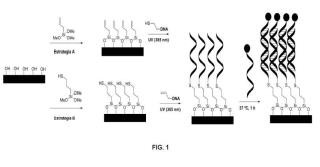
La presente invención se refiere a un método de activación química superficial por reacción tiol-eno (TEC) o tiol-ino (WC) de un soporte sólido en base silicio mediante anclaje covalente directo de al menos una biomolécula que es una secuencia de oligonucleótidos de ADN o ARN, donde a) la superficie del soporte está funcionalizada con grupos alqueno o alquino y la biomolécula presenta un grupo tiol terminal, y/o b) la superficie del soporte está funcionalizada con grupos tiol y la biomolécula presenta un grupo alqueno o alquino terminal; dicho método comprendiendo las etapas de: depositar la secuencia de oligonucleótidos sobre la superficie del soporte mediante técnicas de impresión con o sin contacto; y anclar la secuencia de oligonucleótidos a la superficie del soporte por adición radical mediante reacción TEC o TYC provocada por fotoirradiación con luz UV cercana al visible durante un intervalo de tiempo comprendido entre 5 minutos y 3 horas, sin necesidad de emplear crosslinkers y/o catalizadores.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201331587.
Solicitante: UNIVERSITAT POLITECNICA DE VALENCIA.
Nacionalidad solicitante: España.
Inventor/es: MAQUIEIRA CATALA, ANGEL, PUCHADES PLA, ROSA, GRIJALVO TORRIJO,SANTIAGO, BAÑULS POLO,MARIA JOSE, ERITJA CASADELLÁ,Ramón, ESCORIHUELA FUENTES,Jorge.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- B01J19/12 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01J PROCEDIMIENTOS QUÍMICOS O FÍSICOS, p. ej. CATÁLISIS O QUÍMICA DE LOS COLOIDES; APARATOS ADECUADOS. › B01J 19/00 Procedimientos químicos, físicos o físico-químicos en general; Aparatos apropiados. › utilizando radiaciones electromagnéticas.
- C07F7/08 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07F COMPUESTOS ACICLICOS, CARBOCICLICOS O HETEROCICLICOS QUE CONTIENEN ELEMENTOS DISTINTOS DEL CARBONO, HIDROGENO, HALOGENOS, OXIGENO, NITROGENO, AZUFRE, SELENIO O TELURO (porfirinas que contienen metal C07D 487/22; compuestos macromoleculares C08). › C07F 7/00 Compuestos que contienen elementos de los grupos 4 o 14 del sistema periódico. › Compuestos que tienen uno o más enlaces C— Si.
- C07H21/00 C07 […] › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos.
- G01N1/28 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 1/00 Muestreo; Preparación de muestras para la investigación (manipulación de materiales para un análisis automático G01N 35/00). › Preparación de muestras para el análisis (montaje de muestras sobre las placas del microscopio G02B 21/34; medios de soporte para los objetos o para los materiales a examinar en un microscopio electrónico H01J 37/20).
- G01N33/50 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
Fragmento de la descripción:
Método de activación química superficial de un soporte sólido en base silicio mediante anclaje covalente directo de al menos una biomolécula de ácido nucleico
Campo técnico de la invención
La invención se enmarca en el sector técnico de la Química y la Biotecnología, centrándose en el empleo de reacciones de click chemistry (TEC -tiol-eno- y TYC -tiol-ino-) para inmovilizar de manera covalente y especialmente con localización espacial sondas de ácidos nucleicos sobre soportes en base silicio. También se centra en el método de modificación de las sondas de ácidos nucleicos (ANs) para permitir dicho anclaje.
Antecedentes de la invención
Las tecnologías de microarray son una potente plataforma de ensayo con diversas aplicaciones de gran interés. Sus principales ventajas son su formato miniaturizado y su alta capacidad de trabajo que ofrece la posibilidad de realizar múltiples ensayos en paralelo y con una disposición espacial prefijada.
En su sentido más simple, una matriz de ADN (o ARN) o sonda se define como una disposición ordenada de moléculas únicas de ácidos nucleicos (ANs) de secuencia conocida (P. Baldi, G.W. Hatfield: DNA Microarrays and Gene expression: Form Experiments to Data Analysis and Modeling, Cambridge University Press, Cambridge, 2011, pp 7-15). En el desarrollo de una química útil y fiable para la producción de matrices de ADN con prestaciones competitivas, son parámetros críticos a considerar: la accesibilidad y la funcionalidad del ADN unido a la superficie, la densidad de inmovilización, la estabilidad de la matriz, la reproducibilidad de la química de fijación, y la especificidad de las secuencias de anclaje. El desarrollo de derivatizaciones químicas superficiales eficientes para la fabricación de micromatrices de ADN sobre soportes sólidos se ha convertido, por tanto en esencial para el desarrollo de la tecnología de chips de ADN.
Como la mayoría de las superficies sólidas no poseen de manera original la estructura química necesaria para la adecuada inmovilización de moléculas de ADN, se han implementado diferentes metodologías de fijación. Los métodos típicos implican la generación de grupos funcionales activos en la superficie, que reaccionan covalentemente con la sonda de ADN, que a su vez ha sido modificada con el grupo funcional adecuado. En casi todas las ocasiones, es necesario emplear agentes de entrecruzamiento, conocidos
como crosslinkers, para lograr la unión entre el grupo funcional de la sonda y el de la superficie. Si nos centramos en soportes de base silicio (incluyendo vidrio, óxido de silicio, nitruro de silicio y silicio, entre los más importantes sin ser limitantes), la química de los organosilanos han sido la más ampliamente utilizada para la modificación superficial (D.K. Aswal, S. Lenfant, D. Guerin, J.V. Yakhami, D. Villaume, Anal. Chim. Acta 568 (2006) 84- 108; M. Stutzmann, J. A. Garrido, M. Eickhoff, M. S. Brandt, Phys. Status Solidi A 203 (2006) 3424-3437; R.J. Hamers, Annu. Rev. Anal. Chem. 1 (2008) 707-736; J.N. Chazalviel, P. Allongue, A.C. Gouget-Laemmel, C. Henry de Villeneuve, A. Moraillon, F. Ozanam, Sci. Adv. Mater. 3 (2011) 332-353).
Sin embargo, estos métodos no son capaces de realizar la inmovilización de sondas de ADN con selectividad espacial. Esto, actualmente, sólo se consigue de dos maneras:
1) Por microimpresión de contacto (microcontact printing, pCP) o por nanolitografía de plumillas deslizantes (dip-pen nanolithography DPN). La técnica de pCP permite la inmovilización de biomoléculas en un solo paso de impresión sobre una gran superficie, siguiendo un patrón (que se define por la forma que tiene el sello utilizado para la impresión y que generalmente está hecho de polidimetoxisiloxano (PDMS). Se alcanzan dimensiones de resolución por debajo de 1 pm y presenta la ventaja de la rapidez y la desventaja de imprimir un único tipo de biomoléculas por toda la superficie. La técnica de DPN tiene mucha más resolución (por debajo de 100 nm) pero es mucho más lenta, puesto que la impresión es secuencial. Por otro lado, al ser secuencial, presenta la ventaja de poder imprimir biomoléculas de diferente naturaleza sobre la misma superficie.
2) Por irradiación a través de una fotomáscara. Los métodos de inmovilización de biomoléculas basados en luz son una aproximación flexible y alternativa a las anteriores para la fabricación de biochips. Permiten la inmovilización de distintos tipos de moléculas sobre la superficie y alcanzan una resolución en el patronaje de la superficie del orden de nanómetros (como ejemplo, los chips de ANs de Affimetrix ( www.affymetrix.com ) inmovilizan miles de sondas en soportes de 1 cm de lado). Sin embargo, los métodos desarrollados hasta el momento -generalmente basados en la síntesis en fase sólida, nucleótido a nucleótido, de las sondas- usan grupos protectores que se fotodesprotegen o bien grupos reactivos que se fotoactivan. Esto implica el uso de pasos adicionales de reacción para la protección/activación de dichos grupos. Además, en los casos en que la longitud de onda utilizada es menor de 300 nm, existe el riesgo de dañar irreversiblemente a la molécula responsable del bioreconocimiento en el bioensayo. Por tanto, el desarrollo de métodos de fotoinmovilización que impliquen un solo paso y que sean biocompatibles sigue siendo de gran interés para el desarrollo de nuevas vías de inmovilización.
La reacción conocida como TEC (thiol-ene coupling) implica la unión de un grupo sulfhidrilo (o tiol) con un alqueno en presencia de fuentes de radicales o por irradiación con luz. Esta reacción ha demostrado ser un método de unión robusto con la gran mayoría de los atributos de las reacciones de click chemistry de acuerdo con la guía formulada por Sharpless y colaboradores en 2001 (H.C. Kolb, M.G. Finn, K.B. Sharpless, Angew. Chem. Int. Ed., 2001, 40, 2004-2021). Así, posee las características de ortogonalidad con otros procedimientos sintéticos comunes, condiciones de reacción muy suaves, uso de catalizadores y disolventes inocuos (en esta reacción el catalizador es la luz, y la reacción se lleva a cabo en agua), alta velocidad de reacción, insensibilidad a la presencia de oxígeno, regioselectividad completa, facilidad de manejo, y altos rendimientos. Es por tanto, entendible que haya encontrado numerosas aplicaciones (C.E. Hoyle, A.B. Lowe, C.N. Bowman, Chem. Soc. Rev., 2010, 39, 1355; y A.B. Lowe, Polym. Chem. 2010, 1, 17-36) en campos como polímeros y síntesis de materiales para recubrimiento dental, lentes de contacto, adhesivos y procesos fotolitográficos, entre otros.
También se encuentran descritas aplicaciones de la reacción TEC para bioconjugación (ver las tres referencias anteriores). Wittrock et al. (S. Wittrock, T. Becker, H. Kunz, Angew. Chem. Int. Ed., 2007, 46, 5226-5230) emplean la reacción TEC para unir un sacárido asociado a la formación de tumores a modo de antígeno con una proteína (BSA) transportadora y así desarrollar una vacuna antitumoral. Existen otros ejemplos de empleo de la reacción TEC para aplicaciones relacionadas con glicoconjugaciones que pueden encontrarse recopiladas en el artículo de revisión de Dondoni y Marra (A. Dondoni, A. Marra, Chem. Soc. Rev., 2012, 41, 573-586). Con respecto a las aplicaciones reportadas hasta el momento de la reacción TEC en la construcción de microarrays se encuentran únicamente los trabajos desarrollados por Waldmann y colaboradores (P. Jonkheijm, D. Weinrich, M. Kóhn, H. Engelkamp, P.C.M. Christianene, J. Kuhlman, J.C. Maan, D. Nüssse, H. Schroeder, R. Wacker, R. Breinbauer, C. M. Niemeyer, H. Waldmann, Angew. Chem. Int. Ed., 2008, 47, 4421-4424; y D. Weinrich, M. Kóhn, P. Jonkheijm, U. Westerlind, L. Dehmelt, H. Engelkamp, P. C. M. Christianene, J. Kuhlmann, J. C. Maan, D. Nüsse, H. Schróder, R. Wacker, E. Voges, R. Breinbauer, H. Kunz, C. M. Niemeyer, H. Waldmann, ChemBioChem.2010, 11, 235-247), y el de Gupta et al. (N. Gupta, B. F. Lin, L. M. Campos, M. D. Dimitrou, S. Hikita, N. D. Treat, M. V. Tirrel, D. O. Clegg, E. J. Kramer, C. J. Hawker, Nature Chem., 2010, 2, 138-145). Los primeros usan superficies de óxido de silicio y de vidrio que son modificadas con grupos tiol o alqueno y que se emplean para unir un derivado alquenilado o tiolado de biotina dibujando un patrón determinado, para ello emplean la
irradiación a través de una fotomáscara. También describen el empleo de oligonucleótidos tiolados para el anclaje a las superficies modificadas pero a través de un dendrímero y no directamente a la superficie. En cualquier caso, los métodos empleados requieren de varios pasos y, en todos los casos, del empleo de algún crosslinker. Por otro lado, Gupta et al. (ver referencia anterior) describen la construcción de un microarray...
Reivindicaciones:
1. Un método de activación química superficial por reacción tiol-eno o tiol-ino de un soporte sólido en base silicio mediante anclaje covalente directo de al menos una biomolécula que es una secuencia de oligonucleótidos de ADN ó ARN, donde A) la superficie del soporte está funcionalizada con grupos alqueno o alquino y la secuencia de oligonucleótidos presenta un grupo tiol terminal, y/o B) la superficie del soporte está funcionalizada con grupos tiol y la secuencia de oligonucleótidos presenta un grupo alqueno o alquino terminal; dicho método comprendiendo las etapas de:
I) depositar la biomolécula sobre la superficie del soporte mediante técnicas de impresión
con o sin contacto; y
II) anclar la biomolécula a la superficie del soporte por adición radical mediante reacción
del grupo alqueno o alquino con el grupo tiol provocada por fotoirradiación con luz ultravioleta de longitud de onda de 320 nm a 400 nm, durante un intervalo de tiempo comprendido entre 5 minutos y 3 horas, en ausencia de crosslinkers y catalizadores.
2. El método según la reivindicación anterior, donde la superficie del soporte está funcionalizada simultáneamente con grupos tiol y con grupos alqueno o alquino, y la activación química se lleva a cabo empleando tanto secuencias de oligonucleótidos con un grupo tiol terminal como secuencias de oligonucleótidos con un grupo alqueno o alquino terminal.
3. El método según una cualquiera de las reivindicaciones anteriores, donde el soporte en base silicio es seleccionado dentro del grupo compuesto por óxido de silicio, nitruro de silicio, silicio y vidrio.
4. El método según la reivindicación anterior, donde el soporte en base silicio es un chip.
5. El método según una cualquiera de las reivindicaciones anteriores, donde la superficie del soporte está funcionalizada mediante compuestos organosilanos que comprenden en su extremo una agrupación seleccionada entre tiol, alqueno o alquino.
6. El método según la reivindicación anterior, donde el compuesto organosilano es seleccionado entre un clorosilano y un alcoxisilano.
7. El método según una cualquiera de las reivindicaciones anteriores, que comprende una etapa previa a la deposición de la biomolécula en la superficie del soporte en la que dicha
superficie se funcionaliza introduciendo los grupos alqueno o alquino y/o los grupos tiol mediante reacción de condensación con compuestos organosilanos, de fórmula general R2- Si(Y1)3, siendo: Y1=R1O-, R1- ó Cl-, siendo R1 una cadena hidrocarbonada de 1 a4 carbonos; y R2 una cadena hidrocarbonada lineal o ramificada, de entre 1 y 20 átomos, opcionalmente sustituida con uno o varios sustituyentes y que comprende entre 0 y 6 heteroátomos, preferentemente N u O, y que contiene en su extremo uno de los siguientes grupos -SH; -CH=CH2; ó -CzCH.
8. El método según una cualquiera de las reivindicaciones 6 ó 7, donde los compuestos organosilanos son seleccionados dentro del grupo compuesto por: 3-mercaptopropil trietoxisilano, alil trimetoxisilano, vinil trimetoxisilano y 3-glicidoxipropiltrimetoxisilano con propargilamina.
9. El método según una cualquiera de las reivindicaciones anteriores, donde la biomolécula es una sonda de ácidos nucleicos de longitud comprendida entre 5 y 50 bases.
10. El método según una cualquiera de las reivindicaciones anteriores, donde la biomolécula presenta el grupo tiol o el grupo alqueno o alquino en el extremo 5.
11. El método según una cualquiera de las reivindicaciones anteriores, donde la biomolécula presenta el grupo tiol, el grupo alqueno o el grupo alquino en el extremo de un espaciador que es una cadena hidrocarbonada lineal o ramificada de entre 1 y 20 átomos, opcionalmente sustituida con uno o varios sustituyentes, y que comprende entre 0 y 6 heteroátomos, preferentemente oxígeno.
12. El método según la reivindicación anterior, donde el espaciador es seleccionado entre un compuesto alquilo alifático de entre 1 y 20 carbonos o un poliglicol.
13. El método según una cualquiera de las reivindicaciones 11 ó 12, donde el grupo tiol y el
espaciador forman un compuesto tiolado de fórmula alquilo(C1-C20)-SH ó
(CH2CH2O)n(CH2)mSH; el grupo alqueno y el espaciador forman un compuesto alquenilado de fórmula alquilo(C1-C20)-CH=CH2 ó (CH2CH2O)n(CH2)mCH=CH2; y el grupo alquino y el espaciador forman un compuesto alquinilado de fórmula alquilo(C1-C20)-CECH ó (CH2CH2O)n(CH2)mCECH; siendo n un numero entero entre 1 y 6 y m un número entero entre 1 y 3.
14. El método según una cualquiera de las reivindicaciones anteriores, donde la biomolécula es seleccionada dentro del grupo compuesto por:
- 5-X- CCCGATTGACCAGCTAGCATT-3;
- 5-X-CCCGATT GACCTGCTAGCATT-3;
- 5-X- CCCGATTGATTAGCTAGCATT-3 y
- 5-X-CCATATTGACCAGCTATCATT-3,
donde X representa un compuesto seleccionado dentro del grupo que consiste en: un compuesto tiolado de fórmula alquilo(C1-C20)-SH ó (CH2CH2O)n(CH2)mSH; un compuesto alquenilado de fórmula alquilo(C1-C20)-CH=CH2 ó (CH2CH2O)n(CH2)mCH=CH2; o un compuesto alquinilado de fórmula alquilo(C1-C20)-CECH o (CH2CH2O)n(CH2)mCECH, siendo n un numero entero entre 1 y 6 y m un número entero entre 1 y 3; y estando unidos al extremo 5 del ácido nucleico a través de un enlace tipo fosfato.
15. El método según una cualquiera de las reivindicaciones 10 a 17, donde el compuesto alquenilado es -(CH2CH2O)nCH2CH=CH2, donde n=3, y el compuesto tiolado es -(CH2)6SH.
16. El método según una cualquiera de las reivindicaciones anteriores, que comprende preparar la biomolécula de forma previa a su deposición en la superficie del soporte, por derivatización química mediante el método del fosforamidito.
17. El método según una de las reivindicaciones anteriores, donde la impresión sin contacto se lleva a cabo mediante un impresor de micromatrices automático de no contacto con volúmenes reducidos.
18. El método según la reivindicación anterior, donde la longitud de onda de la luz ultravioleta es de 365 ± 30 nm.
19. El método según una de las reivindicaciones anteriores, donde el tiempo de irradiación está comprendido entre 10 minutos y 2 horas, incluidos ambos límites.
20. El método según una de las reivindicaciones anteriores, donde el anclaje se realiza irradiando a través de una fotomáscara que induce la fotoinmovilización covalente y de forma selectiva de la biomolécula funcionalizada sobre el soporte sin reactividad cruzada.
21. Un soporte sólido en base silicio con superficie activada químicamente mediante anclaje covalente directo y sin agentes de entrecruzamiento de al menos una biomolécula que es
una secuencia de oligonucleótidos de ADN ó ARN, obtenible por el método descrito en cualquiera de las reivindicaciones anteriores, que presenta una densidad de inmovilización de los oligonucleótidos en su superficie comprendida entre 3 y 6 pmol/cm2 y un grado de reproducibilidad con coeficiente de variación entre soportes inferior al 15%.
22. El soporte según la reivindicación anterior, donde dicho soporte es un biochip de ácidos nucleicos.
23. El soporte según una cualquiera de las reivindicaciones 21 ó 22, donde dicho soporte es 10 un biochip de ácidos nucleicos con selectividad espacial cuando la irradiación de anclaje de
la biomolécula a la superficie del soporte se aplica a través de una fotomáscara.
24. Uso del soporte descrito en una cualquiera de las reivindicaciones 21 a 23, que comprende una de las siguientes aplicaciones: medicina forense, detección de organismos
genéticamente modificados, identificación de cepas de bacterias, diagnóstico clínico y veterinaria.
Patentes similares o relacionadas:
Proteínas de unión a interleuquina-13, del 15 de Julio de 2020, de AbbVie Bahamas Ltd: Un anticuerpo anti-IL-13 recombinante, o fragmento de unión a antígeno del mismo, en donde dicho anticuerpo anti-IL-13 recombinante, o fragmento de unión a antígeno del mismo, […]
Polinucleótidos aislados y métodos y plantas que usan los mismos para regular la acidez de las plantas, del 10 de Junio de 2020, de The State of Israel, Ministry of Agriculture and Rural Development, Agricultural Research Organization, (A.R.O.), Volcani Cent: Una célula de planta o una planta que comprende una construcción de ácido nucleico que comprende una secuencia de ácido nucleico que codifica un polipéptido […]
Métodos y composiciones para modular PD1, del 13 de Mayo de 2020, de Sangamo Therapeutics, Inc: Célula aislada que comprende una inserción o una deleción en un gen de PD1 endógeno dentro de, o entre, las secuencias mostradas en SEQ ID NO: 56 y SEQ ID NO: 60 del gen de PD1 […]
Compuesto de tioéter para la protección del grupo 2''-hidroxi en nucleósidos que van a ser utilizados en la síntesis de oligonucleótidos, del 6 de Mayo de 2020, de Bonac Corporation: Un éter representado por la siguiente fórmula química : **(Ver fórmula)** en dicha fórmula química , R4 es un grupo alquilo de cadena lineal o ramificada […]
Métodos de preparación de polinucleótidos usando composiciones de sales de catiónicas multivalentes, del 6 de Mayo de 2020, de GERON CORPORATION: Un método para preparar un polinucleótido, comprendiendo el método: a) poner en contacto una primera composición polinucleotídica con una sal catiónica […]
Nucleótidos modificados para secuenciación de polinucleótidos, del 8 de Abril de 2020, de ILLUMINA CAMBRIDGE LIMITED: Una molécula de nucleótido que tiene una unidad estructural de azúcar ribosa o desoxirribosa y una base enlazada a un marcador detectable a través de […]
Análogos de oligonucleótidos que incorporan 5-aza-citosina en los mismos, del 8 de Enero de 2020, de Astex Pharmaceuticals, Inc: Un análogo de oligonucleótido aislado o sintético, o una sal o éster del mismo, de fórmula general 5'-DpG-3' o 5'-GpD-3', en los que D es decitabina; p es un […]
Nucleótidos modificados, del 1 de Enero de 2020, de ILLUMINA CAMBRIDGE LIMITED: Un kit que comprende cuatro moléculas de nucleótido trifosfato modificadas, cada una de las cuales comprende una base de purina o pirimidina y una unidad estructural […]