Composiciones que comprenden liposomas, un antígeno, un polinucleótido y un vehículo que comprende una fase continua de una sustancia hidrófoba.
Una formulación de vacuna inyectable, que comprende:
(a) un antígeno frente al que se va a inducir una respuesta inmunitaria en un sujeto en necesidad de la misma,
en el que el antígeno se selecciona entre el grupo que consiste en un antígeno derivado de una bacteria, un virus, un hongo, un parásito o una célula tumoral; un antígeno de enfermedades infecciosas; un antígeno derivado de un alérgeno animal, un alérgeno alimentario, un alérgeno de insectos, un alérgeno bacteriano, un alérgeno de fármacos, una hormona o una enzima; y un polipéptido derivado de hormona liberadora de gonadotropina, survivina o péptido beta-amiloide;
(b) liposomas;
(c) un polinucleótido polil:C; y
(d) un vehículo que consiste esencialmente en aceite o que es una emulsión de agua en aceite.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CA2009/000692.
Solicitante: IMMUNOVACCINE TECHNOLOGIES INC.
Nacionalidad solicitante: Canadá.
Dirección: 1344 Summer Street, Suite 412 Halifax, Nova Scotia B3H 0A8 CANADA.
Inventor/es: MANSOUR,MARC, SAMMATUR,LEELADHAR, MACDONALD,LISA DIANA, KARKADA,MOHAN, WEIR,GENEVIEVE MARY, FUENTES-ORTEGA,ANTAR.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61K39/39 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61K9/127 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Liposomas.
- A61P25/28 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › de los problemas neurodegenerativos del sistema nervioso central, p. ej. noótropos, activadores del conocimiento, medicamentos para el tratamiento del Alzheimer o de otras formas de demencia.
- A61P35/00 A61P […] › Agentes antineoplásicos.
- A61P37/04 A61P […] › A61P 37/00 Medicamentos para el tratamiento de problemas inmunológicos o alérgicos. › Inmunoestimulantes.
PDF original: ES-2524699_T3.pdf




Fragmento de la descripción:
Composiciones que comprenden liposomas, un antígeno, un polinucleótido y un vehículo que comprende una fase continua de una sustancia hidrófoba
Campo de la invención
La presente solicitud se refiere a composiciones que comprenden liposomas, un antígeno, un polinucleótido polil:C y un vehículo que comprende una fase continua de una sustancia hidrófoba y a su uso.
Antecedentes de la invención
Las vacunas convencionales pueden comprender un antígeno, un adyuvante y un vehículo farmacéuticamente aceptable. Se sabe que un polinucleótido polil:C puede ser útil como un adyuvante. También se sabe que los liposomas pueden ser útiles en composiciones de vacuna (véase la patente de EE.UU. 6.793.923 concedida de los solicitantes). Sin embargo, según creen los solicitantes, la técnica no enseña o sugiere la combinación de un antígeno, un polinucleótido polil:C, liposomas y un vehículo hidrófobo en una composición de vacuna.
Una composición para dirigir y modular la actividad de las células tumorales mediante la inhibición de la isoclase que cambia de IgM a IgA se divulga en el documento WO 26/5155. Las composiciones divulgadas en el mismo comprenden como compuestos activos el mitógeno de hierba carmín y polil:C, estando el polil:C incluido en un liposoma catiónico en algunas realizaciones. Se describen otras realizaciones, tales como formulaciones farmacéuticas para administración parenteral, como que incluyen soluciones acuosas de los compuestos activos en forma hidrosoluble y suspensiones de los compuestos activos preparadas como suspensiones inyectables oleosas.
Sumario de la invención
Los solicitantes han descubierto ahora que una composición según se define en la reivindicación 1 puede proporcionar sorprendentemente títulos de anticuerpos más altos y un mayor porcentaje de células T de memoria CD8+ o activadas que cualquiera de las composiciones de vacunas convencionales que contienen polinucleótidos polil:C en un vehículo acuoso, o composiciones que comprenden liposomas, un vehículo hidrófobo y un adyuvante de alumbre.
Por consiguiente, en un aspecto, la invención proporciona una composición según se define en la reivindicación 1.
En otro aspecto, la invención proporciona un método para preparar una composición, según se define en la reivindicación 6. En una realización, el antígeno está encapsulado en los liposomas. En una realización, el Polinucleótido polil:C está encapsulado en los liposomas.
La composición de la invención se puede usar como medicamento. En una realización, el medicamento es para inducir una respuesta de anticuerpos o una respuesta inmunitaria mediada por células al antígeno en el sujeto.
Otros aspectos y características de la presente invención serán evidentes para los expertos en la técnica tras la revisión de la siguiente descripción de realizaciones específicas de la invención junto con las figuras adjuntas.
Breve descripción de las figuras
En las figuras, que ilustran realizaciones de la invención a modo de ejemplo solamente:
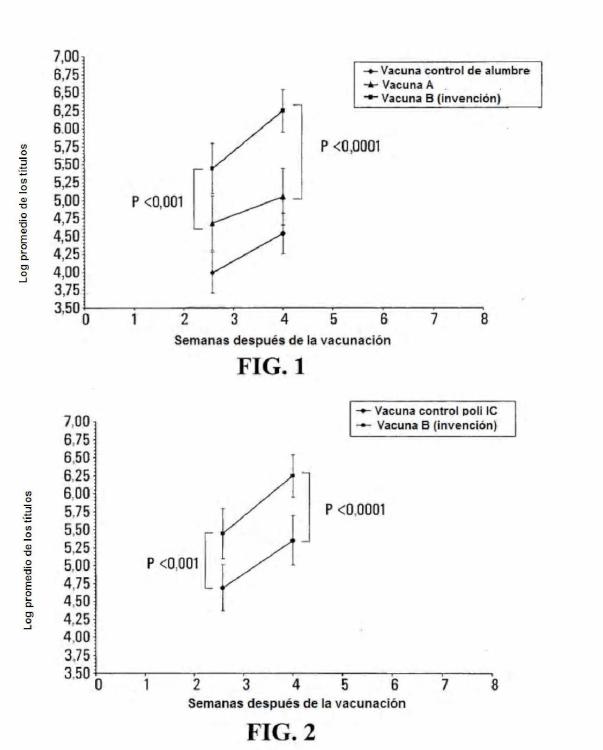
La figura 1 es un gráfico que muestra los resultados de la vacunación de tres grupos de ratones (n = 9 o 1) del siguiente modo: los ratones del grupo 1 se vacunaron con 1 microgramo de rHAy 4 microgramos de polil:C en una dosis de 3 microlitros formulada como una vacuna de liposomas/Polil:C/vehículo hidrófobo (vacuna B, la invención). Los ratones del grupo 2 se trataron con la vacuna A que comprende 1 microgramo de rHA y 6 microgramos de alumbre en una dosis de 3 microlitros de la formulación de liposoma/alumbre/vehículo hidrófobo. Los ratones del grupo 3 se vacunaron con 1 microgramo de rHA y 6 microgramos de alumbre por dosis de 3 microlitros de la vacuna de alumbre control. Las respuestas inmunitarias humorales se midieron mediante ELISA como se describe en el presente documento. Para cada grupo de tratamiento, los valores log 1 de los títulos de anticuerpos de punto final se promediaron y se calcularon las desviaciones estándar para cada punto de tiempo. Los valores p se calcularon utilizando la prueba t de Student.
La figura 2 es un gráfico que muestra los resultados de la vacunación de dos grupos de ratones (n = 9 o 1) del siguiente modo: los ratones del grupo 1 se vacunaron con 1 microgramo de rHA y 4 microgramos de polil:C en una dosis de 3 microlitros formulada como una vacuna de liposomas/Polil:C/vehículo hidrófobo (vacuna B, la invención). Los ratones del grupo 2 se vacunaron con 1 microgramo de rHA y 4 microgramos de polil:C por dosis de 3 microlitros de la vacuna polil:C control. Las respuestas inmunitarias humorales se midieron mediante ELISA como se describe en el presente documento. Para cada grupo de tratamiento, los valores Iog1 de los títulos de anticuerpos
de punto final se promediaron y se calcularon las desviaciones estándar para cada punto de tiempo. Los valores p se calcularon utilizando la prueba t de Student.
La figura 3 es un gráfico que muestra los resultados de la vacunación de dos grupos de ratones (n = 8 o 9) del siguiente modo: Los ratones del grupo 1 se vacunaron con una única dosis de 1 microgramo de rHA y 1 microgramos de PolibC en una dosis de 5 microlitros formulada como una vacuna de liposomas liofilizados/Polil:C/vehículo hidrófobo (vacuna C, la invención). Los ratones del grupo 2 se trataron con 1 microgramo de rHA y 1 microgramos de alumbre por dosis de 5 microlitros de la vacuna de alumbre control; se administró un refuerzo a los ratones 21 días después de la vacunación. Las respuestas inmunitarias humorales se midieron mediante ELISA como se describe en el presente documento. Para cada grupo de tratamiento, los valores Iog1 de los títulos de anticuerpos de punto final se promediaron y se calcularon las desviaciones estándar para cada punto de tiempo.
Figura 4. Respuestas de anticuerpos anti-rHA potenciadas después de la vacunación con el antígeno rHA formulado en una vacuna de liposomas/polihc/vehículo oleoso. Dos grupos de ratones (n = 9 o 1) se vacunaron del siguiente modo: los ratones del grupo 1 se vacunaron con 1 microgramo de rHA y 4 microgramos de PolibC en una dosis de 3 microlitros formulada como una vacuna de liposomas/PolihC/vehículo hidrófobo (vacuna B, la invención). Los ratones del grupo 2 se trataron con la vacuna A, 1 microgramo de rHA y 6 microgramos de alumbre en una dosis de 3 microlitros de la formulación de liposoma/alumbre/vehículo hidrófobo. Las respuestas inmunitarias humorales se midieron mediante ELISA como se describe en el presente documento. Para cada grupo de tratamiento, los valores log 1 de los títulos de anticuerpos de punto final se promediaron y se calcularon las desviaciones estándar para cada punto de tiempo. Los valores p se calcularon utilizando la prueba t de Student.
Figura 5. Respuestas de anticuerpos anti-rHA potenciadas después de la vacunación con el antígeno rHA formulado en una vacuna de liposoma/polibc/vehículo oleoso. Dos grupos de ratones (n = 9 o 1) se vacunaron del siguiente modo: los ratones del grupo 1 se vacunaron con 1 microgramo de rHA y 4 microgramos de PolibC en una dosis de 3 microlitros formulada como una vacuna de liposomas/PolibC/vehículo hidrófobo (vacuna B, la invención). Los ratones del grupo 2 se vacunaron con 1 microgramo de rHA y 4 microgramos de polibC por dosis de 3 microlitros de la vacuna polibC control. Las respuestas inmunitarias humorales se midieron mediante ELISA como se describe en el presente documento. Para cada grupo de tratamiento, los valores Iog1 de los títulos de anticuerpos de punto final se promediaron y se calcularon las desviaciones estándar para cada punto de tiempo. Los valores p se calcularon utilizando la prueba t de Student.
Figura 6. Respuestas de anticuerpos anti-rHA potenciadas después de la vacunación con el antígeno rHA formulado en una vacuna de liposomas liofilizados/PolibC/vehículo oleoso. Dos grupos de ratones (n = 9 o 1) se inmunizaron del siguiente modo: los ratones del grupo 1 se vacunaron con una única dosis de 1,5 microgramos de rHA y 12,5 microgramos de PolibC en una dosis de 5 microlitros formulada como una vacuna de liposomas liofilizados/PolibC/vehículo hidrófobo (vacuna C, la invención). Los ratones del grupo 2 se trataron con 1,5 microgramos de rHA y 1 microgramos de alumbre por dosis de 5 microlitros de la vacuna de alumbre control; se administró un refuerzo a los ratones 28 días (semana 4) después de la vacunación. Las respuestas inmunitarias humorales se midieron mediante ELISA como se describe en el presente documento. Para cada grupo de tratamiento, los valores log 1 de los títulos de anticuerpos de punto final se promediaron y se calcularon las desviaciones estándar para cada punto de tiempo. Los valores p se calcularon utilizando... [Seguir leyendo]
Reivindicaciones:
1. Una formulación de vacuna inyectable, que comprende:
(a) un antígeno frente al que se va a inducir una respuesta inmunitaria en un sujeto en necesidad de la misma, en el que el antígeno se selecciona entre el grupo que consiste en un antígeno derivado de una bacteria, un virus, un hongo, un parásito o una célula tumoral; un antígeno de enfermedades infecciosas; un antígeno derivado de un alérgeno animal, un alérgeno alimentario, un alérgeno de insectos, un alérgeno bacteriano, un alérgeno de fármacos, una hormona o una enzima; y un polipéptido derivado de hormona liberadora de gonadotropina, survivina o péptido beta-amiloide;
(b) liposomas;
(c) un polinucleótido polil:C; y
(d) un vehículo que consiste esencialmente en aceite o que es una emulsión de agua en aceite.
2. La formulación de vacuna inyectable de acuerdo con la reivindicación 1, en la que el polinucleótido polikC comprende ARN y/o ADN.
3. La formulación de vacuna inyectable de acuerdo con una cualquiera de las reivindicaciones 1-2, en la que el polinucleótido polil:C es un homopolímero o un heteropolímero.
4. La formulación de vacuna inyectable de acuerdo con una cualquiera de las reivindicaciones 1-2, en la que el polinucleótido polil :C comprende un polinucleótido polibC homopolimérico y un.polinucleótido polil :C heteropolimérico.
5. La formulación de vacuna inyectable de acuerdo con una cualquiera de las reivindicaciones 1-4, en la que el antígeno está encapsulado en los liposomas, o el polinucleótido polil:C está encapsulado en los liposomas, o tanto el antígeno como el polinucleótido polil:C están encapsulados en los liposomas.
6. Un método para preparar una formulación de vacuna inyectable, comprendiendo dicho método, combinar, en cualquier orden:
(a) un antígeno frente al que se va a inducir una respuesta inmunitaria en un sujeto en necesidad de la misma, en el que el antígeno se selecciona entre el grupo que consiste en un antígeno derivado de una bacteria, un virus, un hongo, un parásito o una célula tumoral; un antígeno de enfermedades infecciosas; un antígeno derivado de un alérgeno animal, un alérgeno alimentario, un alérgeno de insectos, un alérgeno bacteriano, un alérgeno de fármacos, una hormona o una enzima; y un polipéptido derivado de hormona liberadora de gonadotropina, survivina o péptido beta-amiloide;
(b) liposomas;
(c) un polinucleótido polikC; y
(d) un vehículo que consiste esencialmente en aceite o que es una emulsión de agua en aceite.
7. El método de acuerdo con la reivindicación 6, en el que dicho antígeno está encapsulado en dichos liposomas.
8. El método de acuerdo con la reivindicación 6 o 7, en el que dicho polinucleótido polikC está encapsulado en dichos liposomas.
9. El método de acuerdo con la reivindicación 6 o 7, en el que dicho polinucleótido polikC se añade en el exterior de dichos liposomas.
1. Una formulación de la vacuna inyectable de acuerdo con una cualquiera de las reivindicaciones 1-5 para su uso como un medicamento.
11. La formulación de vacuna inyectable de acuerdo con la reivindicación 1, para su uso en la inducción de una respuesta de anticuerpos a dicho antígeno en un sujeto en necesidad de la misma.
12. La formulación de vacuna inyectable de acuerdo con la reivindicación 1, para su uso en la inducción de una respuesta mediada por células a dicho antígeno en un sujeto necesidad de la misma.
13. La formulación de vacuna inyectable de acuerdo con la reivindicación 1, para su uso en el tratamiento y/o prevención de una enfermedad causada por una bacteria, un virus, un hongo, o un parásito, en la que el antígeno en
la formulación de vacuna deriva de las bacterias, los virus, los hongos, o el parásito.
14. La formulación de vacuna inyectable de acuerdo con la reivindicación 1, para su uso en el tratamiento y/o prevención de una enfermedad causada por un alérgeno animal, un alérgeno alimentario, un alérgeno de insectos o un alérgeno de fármacos, en la que el antígeno en la formulación de vacuna deriva del alérgeno.
15. La formulación de vacuna inyectable de acuerdo con la reivindicación 1, para su uso en el tratamiento y/o prevención de una enfermedad causada por una célula tumoral que expresa el antígeno en la formulación de vacuna.
16. La formulación de vacuna inyectable según la reivindicación 13, en la que el tratamiento y/o prevención comprende la inducción de un anticuerpo y/o una respuesta inmunitaria mediada por células al antígeno en un sujeto, en la que el sujeto tiene o está en riesgo de desarrollar una infección viral.
17. La formulación de vacuna inyectable de acuerdo con la reivindicación 16, en la que la infección viral es una infección por virus de la gripe.
18. La formulación de vacuna inyectable según la reivindicación 15, en la que el tratamiento y/o prevención comprende la inducción de un anticuerpo y/o una respuesta inmunitaria mediada por células al antígeno en un sujeto, en la que el sujeto tiene o está en riesgo de desarrollar cáncer.
19. La formulación de vacuna inyectable de acuerdo con la reivindicación 1, para su uso en el tratamiento y/o prevención de una enfermedad neurodegenerativa, en la que la enfermedad neurodegenerativa está asociada con la expresión del antígeno en la formulación de vacuna.
2. La formulación de vacuna inyectable de acuerdo con la reivindicación 19, en la que la enfermedad neurodegenerativa es la enfermedad de Alzheimer.
21. La formulación de vacuna inyectable de acuerdo con la reivindicación 1 o el método para la fabricación de una formulación de vacuna inyectable de acuerdo con la reivindicación 6, en los que el antígeno es un antígeno específico de tumor.
22. El método de acuerdo con la reivindicación 6, que comprende la formación de los liposomas en presencia del antígeno, o en presencia del polinucleótido polil:C, o en presencia de tanto el antígeno como el polinucleótido polil:C y después la combinación de los liposomas con el vehículo para producir la formulación de vacuna inyectable.
23. El método de acuerdo con la reivindicación 6 que comprende (i) formar los liposomas, (¡i) combinar los liposomas con el antígeno, o con el polinucleótido polil:C, o con tanto con el antígeno como con el polinucleótido polil:C para formar una mezcla de liposomas y (iii) combinar la mezcla de liposomas con el vehículo para producir la formulación de vacuna inyectable.
Patentes similares o relacionadas:
Eliminación de impurezas de cultivos celulares residuales, del 29 de Julio de 2020, de NOVARTIS AG: Un método para eliminar la Proteína Nuclear (NP) de la Gripe de una preparación que comprende proteínas del virus de la gripe de interés que incluyen hemaglutinina […]
 Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Cepas de Bordetella vivas atenuadas como vacuna de dosis única contra la tos ferina, del 29 de Julio de 2020, de INSTITUT PASTEUR DE LILLE: Una vacuna que comprende una cepa viva, atenuada y mutada de Bordetella pertussis que comprende al menos una mutación del gen (ptx) de la toxina […]
Método para producir inmunoconjugados de anticuerpo-SN-38 con un enlazador CL2A, del 22 de Julio de 2020, de IMMUNOMEDICS, INC.: Un método para producir un compuesto, CL2A-SN-38, que presenta la estructura, **(Ver fórmula)** que comprende realizar un esquema de reacción como el que se muestra: **(Ver […]
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Arenavirus trisegmentados como vectores de vacunas, del 22 de Julio de 2020, de UNIVERSITE DE GENEVE: Una partícula de arenavirus trisegmentada infecciosa y competente para la replicación que comprende un segmento L y dos segmentos S, en donde uno de los dos segmentos […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]