Formulaciones de vacuna para Norovirus.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/079929.
Solicitante: LIGOCYTE PHARMACEUTICALS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 2155 ANALYSIS DRIVE BOZEMAN, MT 59718 ESTADOS UNIDOS DE AMERICA.
Inventor/es: VEDVICK, THOMAS S., TINO, WILLIAM, T., RICHARDSON,CHARLES, FOUBERT,THOMAS R.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos virales.
- A61K39/42 A61K 39/00 […] › virales.
PDF original: ES-2420136_T3.pdf
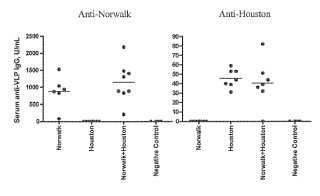
Fragmento de la descripción:
Formulaciones de vacuna para norovirus.
CAMPO DE LA INVENCIÓN
La invención pertenece al campo de las vacunas, especialmente al de las vacunas para norovirus.
DECLARACIÓN DE APOYO GUBERNAMENTAL
Esta invención se realizó con ayuda gubernamental del US Army Medical Research and Material Command, con los contratos número DAMD17-01-C-0400 y W81XWH-05-C-0135. Es posible que el gobierno tenga ciertos derechos sobre la invención.
ANTECEDENTES DE LA INVENCIÓN
Los norovirus son calicivirus humanos no cultivables que aparecen como la principal causa de los brotes epidémicos de gastroenteritis no bacteriana (Glass y col., 2000; Hardy y col., 1999) . La importancia clínica de los norovirus ha estado minusvalorada antes del desarrollo de ensayos moleculares de diagnóstico sensibles. La clonación del genoma del virus de Norwalk (NV) del genogrupo I prototipo y la producción de partículas similares a virus (VLP, por sus siglas en inglés) a partir de un sistema de expresión de baculovirus recombinante ha permitido el desarrollo de pruebas que han mostrado la extensión de infecciones por norovirus (Jiang y col. 1990; 1992) .
Los norovirus son virus de ARN de cadena sencilla y sentido positivo que contienen un genoma de ARN no segmentado. El genoma vírico codifica tres marcos de lectura abiertos, de los cuales los dos últimos especifican la producción de la proteína principal de la cápside y una proteína estructural menor, respectivamente (Glass y col. 2000) . Cuando se expresan a niveles elevados en sistemas de expresión eucariotas, la proteína de la cápside del NV, y de otros norovirus en particular, se ensambla en VLP que estructuralmente mimetizan a viriones de norovirus nativos. Cuando se observan mediante microscopía electrónica de transmisión, las VLP no pueden distinguirse morfológicamente de viriones infecciosos aislados a partir de muestras de heces humanas.
Las respuestas inmunes frente a norovirus son complejas y la correlación de protección está empezando a elucidarse. Los estudios en voluntarios humanos realizados con el virus nativo mostraron que las respuestas inmunes de memoria derivadas a partir de mucosas proporcionaban protección a corto plazo tras la infección y sugerían que es posible la protección mediante vacunas (Lindesmith y col. 2003; Parrino y col. 1997; Wyatt y col., 1974) .
Aunque el norovirus no puede cultivarse in vitro gracias a la disponibilidad de VLP y su capacidad para producirse en grandes cantidades, se ha realizado un progreso considerable a la hora de definir la topografía antigénica y estructural de la cápside del norovirus. Las VLP conservan la conformación auténtica de la proteína de la cápside vírica careciendo del material genético infeccioso. Por consiguiente, las VLP mimetizan las interacciones funcionales del virus con los receptores celulares, mostrando de este modo una respuesta inmune del huésped apropiada al tiempo que carecen de la capacidad para reproducir o causar la infección. Junto al NIH, en el Baylor College of Medicine se estudiaron las respuestas inmunes humoral, mucosa y celular a las VLP de NV en voluntarios humanos en un ensayo clínico en fase I académico patrocinado por el investigador. Se demostró que la administración de VLP por vía oral era segura e inmunogénica en adultos sanos (Ball y col. 1999; Tacket y col. 2003) . En otros centros académicos, los experimentos preclínicos en modelos animales han mostrado un aumento de las respuestas inmunes a VLP cuando se administran por vía intranasal con adyuvantes de exotoxinas bacterianas (Guerrero y col. 2001; Nicollier-Jamot y col. 2004; Periwal y col. 2003) . En conjunto, estos datos sugieren que una vacuna compuesta por VLP formulada de forma adecuada representa una estrategia viable de inmunización frente a una infección por norovirus.
El documento EP1186890A1 se refiere a un kit de detección de SRSV que comprende anticuerpos frente a péptidos que constituyen virus relacionados con SRSV. El documento US5861241A se refiere a anticuerpos monoclonales y su uso en ensayos para determinar la presencia del virus de Norwalk, partículas del virus de Norwalk o IgM específica del virus de Norwalk en una muestra biológica. El documento WO9216543A1 se refiere a un virus de Norwalk agente de la gastroenteritis humana y a la clonación molecular de los ADNc correspondientes. El documento US2005155113A1 se refiere a vectores y procedimientos para la inmunización frente al virus de Norwalk usando plantas transgénicas. El documento WO2007081447A2 se refiere a composiciones inmunogénicas que inducen respuestas inmunes frente a antígenos de norovirus y sapovirus.
RESUMEN DE LA INVENCIÓN
La presente invención proporciona:
1. Una composición que comprende al menos un antígeno de norovirus y al menos un adyuvante en el que dicho antígeno comprende partículas similares a virus (VLP) de norovirus y el adyuvante no es una exotoxina derivada de bacterias y en el que la composición se formula como un polvo seco.
2. La composición del punto 1, en la que dichas partículas similares a virus (VLP) de norovirus comprende una proteína de la cápside de una cepa vírica de norovirus del genogrupo I o del genogrupo II.
3. La composición del punto 1, en la que dichas VLP de norovirus son VLP recombinantes producidas en un sistema de expresión usando una secuencia de ácido nucleico de norovirus.
4. La composición del punto 3, en la que dicha secuencia de ácido nucleico codifica una proteína de la cápside.
5. La composición del punto 4, en la que dicha proteína de la cápside se selecciona entre el grupo compuesto por VP1 y VP2.
6. La composición del punto 1, en la que las VLP son VLP monovalentes o VLP polivalentes.
7. La composición del punto 6, en la que las VLP polivalentes comprenden proteínas de la cápside de norovirus del genogrupo I y del genogrupo II.
8. La composición del punto 3, en la que el sistema de expresión es un sistema de expresión celular recombinante o un sistema de expresión celular infectado con baculovirus.
9. La composición del punto 8, en la que el sistema de expresión celular se selecciona entre el grupo compuesto por un sistema de expresión de levaduras, bacterias, insectos y mamíferos.
10. La composición del punto 1, que además comprende un segundo antígeno de norovirus.
11. La composición del punto 10, en la que dichos primer y segundo antígeno de norovirus son VLP monovalentes de genogrupos diferentes.
12. La composición del punto 1, que además comprende un agente de administración.
13. La composición del punto 12, en la que el agente de administración funciona potenciando la captación del antígeno, proporcionando un efecto de depósito o aumentando el tiempo de retención del antígeno en el sitio de administración.
14. La composición del punto 12, en la que el agente de administración es un bioadhesivo.
15. La composición del punto 14, en la que dicho bioadhesivo es un mucoadhesivo.
16. La composición del punto 15, en la que dicho mucoadhesivo se selecciona entre el grupo compuesto por glucosaminoglucanos (p. ej., sulfato de condroitina, dermatano sulfato de condroitina, sulfato de queratano, heparina, sulfato de heparano, hialuronano) , polímeros de hidratos de carbono (p. ej., pectina, alginato, glucógeno, amilasa, amilopectina, celulosa, quitina, estaquiosa, inulina, dextrina, dextrano) , derivados entrecruzados de poli (ácido acrílico) , alcohol de polivinilo, polivinilpirrolidona, polisacáridos (incluyendo mucina y otros mucopolisacáridos) , poliiones, derivados de celulosa (p. ej., hidroxipropilmetilcelulosa, carboximetilcelulosa) , proteínas (p. ej., lectinas, proteínas frimbiales) y ácido dexoxirribonucleico.
17. La composición del punto 16, en la que dicho mucoadhesivo es un polisacárido.
18. La composición del punto 17 en la que dicho polisacárido es quitosano, sal de quitosano o base de quitosano.
19. La composición del punto 12, en la que dicho adyuvante es MPL, y dicho agente de administración es quitosano, sal de quitosano o base de quitosano.
20. La composición del punto 1, en la que el adyuvante se selecciona entre el grupo compuesto por agonistas de receptores de tipo toll (TLR) , monofosforil lípido A (MPL) , lípido sintético A, miméticos o análogos del lípido A, sales de aluminio, citoquinas, saponinas, derivados del dipéptido de muramilo (MDP) , oligos CpG, lipopolisacárido (LPS) de bacterias gram-negativas, polifosfacenos, emulsiones, virosomas, cocleatos, micropartículas de poli (láctido-co-glucólidos) (PLG) , partículas de poloxámero, micropartículas y liposomas.
21. La composición... [Seguir leyendo]
Reivindicaciones:
1. Una composición que comprende al menos un antígeno de norovirus y al menos un adyuvante en la que dicho antígeno comprende partículas similares a virus (VLP) de norovirus y el adyuvante no es una exotoxina derivada de bacterias y en la que la composición se formula como un polvo seco.
2. La composición de la reivindicación 1, en la que dichas partículas similares a virus (VLP) de norovirus comprende una proteína de la cápside de una cepa vírica de norovirus del genogrupo I o del genogrupo II.
3. La composición de la reivindicación 1, en la que dichas VLP de norovirus son VLP recombinantes producidas en un sistema de expresión usando una secuencia de ácido nucleico de norovirus.
4. La composición de la reivindicación 3, en la que dicha secuencia de ácido nucleico codifica una proteína de la cápside.
5. La composición de la reivindicación 4, en la que dicha proteína de la cápside se selecciona entre el grupo compuesto por VP1 y VP2.
6. La composición de la reivindicación 1, en la que las VLP son VLP monovalentes o VLP multivalentes.
7. La composición de la reivindicación 6, en la que las VLP polivalentes comprenden proteínas de la cápside de norovirus del genogrupo I y del genogrupo II.
8. La composición de la reivindicación 3, en la que el sistema de expresión es un sistema de expresión celular recombinante o un sistema de expresión celular infectado con baculovirus.
9. La composición de la reivindicación 8, en la que el sistema de expresión celular se selecciona entre el grupo compuesto por un sistema de expresión de levaduras, bacterias, insectos y mamíferos.
10. La composición de la reivindicación 1, que además comprende un segundo antígeno de norovirus.
11. La composición de la reivindicación 10, en la que dichos primer y segundo antígenos de norovirus son VLP monovalentes de genogrupos diferentes.
12. La composición de la reivindicación 1, que además comprende un agente de administración.
13. La composición de la reivindicación 12, en la que el agente de administración funciona potenciando la captación del antígeno, proporcionando un efecto de depósito o aumentando el tiempo de retención del antígeno en el sitio de administración.
14. La composición de la reivindicación 12, en la que el agente de administración es un bioadhesivo.
15. La composición de la reivindicación 14, en la que dicho bioadhesivo es un mucoadhesivo.
16. La composición de la reivindicación 15, en la que dicho mucoadhesivo se selecciona entre el grupo compuesto por glucosaminoglucanos (p. ej., sulfato de condroitina, dermatano sulfato de condroitina, sulfato de queratano, heparina, sulfato de heparano hialuronano) , polímeros de hidratos de carbono (p. ej., pectina, alginato, glucógeno, amilasa, amilopectina, celulosa, quitina, estaquiosa, inulina, dextrina, dextrano) , derivados entrecruzados de poli (ácido acrílico) , alcohol de polivinilo, polivinilpirrolidona, polisacáridos (incluyendo mucina y otros mucopolisacáridos) , poliiones, derivados de celulosa (p. ej., hidroxipropilmetilcelulosa, carboximetilcelulosa) , proteínas (p. ej., lectinas, proteínas frimbiales) y ácido dexoxirribonucleico.
17. La composición de la reivindicación 16, en la que dicho mucoadhesivo es un polisacárido.
18. La composición de la reivindicación 17 en la que dicho polisacárido es quitosano, sal de quitosano o base de quitosano.
19, La composición de la reivindicación 12, en la que dicho adyuvante es MPL, y dicho agente de administración es quitosano, sal de quitosano o base de quitosano.
20. La composición de la reivindicación 1, en la que el adyuvante se selecciona entre el grupo compuesto por agonistas de receptores de tipo toll (TLR) , monofosforil lípido A (MPL) , lípido sintético A, miméticos o análogos del lípido A, sales de aluminio, citoquinas, saponinas, derivados del dipéptido de muramilo (MDP) , oligos CpG, lipopolisacárido (LPS) de bacterias gram-negativas, polifosfacenos, emulsiones, virosomas, cocleatos, micropartículas de poli (láctido-co-glucólidos) (PLG) , partículas de poloxámero, micropartículas y liposomas.
21. La composición de la reivindicación 20, en la que el adyuvante es MPL.
22. La composición de la reivindicación 1, en la que la composición tiene un tamaño medio de partícula de aproximadamente 10 a 500 micras de diámetro.
23. La composición de la reivindicación 1 en combinación con uno o más dispositivos para administrar una o más dosis de dicha composición.
24. La composición de la reivindicación 23, en la que dicha una o más dosis son dosis unitarias.
25. La composición de la reivindicación 23, en la que el dispositivo es un dispositivo de administración nasal de un solo uso.
26. La composición de la reivindicación 23, en la que dicha composición se almacena en dicho dispositivo.
27. La composición de la reivindicación 1, en la que dicha composición se formula para administración mucosa.
28. La composición de la reivindicación 27, en la que la vía de administración mucosa es intranasal, oral o vaginal.
29. La composición de la reivindicación 28, en la que la composición se administra en la mucosa nasal mediante un depósito rápido dentro de la fosa nasal a partir de un dispositivo de la formulación que se mantiene cerca o se inserta dentro de las fosas nasales.
30. La composición de la reivindicación 29, en la que la composición se administra en una o ambas fosas nasales.
31. La composición de la reivindicación 1, en la que el antígeno de norovirus se presenta en una concentración de aproximadamente el 0, 01% (p/p) a aproximadamente el 80% (p/p) .
32. La composición de la reivindicación 1, en la que la dosis del antígeno de norovirus está presente en una cantidad de aproximadamente 1 μg a aproximadamente 100 mg por dosis, o es de aproximadamente 1 μg a aproximadamente 1 mg por dosis, o es de aproximadamente 1 μg a aproximadamente 500 μg por dosis, o es de aproximadamente 1 μg a aproximadamente 100 μg por dosis.
33. La composición según una cualquiera de las reivindicaciones anteriores, para su uso en el tratamiento de una infección por norovirus.
34. Un procedimiento para la generación de anticuerpos frente a uno o más antígenos de norovirus, comprendiendo dicho procedimiento la administración de la composición de las reivindicaciones 1 a 33 a un sujeto, en la que dicha administración no incluye procedimientos para el tratamiento mediante terapia practicada sobre dicho sujeto.
Patentes similares o relacionadas:
Composición farmacéutica que comprende un complejo de carga portador polimérico y al menos un antígeno proteínico o peptídico, del 1 de Julio de 2020, de CureVac AG: Composición farmacéutica que incluye: (A) un complejo de carga portador polimérico, que comprende: a) un portador polimérico que comprende componentes catiónicos reticulados […]
Vacunas y diagnóstico de torque teno virus porcino, del 18 de Junio de 2020, de VIRGINIA TECH INTELLECTUAL PROPERTIES, INC.: Composición inmunogénica que comprende una proteína según SEQ ID NO. 16.
Estructuras artificiales de poliepítopos para uso en inmunoterapia, del 17 de Junio de 2020, de Invectys: Un vector de expresión de ADN o una mezcla de vectores de expresión de ADN que codifica al menos dos epítopos de CD4 de la transcriptasa inversa de la telomerasa […]
Métodos para proporcionar virosomas con adyuvante y virosomas con adyuvante obtenibles de esta manera, del 3 de Junio de 2020, de BESTEWIL HOLDING B.V: Un método para preparar los virosomas con adyuvante, que comprende las etapas de: (i) proporcionar una composición acuosa de los virosomas sin adyuvante que comprende […]
Ácido nucleico que comprende o codifica para un tallo-bucle de histona y una secuencia poli(A) o una señal de poliadenilación para aumentar la expresión de un antígeno patogénico codificado, del 3 de Junio de 2020, de CureVac AG: Secuencia de ácido nucleico que comprende o codifica en la dirección 5' → 3' para: i) • una región codificante, que codifica para al menos […]
Composiciones inmunogénicas de PCV2 multivalentes y métodos para producir dichas composiciones, del 27 de Mayo de 2020, de Boehringer Ingelheim Animal Health USA Inc: Una vacuna combinada multivalente para uso en un método para (i) la prevención de una infección por PCV2, o de reinfección por PCV2 o (ii) la reducción o eliminación […]
Vacuna que comprende un pestivirus atenuado, del 27 de Mayo de 2020, de BOEHRINGER INGELHEIM VETMEDICA GMBH: Un pestivirus atenuado, con al menos una mutación en la secuencia codificadora de la glicopoteína E ms y al menos otra mutación en la secuencia […]
Proteínas de consenso del virus de la Fiebre Aftosa (VFA), secuencias codificantes y vacunas preparadas a partir de las mismas, del 6 de Mayo de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Molécula de ácidos nucleicos que comprende una secuencia de ácidos nucleicos seleccionada del grupo que consiste en SEC ID nº 1, SEC ID nº […]