COMPOSICION BIOREABSORBIBLE DE LIBERACION CONTROLADA.
Un procedimiento que comprende las etapas de:
i)mezclar una o más cerámicas bioreabsorbibles e hidratables con una o más sustancias terapéutica,
profiláctica y/o diagnósticamente activas;
ii)densificar la mezcla obtenida en i) mediante aplicación de una presión externa,
iii)hidratar la cerámica durante la densificación en la etapa ii) mediante la adición de agua a la mezcla resultante de la etapa i) en una cantidad correspondiente de aproximadamente 20% a aproximadamente 120% de la cantidad estequiométrica necesaria para hidratar completamente la una o más cerámicas,
en el que se obtiene una cerámica altamente densificada y al menos parcialmente hidratada con una porosidad del 10% como máximo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/002250.
Solicitante: LIDDS AB.
Nacionalidad solicitante: Suecia.
Dirección: KULLAGATAN 8-10,252 20 HELSINGBORG.
Inventor/es: AXEN,NIKLAS, LENNERNAS,HANS.
Fecha de Publicación: .
Fecha Concesión Europea: 10 de Marzo de 2010.
Clasificación Internacional de Patentes:
- A61K9/00M5D
- A61K9/00M8
- A61K9/16H2
- A61K9/16P4
Clasificación PCT:
- A61K9/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
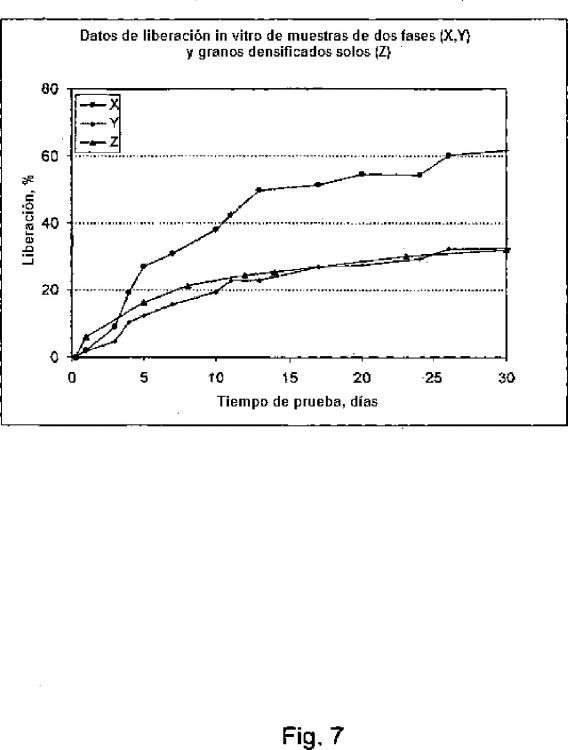
Fragmento de la descripción:
Composición bioreabsorbible de liberación controlada.
Campo de la invención
La presente invención se refiere a un procedimiento nuevo para la preparación de una cerámica altamente densificada y, al menos en parte, preferente y completamente o casi completamente hidratada, para usar en la preparación de una composición farmacéutica principalmente para la liberación controlada de una o más sustancias terapéutica, profiláctica y/o diagnósticamente activas. El procedimiento implica una etapa concomitante de hidratar y densificar una cerámica bioreabsorbible e hidratable. La invención también se refiere a composiciones que comprenden dicha cerámica altamente densificada. La composición farmacéutica es útil para la liberación prolongada local controlada y dirigida de sustancias activas, por ejemplo agentes anticancerosos, en los que el espectro y la gravedad de los efectos secundarios se minimizan debido a un perfil local de concentración-tiempo optimizado.
Antecedentes de la invención
En el pasado se ha desarrollado una gama de sistemas de liberación de fármaco para terapia de liberación local controlada y/o dirigida. Muchos se basan en polímeros bioreabsorbibles (o biodegradables), cerámicas bioreabsorbibles y/o hidrogel(es) como transportadores para la sustancia terapéuticamente activa. Los polímeros biodegradables de uso habitual son ácidos polilácticos y ácidos poliláctico-c-glicólidos. Se han descrito varias cerámicas basadas en sales de calcio, por ejemplo sistemas de fosfato de calcio o de sulfato de calcio, o hidroxilapatita, en forma de perlas, gránulos, armazones o pastas moldeables, para transportar y liberar fármacos en forma tanto activa como inactiva, por ejemplo hormonas, antibióticos, antivirales, anticancerosos, analgésicos, anticoagulantes y factores de crecimiento óseo, en los tejidos circundantes. Estas cerámicas a menudo se denominan cerámicas hidratables o de hidratación debido a su capacidad para reaccionar químicamente con agua para formar hidratos. Véase, por ejemplo, Royer US 6.91.336, US 6.630.486, US 2003/0170307.
Cuando se usan cerámicas bioreabsorbibles (o biodegradables) e hidratables, los mecanismos de liberación dependen de las propiedades inherentes de los materiales cerámicos hidratables tras solidificación mediante hidratación. Por ejemplo, el sulfato de calcio en forma de su hemihidrato se une rápidamente a agua adicional y forma el sulfato de calcio dihidrato. Cuando una mezcla de polvo de cerámica y fármaco activo se expone a agua e hidratos, el fármaco activo o profármacos se une a una matriz/transportador del material hidratado. Debido a una combinación de factores, tales como la cantidad limitada de agua a la que es posible unirse en las reacciones de hidratación, lo que limita la posible cantidad de fases hidrato que se forma para rellenar los huecos entre los granos de polvo y la necesidad de al menos algún transporte de agua para que progrese la hidratación, tras la hidratación permanece algún grado de porosidad. La porosidad formada como resultado de una hidratación normal a menudo se denomina microporosidad residual. Después de una hidratación normal de sulfato de calcio hemihidrato, la microporosidad constituye aproximadamente 30-50% en vol. En una situación in vivo, el fármaco activo o el profármaco se liberan desde el transportador, pasan a las zonas circundantes, mediante mecanismos que implican, por ejemplo, difusión a través del sistema de poros y/o erosión del material transportador.
Las sustancias cerámicas, como por ejemplo el sulfato de calcio, se han sugerido como materiales de implante para la liberación controlada de sustancias activas (véase, por ejemplo, Royer US 6.391.336, US 6.630.486, US 2003/0170307). Con el fin de obtener una liberación más lenta y controlada de la o las sustancias activas a partir de las cerámicas, Royer usa un agente de formación de complejos que es una sustancia polimérica que forma un complejo con la sustancia activa, según el cual se puede obtener una liberación más lenta del fármaco.
Las cerámicas bioreabsorbibles tienen muchas propiedades favorables para formulaciones farmacéuticas en las aplicaciones de liberación controlada en comparación con los polímeros, tales como biocompatibilidad y biodegradabilidad. En general, las cerámicas bioreabsorbibles no son tóxicas y se basan en moléculas que se encontrarían de forma normal en los tejidos vivos de los mamíferos. El sulfato de calcio es particularmente atractivo ya que es un material reabsorbible y biocompatible, es decir desaparece con el tiempo.
No obstante, la velocidad de liberación de sustancias terapéuticas a partir de transportadores cerámicos se ha convertido en algo difícil de controlar. Para los sistemas cerámicos basados tanto en fosfato de calcio como en sulfato de calcio, la velocidad de liberación es demasiado alta para un sistema de liberación de fármacos a largo plazo. Además, en algunos casos se desean formulaciones que ofrecen una combinación de una dosis terapéutica de tipo refuerzo inmediata y/o rápida en combinación con una liberación de la dosis más lenta y controlada durante un periodo de tiempo prolongado.
La solicitud de PCT WO 05/039537 divulga una composición farmacéutica que comprende una cerámica hidratable bioreabsorbibles, medio acuoso absorbido y una sustancia activa. En la composición descrita, la velocidad de liberación se controla sellando la porosidad.
La presente invención ofrece una técnica para reducir y controlar la velocidad de liberación del fármaco de una cerámica bioreabsorbible e hidratable cuando se usa como transportador para agentes terapéuticos.
Con la invención también se pueden conseguir combinaciones de características liberación más rápida y de liberación más lenta en la misma formulación farmacéutica.
Sumario de la invención
La presente invención proporciona, en un primer aspecto, un procedimiento para la preparación de una cerámica altamente densificada y al menos parcialmente hidratada. En formas de realización específicas, la cerámica obtenida mediante el procedimiento está completamente o casi completamente hidratada. El procedimiento implica someter una o más cerámicas hidratables y bioreabsorbibles a un procedimiento que implica hidratar la cerámica bajo una presión externa. La hidratación es un proceso químico, por ejemplo en el caso del sulfato de calcio, la hidratación transforma el sulfato de calcio hemihidrato en sulfato de calcio dihidrato. Normalmente, el proceso se inicia mediante la adición de, como máximo, una cantidad de equivalente molar de agua (principalmente en forma de un medio acuoso que opcionalmente comprende uno o más aditivos) a la cerámica en polvo o en forma de cristal. No obstante, como se ha descrito en la memoria descriptiva, se pueden añadir al medio acuoso aditivos que retrasen el inicio del proceso de hidratación y/o la duración del proceso de hidratación y, en consecuencia, el tiempo hasta el curado de la cerámica. Dependiendo del aparato usado para proporcionar la presión externa, el agua se puede añadir antes (p. ej., hasta varias horas antes) o inmediatamente antes de someter a la cerámica a la presión externa o, si el aparato está diseñado para ello, durante la aplicación de la presión externa.
Las cerámicas hidratables tienen la capacidad de unirse al agua y formar cristales ricos en agua. Cuando se añade agua a un polvo de una cerámica hidratable, los granos de polvo se transforman en una nueva forma de cristal rica en agua. Esta reacción de hidratación, que es una recristalización, a menudo tiene como resultado una solidificación de la mezcla polvo-agua en un material sólido. La velocidad de la hidratación, así como la capacidad de absorción de agua, varía en función del tipo de cerámicas de hidratación así como de los parámetros de sistema, tal como el tamaño de grano, la temperatura, el valor de pH etc. La cerámica de partida puede ser una forma libre de agua o semihidratada. Algunas cerámicas forman hidratos intermedios entre la forma sin agua y la completamente hidratada. Para cada cerámica hidratable también hay una forma definida completamente hidratada que no puede unirse a agua adicional. Para el caso particularmente interesante del sulfato de calcio, hay una forma anhidra sin agua, un hidrato intermedio con 0,5 unidades de agua por unidad de sulfato de calcio y el sulfato de calcio dihidrato completamente hidratado con 2 unidades de agua por unidad de sulfato de calcio.
En otro aspecto, la invención se refiere a una composición farmacéutica, que comprende una o...
Reivindicaciones:
1. Un procedimiento que comprende las etapas de:
en el que se obtiene una cerámica altamente densificada y al menos parcialmente hidratada con una porosidad del 10% como máximo.
2. Un procedimiento de acuerdo con la reivindicación 1, en el que se añade agua antes de la densificación.
3. Un de acuerdo con la reivindicación 1 ó 2, en el que la una o más cerámicas están, como máximo, parcialmente hidratadas antes de la densificación en la etapa ii).
4. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que el agua se añade durante la densificación en la etapa ii).
5. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la cantidad de agua añadida corresponde a, como máximo, 110%, tal como, como máximo aproximadamente 105% o como máximo 100%, o al menos 30%, tal como, por ejemplo, al menos 40%, al menos 50%, al menos 60%, al menos 70%, al menos 80%, al menos 85%, tal como en un intervalo correspondiente a de 90% a 100% de la cantidad correspondiente a la cantidad estequiométrica necesaria para hidratar completamente la una o más cerámicas.
6. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que el agua añadida en la etapa (ii) está comprendida en un medio acuoso.
7. Un procedimiento de acuerdo con la reivindicación 6, en el que el medio acuoso comprende un ácido orgánico que comprende un grupo de ácido carboxílico.
8. Un procedimiento de acuerdo con cualquiera de las reivindicaciones 6 ó 7, en el que el medio acuoso retrasa el curado de la una o más cerámicas hidratables y bioreabsorbibles.
9. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la mezcla de la etapa i) y/o el agua de la etapa iii) comprende otras sustancias activas, aditivos u otros excipientes farmacéuticamente aceptables para modificar la microestructura y la velocidad de liberación.
10. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la adición de agua tiene lugar como máximo 2 horas antes de la densificación, tal como, como máximo 1,5 hora, como máximo 1 hora, como máximo 30 minutos, como máximo 20 minutos, como máximo 15 minutos, como máximo 10 minutos, como máximo 5 minutos, como máximo 2 minutos, como máximo 1 minuto, como máximo 30 segundos, como máximo 15 segundos, como máximo 10 segundos o como máximo 5 segundos.
11. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la presión externa se proporciona mediante presión uniaxial y/o isostática.
12. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la presión externa aplicada en la etapa ii) es de al menos 20 MPa, tal como al menos 50 MPa, al menos 80 MPa, al menos 100 MPa, al menos 150 MPa, 200 MPa, al menos 250 MPa o al menos 300 MPa.
13. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la presión externa se aplica durante un periodo de tiempo de al menos 10 minutos, tales como, por ejemplo al menos 15 minutos, al menos 20 minutos, al menos 25 minutos, al menos 30 minutos o al menos 45 minutos.
14. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, que además comprende una etapa iv) de post-hidratación de la cerámica densificada e hidratada al menos parcialmente.
15. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, que comprende una etapa i) de reducción del tamaño de partícula medio de la cerámica hidratable y bioreabsorbible.
16. Un procedimiento de acuerdo con la reivindicación 15, en el que el tamaño de partícula medio de la cerámica hidratable y bioreabsorbible se reduce a, como máximo, aproximadamente 10 µm, tal como, como máximo, aproximadamente 8 µm, como máximo aproximadamente 7 µm, como máximo aproximadamente 6 µm o como máximo aproximadamente 4 µm.
17. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, que además comprende una etapa de granulación de la una o más cerámicas hidratables y bioreabsorbibles antes de la etapa i).
18. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, que además comprende una etapa de dar forma a la mezcla obtenida en la etapa i) mediante, por ejemplo, moldeo, granulación, incluida la granulación en frío, granulación en húmedo, granulación en seco, presurización, antes de someter la mezcla a la etapa ii).
19. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que uno o más excipientes farmacéuticamente aceptables se añaden en la etapa i).
20. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la cerámica altamente densificada y al menos parcialmente hidratada obtenida tiene una porosidad de, como máximo 10%, tal como, por ejemplo, como máximo 5%, como máximo 3%, como máximo 2% o como máximo 1%.
21. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la cerámica altamente densificada y al menos parcialmente hidratada obtenida tiene un tamaño de poro de, como máximo, aproximadamente 100 nm, tal como, por ejemplo, como máximo aproximadamente 75 nm, como máximo aproximadamente 50 nm o como máximo de aproximadamente 10 nm.
22. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la una o más cerámicas hidratables y bioreabsorbibles son una cerámica no hidratada, hidratada, semihidratado o parcialmente hidratada seleccionada del grupo constituido por sulfato de calcio, tal como, por ejemplo, sulfato de calcio-a, sulfato de calcio-ß; sulfato de calcio hemihidrato; fosfato de calcio; carbonato de calcio; fluoruro de calcio; silicato de calcio; sulfato de magnesio; fosfato de magnesio; carbonato de magnesio; fluoruro de magnesio; silicato de magnesio; sulfato de bario; fosfato de bario; carbonato de bario; fluoruro de bario; y silicato de bario; y mezclas de los mismos.
23. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la una o más cerámicas hidratables y bioreabsorbibles son sulfato de calcio no hidratado, hidratado, semihidratado o parcialmente hidratado, tal como sulfato de calcio-a, sulfato de calcio-ß o sulfato de calcio hemihidrato o mezclas de los mismos.
24. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la cerámica hidratable y bioreabsorbible es sulfato de calcio hemihidrato y la cantidad total de agua empleada en la etapa iii) es, como máximo, 1,5 equivalentes molares de agua, tal como, por ejemplo, de 0,5 a 1,5 equivalentes molares, de 0,75 a 1,5 equivalentes molares, de 1 a 1,5 equivalentes molares.
25. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la una o más sustancias terapéutica, profiláctica y/o diagnósticamente activas están dispersas u homogéneamente dispersas en la cerámica altamente densificada y al menos parcialmente hidratada, o la una o más cerámicas altamente densificadas y al menos parcialmente hidratadas encapsulan completa o al menos parcialmente la una o más sustancias terapéutica, profiláctica y/o diagnósticamente activas.
26. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la una o más sustancias terapéutica, profiláctica y/o diagnósticamente activas están absorbidas en la una o más cerámicas hidratables y bioreabsorbibles antes de la etapa ii) y iii).
27. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la una o más sustancias terapéutica, profiláctica y/o diagnósticamente activas empleadas en la etapa i) son una sustancia activa adecuada para usar en una enfermedad o afección relacionada con la próstata.
28. Un procedimiento de acuerdo con la reivindicación 27, en el que la sustancia activa es un andrógeno o un derivado del mismo, un anti-andrógeno o un derivado del mismo, un estrógeno o un derivado del mismo, un antiestrógeno o un derivado del mismo, un anti-estrógeno o un derivado del mismo, un gestágeno o un derivado del mismo, un antigestágeno o un derivado del mismo, un oligonucleótido, un progestágeno o un derivado del mismo, una hormona liberadora de gonadotropina o un análogo o derivado de la misma, un inhibidor de la gonadotropina o un derivado de la misma, un inhibidor enzimático suprarrenal y/o prostático, una proteína de eflujo membrana y/o transportadora de membrana, un modulador del sistema inmunitario, un inhibidor de la angiogénesis, o combinaciones de los mismos.
29. Un procedimiento de acuerdo con la reivindicación 28, en el que el antiandrógeno es flutamida, hidroxiflutamida, ciproterón, nilutamida o bicalutamida, o una combinación de un antiandrógeno y una hormona liberadora de gonadotropina o un análogo de los mismos.
30. Un procedimiento de acuerdo con cualquiera de las reivindicaciones precedentes, en el que la sustancia terapéutica, profiláctica y/o diagnósticamente activa es hidroxiflutamida.
31. Un procedimiento para la preparación de una composición farmacéutica, que comprende mezclar una cerámica altamente densificada y al menos parcialmente hidratada obtenida como se ha definido en cualquiera de las reivindicaciones 1-30 junto con uno o más excipientes farmacéuticamente aceptables.
32. Una composición farmacéutica que comprende una cerámica altamente densificada y al menos parcialmente hidratada obtenible mediante el procedimiento definido en cualquiera de las reivindicaciones 1-31.
33. Una composición farmacéutica que comprende una cerámica altamente densificada y al menos parcialmente hidratada como se ha definido en cualquiera de las reivindicaciones 1-31. 33
34. Una composición farmacéutica de acuerdo con la reivindicación 32 ó 33, en la que la cerámica altamente densificada y al menos parcialmente hidratada, que contiene al menos una parte de las sustancias activas, está en forma de barras, cilindros, comprimidos, perlas o en una forma particulada.
35. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 32-34, en la que la carga de fármaco de la sustancia activa en la cerámica altamente densificada y al menos parcialmente hidratada es, como máximo 50% p/p, tal como, como máximo, 40% p/p, como máximo 35% p/p, como máximo 30% p/p, como máximo 25% p/p o como máximo 20% p/p.
36. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 32-34, en la que la una o más sustancias terapéutica, profiláctica y/o diagnósticamente activa activas contenidas en la cerámica altamente densificada y al menos parcialmente hidratada son como se ha definido en una cualquiera de las reivindicaciones 27-30.
37. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 32-36, en la que la composición además contiene una segunda parte que comprende una cerámica bioreabsorbible, que rodea, al menos parcialmente, la cerámica altamente densificada y al menos parcialmente hidratada.
38. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 32-37, en la que la composición además contiene una segunda parte que comprende un agente de gelificación o de esponjamiento, que rodea, al menos parcialmente, la cerámica altamente densificada y al menos parcialmente hidratada.
39. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 32-38, en la que la composición además contiene una segunda parte que comprende una combinación de una cerámica hidratable y bioreabsorbible y un agente de gelificación o de esponjamiento, que rodea, al menos parcialmente, la cerámica altamente densificada y al menos parcialmente hidratada.
40. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 37-39, en la que la segunda parte está en forma de un recubrimiento o película o la segunda parte está en forma de matriz, que rodea a una o más unidades múltiples de la cerámica altamente densificada y al menos parcialmente hidratada.
41. Una composición farmacéutica de acuerdo con las reivindicaciones 37-40, en la que la segunda parte contiene además un medio acuoso.
42. Una composición farmacéutica de acuerdo con las reivindicaciones 38-41, en la que el agente de gelificación o de esponjamiento se selecciona del grupo constituido por ácido algínico, alginatos, metilcelulosa, carboximetilcelulosa cálcica, carboximetilcelulosa sódica crospovidona, hidroxipropilcelulosa, hidroxipropilmetilcelulosa (HPMC), hidroxipropilcelulosa de baja sustitución (L-HPC), celulosa microcristalina, polacrilina potásica, ácido poliacrílico, policarbofilo, polietilenglicol, polivinilacetato, polivinilpirrolidona, plasdona, croscarmelosa sódica, almidón glicolato de sodio (Explotab) y almidones, dextrano, ácido hialurónico y mezclas de los mismos.
43. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 37-42, en la que la segunda parte comprende un ácido orgánico que comprende un grupo de ácido carboxílico.
44. Una composición farmacéutica de acuerdo con la reivindicación 41, en el que el medio acuoso comprende un ácido orgánico que comprende un grupo de ácido carboxílico.
45. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 37-44, en la que la cerámica bioreabsorbible es como se ha definido en una cualquiera de las reivindicaciones 22-23.
46. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 37-45, en la que la segunda parte comprende además una o más sustancias terapéutica, profiláctica y/o diagnósticamente activas.
47. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 37-46, en la que la cerámica altamente densificada y al menos parcialmente hidratada está en forma particulada, que está incluida en la segunda parte o está recubierta con una película o recubrimiento de la segunda parte.
48. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 37-47, en la que la cerámica altamente densificada y al menos parcialmente hidratada está cubierta con un recubrimiento o película que comprende una o más sustancias terapéutica, profiláctica y/o diagnósticamente activas.
49. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 37-48 en forma semisólida o sólida.
50. Una composición farmacéutica de acuerdo con cualquiera de las reivindicaciones 37-49 para uso parenteral.
51. Un kit que comprende dos o más componentes, en el que un primer componente comprende una cerámica altamente densificada y bioreabsorbible como se ha obtenido mediante el procedimiento definido en cualquiera de las reivindicaciones 1-31, y el segundo componente comprende agua, en el que el agua opcionalmente está
52. Un kit de acuerdo con la reivindicación 51, que comprende tres componentes e instrucciones de uso, en el que un primer componente comprende una cerámica altamente densificada y bioreabsorbible como se ha obtenido mediante el procedimiento definido en cualquiera de las reivindicaciones 1-31, el segundo componente comprende un primer medio acuoso que opcionalmente comprende un ácido orgánico que comprende un grupo de ácido carboxílico y el tercer componente comprende un agente de gelificación o de esponjamiento opcionalmente en un segundo medio acuoso.
53. Un kit de acuerdo con cualquiera de las reivindicaciones 51-52 para la preparación de un producto listo para usar, que comprende una composición como se ha definido en cualquiera de las reivindicaciones 32-50.
54. Un kit de acuerdo con la reivindicación 53, que además comprende un dispositivo para la aplicación del producto listo para usar.
Patentes similares o relacionadas:
PROCEDIMIENTOS Y COMPOSICIONES PARA EL TRATAMIENTO DE TUMORES RESISTENTES A INTERFERON, del 19 de Agosto de 2011, de CANJI, INC.: Un adenovirus recombinante sin capacidad de replicación que codifica un interferón α2b para su uso en el tratamiento de un tumor resistente a interferón de la vejiga, […]
COMPOSICIONES PARA AUMENTAR EL TRANSPORTE A TRAVÉS DE MOCO, del 6 de Junio de 2011, de JOHNS HOPKINS UNIVERSITY: Una partícula que comprende una superficie externa y uno o más grupos modificadores de superficie dispuestos en la superficie externa que reducen la mucoadhesión de la partícula, […]
USO DE LEVO-OMIDAZOL PARA PREPARAR FÁRMACO ANTI-INFECCIONES PARASITARIAS, del 10 de Mayo de 2011, de NANJING SANHOME PHARMACEUTICAL CO., LTD: L-ornidazol, para uso en el tratamiento de infecciones parasitarias
COMPOSICIONES Y SU USO PARA ATRAPAR E INACTIVAR MICROBIOS PATÓGENOS Y ESPERMATOZIODES, del 26 de Abril de 2011, de RUSH-PRESBYTERIAN-ST.LUKE'S MEDICAL CENTER: Una composición antimicrobiana y anticonceptiva que reduce el riesgo de transmisión de, o infección por, una enfermedad de transmisión sexual a través de […]
 FORMULACIONES MUCOADHESIVAS SEMISÓLIDAS, del 4 de Marzo de 2011, de ITALFARMACO, S.A.: Formulaciones mucoadhesivas semisólidas de aplicación vaginal, con características técnicas y organolépticas mejoradas, que contienen al menos dos polímeros bioadhesivos […]
FORMULACIONES MUCOADHESIVAS SEMISÓLIDAS, del 4 de Marzo de 2011, de ITALFARMACO, S.A.: Formulaciones mucoadhesivas semisólidas de aplicación vaginal, con características técnicas y organolépticas mejoradas, que contienen al menos dos polímeros bioadhesivos […]
FORMAS DE DOSIFICACION DE COMPUESTOS DE PROSTAGLANDINA E ESTABILIZADOS TOPICOS, del 27 de Julio de 2010, de NEXMED HOLDINGS, INC.: Forma de dosificación multicomponente embalada que comprende un compartimento de principios activos sellado, que contiene una composición no acuosa […]
 COMPOSICIONES MEDICAS PARA EL TRATAMIENTO INTRAVESICAL DE CANCER DE VEJIGA, del 29 de Junio de 2010, de SPECTRUM PHARMACEUTICALS, INC: Una formulación anti-cáncer comprendiendo una solución tamponada comprendiendo:
5-(1-azaridinil)-3-(hidroximetil)-2-[(E)-3-hidroxiprop-1-enil]-1-methil-1H-indole-4,7-diona […]
COMPOSICIONES MEDICAS PARA EL TRATAMIENTO INTRAVESICAL DE CANCER DE VEJIGA, del 29 de Junio de 2010, de SPECTRUM PHARMACEUTICALS, INC: Una formulación anti-cáncer comprendiendo una solución tamponada comprendiendo:
5-(1-azaridinil)-3-(hidroximetil)-2-[(E)-3-hidroxiprop-1-enil]-1-methil-1H-indole-4,7-diona […]
AGENTES PARA EL TRATAMIENTO DE LA RETINOPATÍA GLAUCOMATOSA Y DE LA NEUROPATÍA ÓPTICA, del 30 de Diciembre de 2011, de NOVARTIS AG: Composición para el tratamiento de la retinopatía glaucomatosa o de la neuropatía óptica en un sujeto en la que la composición proporciona una concentración […]