PROCEDIMIENTO DE MANIPULACION DE MUESTRAS DE UN CITOMETRO DE FLUJO.
Una disposición de boquilla mejorada para un citómetro de flujo para la orientación altamente eficiente y proceso de clasificación en una muestra plana e ítem dedicados tales como células de esperma de equinos o de bovinos.
La disposición de boquilla mejorada comprende una boquilla con una geometría de superficie interior novedosa que puede acelerar gentimente las células e incluso incluir un elemento de superficie interior de torsión individual tipo elíptica puede tener una superficie de flujo laminar y puede producir el paso de flujo más simple para aplicar fuerzas mímimas las cuales actúan en naturaleza de acelaración o fuerzas hidrodinámicas de orientación, es decir, de torsión
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US00/42350.
Solicitante: XY, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1108 NORTH LEMAY AVENUE,FORT COLLINS, CO 80524.
Inventor/es: BUCHANAN,KRISTOPHER,S.,XY,INC, HERICKHOFF,LISA,XY,INC.
Fecha de Publicación: .
Fecha Concesión Europea: 5 de Mayo de 2010.
Clasificación Internacional de Patentes:
- G01N15/14C
Clasificación PCT:
- G01N15/14 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 15/00 Investigación de características de partículas; Investigación de la permeabilidad, del volumen de los poros o del área superficial efectiva de los materiales porosos (identificación de microorganismos C12Q). › Investigación por medios electroópticos.
Clasificación antigua:
- G01N15/00 G01N […] › Investigación de características de partículas; Investigación de la permeabilidad, del volumen de los poros o del área superficial efectiva de los materiales porosos (identificación de microorganismos C12Q).
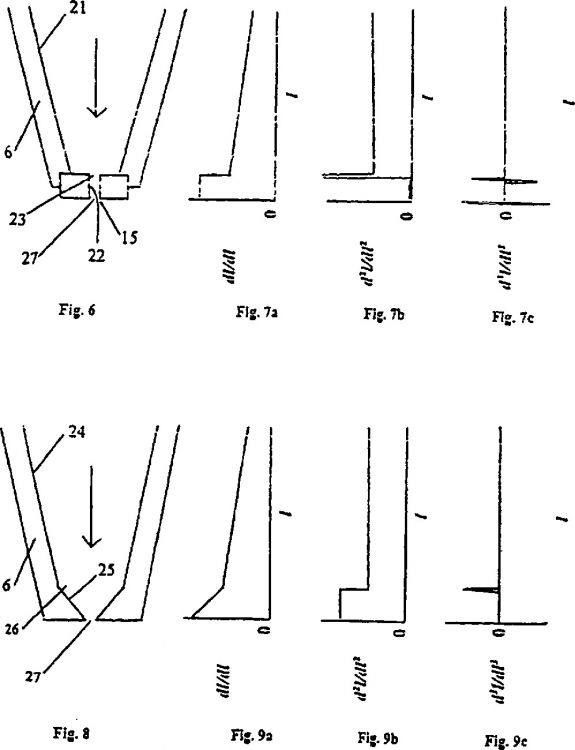
Fragmento de la descripción:
Procedimiento de manipulación de muestras de un citómetro de flujo.
I. Campo técnico
La presente invención versa acerca de un procedimiento que utiliza una boquilla mejorada para un procesamiento de muestras de un citómetro de flujo. Específicamente, la presente invención versa acerca de un diseño novedoso de una geometría de una superficie interior de una boquilla que manipula con cuidado y orienta una muestra en una dirección radial apropiada para un análisis y una clasificación eficaz. La presente invención también se centra en un procedimiento para clasificar células delicadas, especialmente espermatozoides vivos.
II. Antecedentes
Los citómetros de flujo han tenido un uso clínico y de investigación durante muchos años y sus aplicaciones en la industria animal, tal como en la industria de cría de animales han aumentado rápidamente. Un citómetro de flujo disponible comercialmente utiliza normalmente una geometría cilíndrica de fluido en su boquilla. Este tipo de sistema de citómetro de flujo tiene un recorrido de flujo que se centra con una simetría de revolución, como se describe en algunas patentes US (nos de patente 5.602.039, 5.483.469, 4.660.971, 4.988.619 y 5.466.572). Este tipo de diseño, según la ley de similitud, no produce muestras orientadas de forma radial. En los campos clínico, de cría de animales, y de investigación biológica, cuando se clasifican células tales como espermatozoides, pueden ser tincionadas previamente con un tinte que produce fluorescencia cuando se expone a una fuente de luz de excitación. Como se explicó en la patente US nº 5.135.759 de Lawrence Johnson, se puede utilizar un citómetro de flujo que detecta la fluorescencia emitida perpendicular al eje de flujo con gran precisión en la medición y en la discriminación del contenido de ADN de las células. Sin embargo, como otros han señalado, incluso esta precisión en la medición del contenido de ADN solo puede conseguirse de forma más eficaz cuando las células de interés son esféricas o cilíndricas (Dean et al., 1978, Biophys. J. 23: 1-5). En cuanto a los espermatozoides -que tienen cabezas planas- la intensidad observada de fluorescencia depende en gran parte de la orientación apropiada de las cabezas con respecto al detector. Los espermatozoides emiten una señal fluorescente más fuerte desde el borde que la superficie plana. Por lo tanto, la intensidad de la señal fluorescente depende de la orientación de la cabeza del espermatozoide según pasa por el detector. Debido a que el contenido de ADN se determina por medio de fluorescencia y debido a que la intensidad fluorescente se ve afectada por la orientación, la determinación del contenido de ADN puede complicarse por la falta de orientación en una boquilla. Por esta razón, sin una orientación radial, la distribución de intensidad de fluorescencia resultante obtenida para cabezas normales de espermatozoide orientadas de forma aleatoria refleja tanto el contenido de ADN como la orientación de las cabezas. Debido a que las células emiten una señal de fluorescencia más brillante desde el borde de la cabeza (Gledhill et al., 1976, J. Cell Physiol. 87: 367-376; Pinkel et al, 1982, Cytometry 7: 268-273) la precisión de la determinación del contenido de ADN (que puede diferir en tan solo el 3,5%) se ve muy afectada por la orientación de las células. Por esta razón, el citómetro convencional de flujo ha sufrido limitaciones, especialmente cuando se clasifican espermatozoides aplanados u otras células no esféricas o no cilíndricas y similares.
Además, ciertas células pueden exhibir una funcionalidad reducida como resultado del procedimiento de clasificación. Esto puede ser particularmente cierto para células tales como espermatozoides de mamíferos que no son solo delicados mecánicamente, sino que también se vuelven funcionalmente incapacitados (como quizás se puede ver por de una fertilidad reducida) o incluso heridos mortalmente como resultado de alguna incidencia en el proceso de clasificación. Ha habido limitaciones significativas en las tentativas de citometría de flujo con células delicadas acerca de las capacidades. Esto es más grave en el campo altamente especializado de clasificación de espermatozoides no solo porque las propias células son excepcionalmente delicadas, sino también porque existe la necesidad de tasas extremadamente elevadas de clasificación por razones fisiológicas y prácticas. Ha sucedido que estas dos necesidades contrapuestas suponen retos sumamente críticos en el campo excepcional de clasificación de esperma con fines comerciales de cría. Por lo tanto, aunque estos dos aspectos -una manipulación y una orientación con cuidado- son quizás aplicables de forma independiente en una variedad de casos, en muchos casos pueden actuar de forma sinérgica. Tanto sus caracteres como sus interrelaciones sinérgicos son quizás más críticas en el campo comercial de clasificación de esperma. De modo interesante, parece que esta sinergia e interrelación potencial no han sido apreciadas completamente antes de la presente invención.
Vistos por separado, el aspecto de una orientación apropiada de una muestra que contiene partículas o células puede ser vista por lo tanto que desempeña un papel importante en la intensidad y en la calidad de la señal del citómetro de flujo y en la eficacia de clasificación. Se han realizado esfuerzos para orientar la muestra de forma hidrodinámica y se ha explorado en las últimas décadas el uso de la orientación hidrodinámica de la muestra en flujo a través de sistemas y citómetros de flujo (Fulwyler, 1977, J. Histochem. Cytochem. 25: 781-783; Karbel et al., 1977, J. Histochem. Cytochem. 25: 774-780; Dean et al., supra). La orientación hidrodinámica de la muestra dentro del citómetro de flujo puede mejorar la medición precisa del contenido relativo de tinción del ADN y también puede proporcionar una medición potencialmente útil de parámetros morfológicos tal como grosor de las células y grado de curvatura de la cara plana. Para algunas aplicaciones, esta orientación es sencilla. No obstante, cuando hay implicadas células delicadas (tal como espermatozoides) u otras partículas, ha sido necesaria, sin embargo, una técnica más cuidadosa. Por ejemplo, incluso se ha utilizado un tubo de inyección de muestras con una punta con forma de cuña en algunos intentos por aumentar el porcentaje de las células orientadas (Dean et al., 1978, Biophys. J. 23: 1-5; Fulwyler, 1977, J. Histochem. Cytochem. 25: 781-783; Johnson et al., 1986, Cytometry 7: 268-273; Pinkel et al., 1982, Cytometry 3: 1-9; Welch et al., 1994, Cytometry 17 (supl. 7): 74). Debido a esta punta con forma de cuña del tubo de inyección de muestras, la corriente de muestras tendía a ser aspirada en una banda delgada por el fluido envolvente a diferencia de lo que ocurre en una corriente cilíndrica. Las células con cabezas planas tal como espermatozoides de mamíferos, encontraron a menudo el fluido envolvente a una mayor velocidad (100 mm/seg), y fueron giradas de forma que sus lados planos se encontraban en el plano de la banda. Por desgracia, la separación del evento de orientación y el evento de análisis final pueden provocar resultados que no llegan a ser óptimos. Por lo tanto, esta técnica no ha mostrado ser prácticamente tan ventajosa como se desea.
En una aplicación distinta, Kachel y sus colegas (Kachel et al., supra) demostraron la ley de similitud y expusieron tres tipos de recorridos de flujo que influyen en las partículas en movimiento. Concluyeron que, para conseguir una orientación radial uniforme con fuerzas hidrodinámicas para partículas planas tales como hematíes aplanados, el recorrido preferente de flujo sería aquel en mediante el cual se obtuviese una constricción unilateral. El recorrido de flujo más sencillo que exhibe una mayor constricción unilateral en uso con un sistema de flujo a través del mismo se haría de un tubo con un corte transversal elipsoidal, y también terminaría en una salida elipsoidal. En una disposición, el eje largo de esta salida elipsoidal estaría ubicado con un ángulo recto al eje largo en el corte transversal del tubo elíptico de constricción. Sin embargo, dado que la salida elíptica no produce el tipo de gotitas deseado para un citómetro de flujo de alta velocidad clasificador de células, no se prevé que esta disposición sea utilizada en un citómetro de flujo, y por lo visto no ha sido aplicada a uno.
En un intento similar, Rens y sus colegas diseñaron una punta de boquilla que tenía un interior elíptico y un orificio elíptico de salida (Rens et al., 1998,...
Reivindicaciones:
1. Un procedimiento de procesamiento de muestras de citometría de flujo, que comprende las etapas de:
2. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 1, en el que dicha superficie interior de torsión única similar a una elipse (c) tiene una elipticidad que varía a lo largo de su longitud y que comprende, además, la etapa de variar de manera homogénea dicha elipticidad de dicha superficie interior de torsión única similar a una elipse (c).
3. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 1, y que comprende, además, las etapas de:
4. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 3, en el que dicha etapa de sometimiento de dicha muestra a una primera superficie (21) de movimiento axial en una boquilla (6) comprende la etapa de sometimiento de dicha muestra a una primera superficie (24) de aceleración axial en dicha boquilla (6) y en el que dicha etapa de sometimiento de dicha muestra a dicha segunda superficie (22) de movimiento axial en dicha boquilla (6) comprende la etapa de sometimiento de dicha muestra a una segunda superficie (25) de aceleración axial, en el que se produce una transición en dichas superficies primera y segunda (21/22) de movimiento axial de máxima diferenciación de la aceleración.
5. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 3, en el que se combinan dichas fuerzas hidrodinámicas de torsión única y dicha máxima diferenciación de la aceleración y están escogidas de manera afirmativa de forma que no superen las capacidades prácticas de dicha muestra en su longitud.
6. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 5, en el que dicha etapa de transición a una segunda superficie (22) de movimiento axial en dicha boquilla (6) comprende la etapa de sometimiento de dicha muestra a una superficie unitaria.
7. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 6, en el que dicha etapa de transición a una segunda superficie (22) de movimiento axial en dicha boquilla (6) comprende la etapa de sometimiento de dicha muestra a un orificio unitario (15) de salida.
8. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 3, y que comprende, además, las etapas de:
9. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 3, y que comprende, además, la etapa de presurizar dicha boquilla (6) hasta una presión de al menos 344,7 kPa.
10. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 8, en el que dicha etapa de inyectar una muestra dentro de dicho fluido envolvente (2) en un punto de inyección comprende la etapa de inyectar espermatozoides no humanos dentro de dicho fluido envolvente (2).
11. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 9, en el que dicha etapa de inyectar una muestra dentro de dicho fluido envolvente (2) en un punto de inyección comprende la etapa de inyectar espermatozoides no humanos dentro de dicho fluido envolvente (2).
12. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 3, 6, 7, 8 o 9, en el que dicha etapa de inyectar una muestra dentro de dicho fluido envolvente (2) en un punto de inyección comprende la etapa de inyectar espermatozoides seleccionados del grupo constituido por espermatozoides bovinos y espermatozoides equinos dentro de dicho fluido envolvente (2).
13. Un procedimiento como se describe en la reivindicación 10 u 11, en el que se procesan espermatozoides no humanos.
14. Un procedimiento como se describe en la reivindicación 13, en el que se procesan espermatozoides bovinos o espermatozoides equinos.
15. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 1, en el que dicha etapa de establecer una superficie interior de torsión única ahusada similar a una elipse (c) en dicha boquilla (6) comprende la etapa de ahusar gradualmente dicha superficie interior de torsión única similar a una elipse (c).
16. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 15, en el que dicha etapa de ahusar gradualmente dicha superficie interior de torsión única similar a una elipse (c) comprende la etapa de establecer un ahusamiento a aproximadamente 23º.
17. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 1, en el que dicha etapa de orientar dicha muestra con dichas fuerzas hidrodinámicas de torsión única comprende la etapa de someter mínimamente a un par dicha muestra.
18. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 17, en el que dicha muestra recorre una distancia después de llevar a cabo dicha etapa de generar fuerzas hidrodinámicas de torsión única desde dicha superficie de torsión única y antes de llevar a cabo dicha etapa de hacer salir dicha muestra de dicha boquilla (6) y comprende, además, la etapa de minimizar dicha distancia.
19. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 18, en el que dicha etapa de hacer salir dicha muestra de dicha boquilla (6) se produce en un orificio (15) de salida y en el que dicha etapa de minimizar dicha distancia comprende establecer la distancia desde dicho punto de inyección hasta dicho orificio (15) de salida a aproximadamente 6 mm.
20. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 8, en el que dicha muestra está orientada como se describe en la reivindicación 19.
21. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 1, en el que dicha etapa de inyectar una muestra dentro de dicho fluido envolvente (2) en un punto de inyección comprende la etapa de inyectar espermatozoides en un tampón compatible con esperma dentro de dicho fluido envolvente (2).
22. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 21, y que comprende, además, las etapas de:
23. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 21, y que comprende, además, la etapa de recoger dichos espermatozoides después de llevar a cabo dicha etapa de clasificación de dichas gotas.
24. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 22, en el que dicha etapa de inyectar espermatozoides en un tampón compatible con esperma dentro de dicho fluido envolvente (2) comprende la etapa de inyectar espermatozoides en un tampón compatible con esperma dentro de dicho fluido envolvente seleccionado del grupo constituido por espermatozoides equinos y espermatozoides bovinos.
25. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 24, en el que dicha muestra está orientada como se describe en la reivindicación 19.
26. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 16 o 19, y que comprende, además, las etapas de:
27. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 26, en el que se combinan dichas fuerzas hidrodinámicas de torsión única y dicha máxima diferenciación de la aceleración y están escogidas de manera afirmativa, de forma que no se superen las capacidades prácticas de dicha muestra en su longitud.
28. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 27, en el que dicha etapa de transición a una segunda superficie (22) de movimiento axial en dicha boquilla (6) comprende la etapa de sometimiento de dicha muestra a una superficie unitaria.
29. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 28, en el que dicha etapa de transición a una segunda superficie (22) de movimiento axial en dicha boquilla (6) comprende la etapa de sometimiento de dicha muestra a un orificio unitario (15) de salida.
30. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 26, y que comprende, además, las etapas de:
31. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 26, y que comprende, además, la etapa de presurizar dicha boquilla (6) a una presión de al menos 344,7 kPa.
32. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 30, en el que dicha etapa de inyectar una muestra dentro de dicho fluido envolvente (2) en un punto de inyección comprende la etapa de inyectar espermatozoides dentro de dicho fluido envolvente (2).
33. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 31, en el que dicha etapa de inyectar una muestra dentro de dicho fluido envolvente (2) en un punto de inyección comprende la etapa de inyectar espermatozoides dentro de dicho fluido envolvente (2).
34. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 26, en el que dicha etapa de inyectar una muestra dentro de dicho fluido envolvente (2) en un punto de inyección comprende la etapa de inyectar espermatozoides seleccionados del grupo constituido por espermatozoides bovinos y espermatozoides equinos dentro de dicho fluido envolvente (2).
35. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 29, en el que dicha etapa de inyectar una muestra dentro de dicho fluido envolvente (2) en un punto de inyección comprende la etapa de inyectar espermatozoides seleccionados del grupo constituido por espermatozoides bovinos y espermatozoides equinos dentro de dicho fluido envolvente (2).
36. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 30, en el que dicha etapa de inyectar una muestra dentro de dicho fluido envolvente (2) en un punto de inyección comprende la etapa de inyectar espermatozoides seleccionados del grupo constituido por espermatozoides bovinos y espermatozoides equinos dentro de dicho fluido envolvente (2).
37. Un procedimiento de procesamiento de muestras de citometría de flujo como se describe en la reivindicación 31, en el que dicha etapa de inyectar una muestra dentro de dicho fluido envolvente (2) en un punto de inyección comprende la etapa de inyectar espermatozoides seleccionados del grupo constituido por espermatozoides bovinos y espermatozoides equinos dentro de dicho fluido envolvente (2).
38. Un procedimiento de creación de un espécimen sexado de esperma que comprende la etapa de producir un espécimen sexado de esperma como se describe en la reivindicación 32, y en el que dicha etapa de inyectar una muestra dentro de dicho fluido envolvente (2) en un punto de inyección comprende la etapa de inyectar espermatozoides dentro de dicho fluido envolvente (2).
39. Un procedimiento de creación de un espécimen sexado de esperma que comprende la etapa de producir un espécimen sexado de esperma como se describe en la reivindicación 36, y en el que dicha etapa de inyectar espermatozoides dentro de dicho fluido envolvente (2) comprende la etapa de inyectar espermatozoides seleccionados del grupo constituido por espermatozoides bovinos y espermatozoides equinos dentro de dicho fluido envolvente (2).
40. Un procedimiento como se describe en la reivindicación 36, en el que se procesan espermatozoides bovinos o espermatozoides equinos.
Patentes similares o relacionadas:
 DISPOSITIVO MODULAR DESTINADO AL ANALISIS DE UN FLUIDO BIOLOGICO, EN PARTICULAR SANGUINEO, del 1 de Diciembre de 2010, de HORIBA ABX SAS: Dispositivo modular destinado a ser utilizado en un sistema de análisis de un fluido biológico, comprendiendo dicho dispositivo modular unos módulos funcionales […]
DISPOSITIVO MODULAR DESTINADO AL ANALISIS DE UN FLUIDO BIOLOGICO, EN PARTICULAR SANGUINEO, del 1 de Diciembre de 2010, de HORIBA ABX SAS: Dispositivo modular destinado a ser utilizado en un sistema de análisis de un fluido biológico, comprendiendo dicho dispositivo modular unos módulos funcionales […]
 PROCEDIMIENTO Y DISPOSITIVO PARA LA IDENTIFICACION Y CARACTERIZACION SECUENCIAL DE UNIDADES DISCRETAS EN SUSPENSION EN UN CHORRO CAPILAR EN REGIMEN DE FLUJO LAMINAR, MEDIANTE UN SENSOR OPTICO O ELECTROMAGNETICO, del 1 de Agosto de 2007, de UNIVERSIDAD DE SEVILLA: Procedimiento y dispositivo para la identificación y caracterización secuencial de unidades discretas en suspensión en un chorro capilar en régimen de flujo laminar, […]
PROCEDIMIENTO Y DISPOSITIVO PARA LA IDENTIFICACION Y CARACTERIZACION SECUENCIAL DE UNIDADES DISCRETAS EN SUSPENSION EN UN CHORRO CAPILAR EN REGIMEN DE FLUJO LAMINAR, MEDIANTE UN SENSOR OPTICO O ELECTROMAGNETICO, del 1 de Agosto de 2007, de UNIVERSIDAD DE SEVILLA: Procedimiento y dispositivo para la identificación y caracterización secuencial de unidades discretas en suspensión en un chorro capilar en régimen de flujo laminar, […]
PROCEDIMIENTO Y DISPOSITIVO DE REGISTRO AUTOMÁTICO DE LA LOCOMOCIÓN DE NEMATODOS U ORGANISMOS PEQUEÑOS DE TAMAÑOS SIMILARES POR INTERFEROMETRÍA TEMPORAL DE MICROHACES DE LUZ, del 23 de Julio de 2020, de PHYLUMTECH S.A: Procedimiento y dispositivo de registro automático de la locomoción de nematodos u organismos pequeños de tamaños similares por interferometría temporal de microhaces […]
Monitor de aerosol en tiempo real, del 17 de Junio de 2020, de Wuxi Maitong Scientific Instrument Co., Ltd: Un monitor de aerosol en tiempo real, que comprende: un conjunto de fuente de luz láser , configurado para emitir un rayo láser y generar […]
Módulo transductor y método para usar el módulo transductor, del 6 de Mayo de 2020, de BECKMAN COULTER, INC.: Un módulo transductor para analizar una muestra de sangre completa, que comprende: una cubeta de lectura relativamente fija configurada […]
Método para evaluar el envejecimiento celular, del 6 de Mayo de 2020, de Sibelius Limited: Un método para tamizar y seleccionar al menos un compuesto de prueba que tiene un efecto sobre la vida útil cronológica de una población de organismos […]
Celdas de flujo óptico monolíticas y método de fabricación, del 15 de Abril de 2020, de BECKMAN COULTER, INC.: Método para producir una celda (30, 30', 30", 90) de flujo óptico monolítica, transparente, del tipo usado para caracterizar cuerpos formados que pasan a través de la misma, teniendo […]
Caracterización de partículas en cavidad de resonador óptico abierta, del 8 de Abril de 2020, de Oxford University Innovation Limited: Un método para detectar características de partículas polarizables en un fluido , el método que usa una cavidad óptica abierta que comprende […]