USO DE DLK1 COMO INHIBIDOR DE ANGIOGÉNESIS.
Uso de Dlk1 como inhibidor de angiogénesis.
La presente invención se refiere al uso de de una construcción génica que comprende una secuencia codificante de Dlk1 o la proteína recombinante que resulta de la expresión de dicha construcción génica para la preparación de un medicamento para la inhibición de la angiogénesis,
preferentemente la angiogénesis tumoral. También forma parte de la invención el uso de un producto de la expresión de Dlk1 o de cualquiera de sus fragmentos como biomarcador para la determinación de la angiogénesis o de su progresión. Así mismo, también se refiere a un método de determinación de angiogénesis patológica o de su progresión. También se refiere al uso de un kit que comprende la secuencia que codifica para dlk1 o cualquiera de sus productos de expresión para el diagnóstico de angiogénesis patológica.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201031547.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC).
Nacionalidad solicitante: España.
Inventor/es: LAMAS PELÁEZ,Santiago, RODRÍGUEZ PÉREZ,Patricia, HIGUERAS LÓPEZ,María Ángeles, LABORDA FERNÁNDEZ,Jorge.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/18 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Factores de crecimiento; Reguladores de crecimiento.
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- A61P35/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 35/00 Agentes antineoplásicos. › específicos para la metástasis.
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
Fragmento de la descripción:
Uso de Dlk1 como inhibidor de angiogénesis La presente invención se refiere al uso de una construcción génica que comprende una secuencia codificante de Dlk1 o a la proteína recombinante que resulta de la expresión de dicha construcción génica para la preparación de un medicamento para la inhibición de la angiogénesis. Este uso permite tratar y prevenir la formación de nuevos vasos sanguíneos y por lo tanto es útil para el tratamiento y prevención de procesos angiogénicos patológicos tales como la angiogénesis tumoral.
ESTADO DE LA TÉCNICA ANTERIOR
La angiogénesis consiste en la formación de nuevas ramificaciones de vasos sanguíneos a partir de vasos sanguíneos existentes. La angiogénesis se produce por la destrucción local de la pared de los vasos sanguíneos preexistentes, la proliferación de las células endoteliales, la migración de las mismas y la organización de éstas en estructuras tubulares alrededor de las cuales se forman las paredes de los vasos sanguíneos. En adultos, la angiogénesis está muy controlada y se activa únicamente en procesos como la reparación de heridas, hipoxia y durante el ciclo reproductivo femenino (Samaranayake et al. 2010. Hum Gene Ther 21:381-396) . El aumento descontrolado y/o excesivo de la angiogénesis está asociado a diversas patologías tales como cáncer, aterosclerosis, retinopatía diabética, artritis reumatoide, psoriasis y degeneración macular. Sin la activación de la angiogénesis, se ha descrito que la hipoxia en tumores sólidos no permite crecer al tumor y provoca la muerte de células tumorales (Karamysheva 2008. Biochemistr y (Mosc.) 73:751-762; y Folkman et al 1992. J Biol Chem 267:10931-10934) . Por todo esto, la inhibición de la angiogénesis es una herramienta de gran utilidad en la terapia antitumoral. La terapia antiangiogénica en tumores se ha centrado hasta la fecha en la inhibición del factor de crecimiento vascular (VEGF) utilizando anticuerpos neutralizantes frente al mismo o frente a sus receptores como herramientas antiangiogénicas. Sin embargo, se hace necesaria una alternativa ya que los anticuerpos neutralizantes frente a VEGF no producen ni una reducción del tumor ni un aumento de la supervivencia significativos, además de presentar un elevado coste de producción (Samaranayake et al. 2010. Hum Gene Ther 21:381-396) .
La vía de señalización de Notch juega un importante papel en la formación de vasos sanguíneos. Se ha descrito la inducción de la expresión endotelial del ligando de Notch Delta-like 1 (Dll1) en la arteriogénesis postnatal inducida por isquemia en ratones (Limbourg et al. 2007. Cir Res 100:363-371) . Por otra parte, el uso del bloqueo de la función del receptor Notch utilizando una forma soluble del receptor Notch1 se ha demostrado útil para la inhibición de la angiogénesis en estudios in vitro e in vivo en dermis murina tras inducción con VEGF y en xenotransplantes murinos de tumores mamarios y de neuroblastoma (Funahashi et al. 2008. Cancer Res 68:4727-4735) . Sin embargo, no se ha descrito hasta la fecha el uso de una proteína relacionada con la familia Notch "Delta-like homolog 1" (dlk1) en la inhibición de la angiogénesis.
El gen Dlk1 codifica para dlk1, una proteína transmembrana que pertenece a la familia que contiene repeticiones de EGF (factor de crecimiento epitelial) a la que también pertenecen proteínas como los receptores Notch y sus ligandos (familia Delta-Notch-Serrate) . Dlk1 (también llamado Pref-1, "Fetal antigen-1" o pG2) está muy expresado en el embrión y la placenta durante el desarrollo, sin embargo, en tejidos adultos su expresión se reduce considerablemente llegando incluso a desaparecer, con la excepción de la expresión en las células$ del páncreas, la médula ósea, la pituitaria y la glándula adrenal (Yevtodiyenko et al. 2006. Dev Dynamics 235:1115-1123; Jensen et al. 1993. Hum Reprod 8:635-641; Larsen et al. 1996. Lancet 347:191; y Tornehave et al. 1996. Histochem Cell Biol 106:535-542) . Dlk1 participa en el control de diferenciación de diversos procesos, entre los que se incluye diferenciación neuroendocrina, diferenciación de hepatocitos, hematopoyesis, osteogénesis y adipogénesis (WO9413701; Nueda et al 2007. J Mol Biol 367:1281-1293) . Dlk1 también se ha relacionado con el proceso de reparación de heridas ya que se ha detectado expresión de Dlk1 en un tejido mesenquimal no diferenciado de la zona de reparación de tejido de la oreja de ratones MRL y C57BL/6 siendo en los primeros donde más se expresa Dlk1 y los que mayor capacidad de reparación tisular presentan (Samulewicz et al. 2002. Wound Repair Regen 10:215-221) .
En relación a la implicación de Dlk1 en angiogénesis, se ha descrito que en el embrión, la expresión de Dlk1 se ha relacionado con la formación de vasos sanguíneos embrionarios en ratón ya que se ha visto su expresión en el endotelio en desarrollo de diversos vasos sanguíneos (por ejemplo en las arterias cerebrales) así como en los vasos sanguíneos fetales de la placenta (Yevtodiyenko et al. 2006. Dev Dynamics 235:1115-1123) . Sin embrago, no se ha descrito hasta la fecha el uso de la sobreexpresión de Dlk1 en la inhibición de la angiogénesis.
La sobreexpresión de Dlk1 se ha probado hasta la fecha en adipogénesis pero no en angiogénesis. En adipogénesis se ha visto que la sobreexpresión de Dlk1 activa o inhibe la adipogénesis dependiendo del contexto celular, previniendo la adipogénesis en la línea celular 3T3-L1 pero activando la adipogénesis en la línea celular C3H10T1/2 (Nueda et al. 2007. J Mol Biol 367:1281-1293) . Además, se ha sugerido la interacción de Dlk1 con Notch1 in vivo y su participación en la cascada de señalización de Notch1 en la regulación de los procesos de adipogénesis al expresar Dlk1 en una línea celular de ratón (Balb/c 14 que expresa Notch1 pero no Dlk1) y comprobar que la expresión forzada Dlk1 provoca una disminución en la actividad de Notch (Baladrón et al. 2005. Exp Cell Res 303:343-359) .
También se ha descrito el uso de la sobreexpresión de Dlk1 en hematopoyesis. El uso de una fracción soluble de Dlk1 humano resulta útil para inhibir la diferenciación de las células madre hematopoyéticas, resultados que se han obtenido mediante transfección estable del cDNA de Dlk1 humano (WO9731647) .
EXPLICACIÓN DE LA INVENCIÓN
El problema técnico que resuelve la invención es un medicamento alternativo para la inhibición de la angiogénesis obtenido mediante el uso de una construcción génica que comprende la secuencia que codifica para Dlk1. También forma parte de la presente invención el uso de la proteína recombinante resultante de la expresión de la construcción génica que comprende la secuencia que codifica para Dlk1 para la preparación de un medicamento para la inhibición de la angiogénesis. En ambos casos también se contempla el uso para la inhibición de procesos patológicos que cursan con angiogénesis (angiogénesis patológica) tales como cáncer, aterosclerosis, retinopatía diabética, artritis reumatoide, psoriasis y degeneración macular. Dado que en la actualidad no existe ningún tratamiento efectivo para la angiogénesis patológica, entre ella la angiogénesis tumoral, se hace necesaria una alternativa que proporcione un tratamiento efectivo para dicha patología.
La invención describe el uso de una construcción génica que comprende la secuencia que codifica para Dlk1 o un equivalente biológico funcional de la misma para la preparación de un medicamento para el tratamiento de patologías en las que sea necesaria la inhibición de la angiogénesis. Este uso permite prevenir la formación de nuevos vasos sanguíneos y por lo tanto esta nueva aplicación es una alternativa para mejorar la efectividad de los tratamientos antiangiogénicos, incluidos los tratamientos frente a la angiogénesis tumoral.
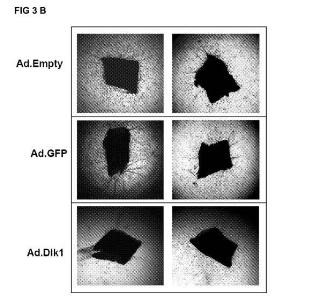
Con el fin de evaluar el potencial antiangiogénico de la secuencia que codifica para Dlk1 para la elaboración de un medicamento para prevenir la formación de vasos sanguíneos (angiogénesis) , se procedió a sobreexpresar Dlk1 en endotelio adulto (por lo tanto células diferenciadas) de modelos animales de angiogénesis mediante construcciones génicas. Las construcciones génicas utilizadas en la invención han sido plásmidos y adenovirus en las que el DNA complementario (cDNA) de Dlk1 se ha fusionado a secuencias marcadoras que permiten la selección de los recombinantes. Se han realizado ensayos in vitro con sistemas de Matrigel, ex vivo con explantes de aorta e in vivo con "plugs" (soportes) de Matrigel en modelos animales. Además, también se ha demostrado el uso de la construcción génica que comprende el cDNA...
Reivindicaciones:
1. Uso de una construcción génica que comprende la secuencia que codifica para dlk1 para la preparación de un medicamento para la inhibición de la angiogénesis.
2. Uso según la reivindicación 1, donde la angiogénesis es angiogénesis tumoral.
5. Uso según cualquiera de las reivindicaciones 1 a 3 donde la construcción génica comprende un adenovirus como vector. 6. Uso de la proteína recombinante que resulta de la expresión de la construcción génica descrita en cualquiera de las 15 reivindicaciones 1 a 5 para la preparación de un medicamento para la inhibición de la angiogénesis. 7. Uso de la proteína recombinante según la reivindicación 6 donde la angiogénesis es angiogénesis tumoral. 8. Uso según cualquiera de las reivindicaciones 1 a 7, donde el medicamento además comprende al menos un excipiente y/o al menos un vehículo farmacéuticamente aceptable. 9. Uso según cualquiera de las reivindicaciones 1 a 8, donde el medicamento además comprende al menos otro 20 principio activo. 10. Uso según cualquiera de las reivindicaciones 1 a 9, donde el medicamento se presenta en una forma adaptada a la administración por vía oral, parenteral o intradérmica. . FIG. 1 A FIG. 1 B FIG. 2 A FIG. 2 B FIG. 4 A FIG. 4 B 5 3. Uso según cualquiera de las reivindicaciones 1 ó 2 donde la construcción génica comprende un vector que se selecciona de la lista que comprende: plásmido, bácmido, cromosoma artificial de levaduras (YACs) , cromosoma artificial de bacterias (BACs) , cromosoma artificial derivado del bacteriófago P1 (PACs) , cósmico, virus con un origen de replicación heterólogo, adenovirus, retrovirus, lentivirus virus del Herpes simplex, o cualquiera de sus combinaciones.
10 4. Uso según cualquiera de las reivindicaciones 1 a 3 donde la construcción génica comprende un plásmido como vector.
FIG 3 A
Ad Tipo 5 (dE1/dE3) FIG 3 B FIG 3 C
Patentes similares o relacionadas:
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Composiciones que comprenden cócteles de fagos antibacterianos y usos de las mismas para el tratamiento de infecciones bacterianas, del 24 de Junio de 2020, de Tecnifar-Indústria Técnica Farmacêutica, S.A: Una composicion que comprende: una primera y una segunda cepa purificada de bacteriofago, cada una de dichas cepas que tiene un genoma que comprende […]
Trampas de GDF, del 3 de Junio de 2020, de ACCELERON PHARMA, INC: Un polipéptido aislado que comprende la secuencia de aminoácidos de SEQ ID NO: 28.
Combinacion de peptidos tolerogenos con TFG-â para inducir y mantener la tolerancia oral en mamiferos jovenes, del 3 de Junio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición nutricional - que contiene al menos un péptido de cinco hasta doce aminoácidos de longitud e incluye una secuencia elegida entre […]
Formulaciones con oxidación reducida, del 3 de Junio de 2020, de F. HOFFMANN-LA ROCHE AG: Una formulación líquida que comprende un anticuerpo y un compuesto que previene la oxidación del anticuerpo en la formulación líquida, en la que el compuesto es […]
Composiciones para lograr niveles plasmáticos deseados del factor 2 de crecimiento glial, del 6 de Mayo de 2020, de ACORDA THERAPEUTICS, INC: Factor de crecimiento glial 2 (GGF2) para su uso en la promocion de la remielinizacion celular en un paciente, donde el GGF2 se administra al paciente en una cantidad de […]
Modulación de la actividad del factor de crecimiento epidérmico de unión a heparina para la curación de la membrana timpánica, del 6 de Mayo de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un agente que proporciona actividad de factor de crecimiento epidérmico de unión a heparina (HB-EGF) para su uso en el tratamiento de una perforación crónica de la membrana […]