PROTEINAS DE FUSION CON UN DOMINO LECTINA DE TIPO BETA-TREBOL, PROCEDIMIENTO DE OBTENCION Y SUS APLICACIONES.
Proteínas de fusión con un dominio lectina de tipo beta-trébol,
procedimiento de obtención y sus aplicaciones.
La presente invención describe un nuevo método general de expresión y purificación de proteínas de fusión conteniendo un dominio peptídico lectina beta-trébol como etiqueta de afinidad y solubilidad. Esta etiqueta permite producir diferentes proteínas de fusión solubles con elevados rendimientos y purificarlas mediante un protocolo de purificación eficaz, sencillo y de bajo coste. Dicho protocolo está basado en la capacidad del péptido para unir azúcares derivados de galactosa y consta de una sola etapa de cromatografía de afinidad que emplea matrices derivadas de agarosa y lactosa como eluyente
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200800909.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC).
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: MANCHEO GOMEZ,JOSE MARIA, ANGULO HERRERA,IVAN.
Fecha de Solicitud: 2 de Abril de 2008.
Fecha de Publicación: .
Fecha de Concesión: 9 de Julio de 2010.
Clasificación Internacional de Patentes:
- C07K14/42 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Lectinas, p. ej. concanavalina, fitohemaglutinina.
- C12N15/62 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Secuencias de ADN que codifican proteínas de fusión.
Clasificación PCT:
Fragmento de la descripción:
Proteínas de fusión con un dominio lectina de tipo ß-trébol, procedimiento de obtención y sus aplicaciones.
Sector de la técnica
La invención se puede encuadrar de un modo genérico en el sector de la biotecnología, con evidentes aplicaciones en el campo farmacéutico y, actualmente, en el desarrollo de proyectos de genómica estructural de alto rendimiento. De un modo más concreto, la invención se encuadraría en los procesos de producción y purificación de proteínas de fusión.
Estado de la técnica
El exitoso desarrollo de proyectos de genómica ocurrido en los últimos años ha permitido obtener una vasta cantidad de información genética, especialmente de organismos procariotas, en donde el número de genomas secuenciados se contará por miles en pocos años (Abby, S. & Daubin, V. (2007). Trends Microbiol. 15, 135-141). Un factor decisivo de este éxito ha sido, sin duda alguna, la homogeneidad química y estructural de los ácidos nucleicos, lo cual ha permitido desarrollar protocolos de secuenciación de alto rendimiento ("high throughput") de carácter universal. Actualmente, en la era post-genómica, el interés se dirige principalmente al análisis funcional y estructural de las proteínas codificadas por dichos genomas. En este sentido, y a diferencia de los ácidos nucleicos, las proteínas son química y estructuralmente mucho más heterogéneas, lo cual supone de facto la imposibilidad de desarrollar protocolos de alto rendimiento universales para la purificación y caracterización estructural de estas moléculas (Waugh, D.S. (2005). Trends Biotechnol. 23, 316-320). Otros problemas relevantes asociados al diseño de este tipo de procesos de alto rendimiento es el bajo rendimiento en la producción y la escasa solubilidad de muchas de las proteínas sobre-expresadas (Esposito, D. & Chatterjee, D.K. (2006). Curr. Opin. Biotechnol. 17, 353-358). Esto último ha conducido a la búsqueda de sistemas de sobre-expresión de proteínas recombinantes alternativos al que puede considerarse el sistema de expresión por excelencia: la bacteria Escherichia coli. Algunos sistemas considerados están basados en células eucariotas de mamífero, levaduras o de insectos (Greene, J.J. (2004). Methods Mol. Biol. 267, 3-14; Daly, R. & Hearn, M.T. (2005). J. Mol. Recognit. 18, 119-138; Kost, T.A., Condreay, J.P. & Jarvis, D.L. (2005). Nat. Biotechnol. 23, 567-575) o bien sistemas libres de células (Murthy, T.V., Wu, W., Qiu, Q.Q., Shi, Z. Labaer, J. & Brizuela, L. (2004). Prot. Expr. Purif. 36, 217-225). No obstante, el bajo coste, la facilidad de manejo y de escalado de cultivos siguen haciendo de E. coli el sistema de sobre-expresión prácticamente universal (Esposito, D. & Chatterjee, D.K. (2006). Curr. Opin. Biotechnol. 17, 353-358).
Una aproximación empleada actualmente en el desarrollo de protocolos de alto rendimiento universales de producción/purificación de proteínas en E. coli es el uso de etiquetas de afinidad ("affinity tag") (Waugh, D.S. (2005). Trends Biotechnol. 23, 316-320; Arnau, J., Lauritzen, C., Petersen, G.E. & Petersen, J. (2006). Prot. Express. Purif. 48, 1-13). Estas etiquetas son proteínas o péptidos que, fusionados a la proteína recombinante de interés, idealmente permitirían aumentar el rendimiento de su expresión, incrementar su solubilidad y desarrollar un protocolo simple y eficaz de purificación. Se puede afirmar que actualmente no existe una etiqueta de afinidad que reúna estas características de un modo general o universal; de hecho, se considera que el uso combinado de varias etiquetas podría ser una posible solución al diseño de estrategias generales (Waugh, D.S. (2005). Trends Biotechnol. 23, 316-320). Obviamente, el empleo sistemático de esta aproximación combinatorial requiere de un conocimiento preciso de las ventajas e inconvenientes de las correspondientes etiquetas individuales.
En la Tabla I y Tabla III se muestran las principales etiquetas de afinidad ("affinity tag") pues permiten desarrollar protocolos de purificación genéricos basados en cromatografías de afinidad, mientras que en la Tabla II, aparecen etiquetas que en algunos casos se ha comprobado actúan como "agentes solubilizantes" ("solubility enhancers").
(Tabla pasa a página siguiente)
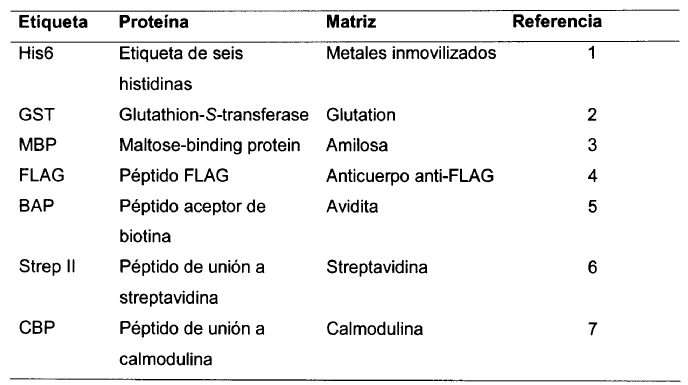

Hoy día el interés se centra principalmente en MBP, GST, NusA y Trx. No obstante y teniendo en cuenta, por un lado, que estudios recientes demuestran una baja eficacia de GST (Dyson, M.R., Shadbolt, S.P., Vincent, K.J., Perera, R.L. & McCafferty, J. (2004). BMC Biotechnol. 4, 32) y Trx (Marblestone, J.G., Edavettal., S.C., Lim, Y., Lim, P., Zuo, X. & Butt, T.R. (2006). Prot. Sci. 15, 182-189) como agentes solubilizantes en E. coli y, por otro, que NusA, aun con una eficacia similar a MBP como agente solubilizante, no permite desarrollar un protocolo de purificación inmediato (Davis, G.D., Elisee, C., Newham, D.M. & Harrison, R.G. (1999). Biotechnol. Bioeng. 65, 382-388; Dummler, A., Lawrence, A.M. & de Marco, A. (2005). Microb. Cell Fact. 4, 34), MBP ha devenido una de las etiquetas de afinidad sobre la que más interés se tiene y una de las más ampliamente estudiadas (Dyson, M.R., Shadbolt, S.P., Vincent, K.J., Perera, R.L. & McCafferty, J. (2004). BMC Biotechnol. 4, 32; Braud, S., Moutiez, M., Belin, P., Abello, N., Drevet, P., Zinn-Justin, S., Courcon, M., Masson, C., Dassa, J. & Charbonnier, J.B. (2005). J. Proteome Res. 4, 2137-2147). Asimismo, puede afirmarse que la eficacia de estas etiquetas es función de la proteína "acompañante" (Dyson, M.R., Shadbolt, S.P., Vincent, K.J., Perera, R.L. & McCafferty, J. (2004). BMC Biotechnol. 4, 32), lo cual no es sino reflejo de la diversidad química y estructural de las proteínas....
Reivindicaciones:
1. Proteína de fusión recombinante caracterizada porque comprende, al menos, una secuencia del siguiente grupo:
2. Procedimiento de obtención de la proteína de fusión según reivindicación 1 caracterizado porque comprende las siguientes etapas:
y, opcionalmente
3. Construcción genética codificante de la secuencia de ADN codificante de la proteína de fusión según reivindicación 1 caracterizada porque comprende, al menos, una secuencia del siguiente grupo:
4. Construcción genética según reivindicación 3 caracterizada porque comprende cualquier otra secuencia de nucleótidos codificante de un péptido o secuencia peptídica que permita el aislamiento, la detección o la secreción al exterior de la célula del péptido expresado, por ejemplo, a título ilustrativo y sin que limite el alcance de la invención, una secuencia de polihistidina (6xHis), una secuencia peptídica reconocible por un anticuerpo monoclonal (por ejemplo, para su identificación, o cualquier otra que sirva para purificar la proteína de fusión resultante por cromatografía de inmunoafinidad: péptidos etiqueta tales como c-myc, HA, E-tag).
5. Vector de expresión caracterizado porque comprende una construcción genética según reivindicaciones 3 y 4 que permite la expresión de una proteína o péptido.
6. Vector de expresión según reivindicación 5 caracterizado porque el vector es un plásmido o un vector viral.
7. Célula huésped caracterizada porque comprende la construcción genética según reivindicaciones 3 y 4 o el vector de expresión según reivindicaciones 5 y 6, preferentemente una célula procariota.
8. Célula huésped según reivindicación 7 caracterizada porque está constituida por una célula E. coli., preferentemente células E. coli BL21 DE3.
Patentes similares o relacionadas:
Cadena ligera de enteroquinasa modificada, del 22 de Julio de 2020, de NOVO NORDISK A/S: Un análogo de la cadena ligera de la enteroquinasa bovina que comprende una secuencia de aminoácidos establecida en la SEQ ID NO: 1, en donde dicho análogo comprende […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Métodos y composiciones para ingeniería genómica, del 3 de Junio de 2020, de Sangamo Therapeutics, Inc: Una pareja de nucleasas de dedo de zinc (ZFN) que comprende una ZFN izquierda y una ZFN derecha, comprendiendo cada ZFN un dominio de escisión […]
Métodos y composiciones para escisión dirigida y recombinación, del 20 de Mayo de 2020, de Sangamo Therapeutics, Inc: Un método in vitro para la escisión selectiva de un gen HLA clase I, un gen HLA que codifica una proteína de clase 1 del Complejo de Histocompatibilidad Mayor (MHC) […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Etiqueta de epítopo y método de detección, captura y/o purificación de polipéptidos etiquetados, del 15 de Abril de 2020, de ChromoTek GmbH: Péptido epítopo aislado que tiene de 12 a 25 aminoácidos, en donde la secuencia de aminoácidos comprende una secuencia según se define en SEQ ID NO: 32 (X1X2RX4X5AX7SX9WX11X12), […]
Utilización diagnóstica de un polipéptido de fusión que comprende una proteína vírica y un enzima MGMT, del 15 de Abril de 2020, de INSTITUT PASTEUR: Utilización in vitro de un polipéptido de fusión que comprende una proteína vírica y i) el enzima 6-metilguanina-ADN-metiltransferasa (MGMT, EC 2.1.1.63) o un homólogo […]