Procedimiento para preparar 4-aminobut-2-enólidos.
Procedimiento para la preparación de 4-aminobut-2-enólidos de fórmula (I)**Fórmula**
en la que
R1 representa alquilo C1-C12,
haloalquilo C1-C12, alquenilo C2-C12, haloalquenilo C2-C12, alquinilo C2-C12, cicloalquilo C3-C8, cicloalquil C3-C8-alquilo (C1-C12), halocicloalquilo C3-C8, alcoxi C1-C12, alcoxi C1-C12-alquilo (C1-C12), halocicloalquil C3-C8-alquilo (C1-C12) o arilalquilo, o
A representa pirid-2-ilo o pirid-4-ilo o representa pirid-3-ilo, que está sustituido dado el caso en la posición 6 con flúor, cloro, bromo, metilo, trifluorometilo o trifluorometoxi o representa piridazin-3-ilo, que está sustituido dado el caso en la posición 6 con cloro o metilo o representa pirazin-3-ilo o 2-cloro-pirazin-5-ilo o 1,3-tiazol-5-ilo, que está sustituido dado el caso en la posición 2 con cloro o metilo, o
A representa un resto pirimidinilo, pirazolilo, tiofenilo, oxazolilo, isoxazolilo, 1,2,4-oxadiazolilo, isotiazolilo, 1,2,4-triazolilo o 1,2,5-tiadiazolilo, que está sustituido dado el caso con flúor, cloro, bromo, ciano, nitro, alquilo C1-C4, que está sustituido dado el caso con flúor y/o cloro, alquil C1-C3-tio que está sustituido dado el caso con flúor y/o cloro, o alquil C1-C3-sulfonilo que está sustituido dado el caso con flúor y/o cloro, o A representa un resto **Fórmula**
en el que
X representa halógeno, alquilo C1-C12 o haloalquilo C1-C12
Y representa halógeno, alquilo C1-C12, haloalquilo C1-C12, haloalcoxi C1-C12, azido o ciano caracterizado porque en
la etapa (i) se hace reaccionar éster de ácido 4-haloacético de fórmula general (II)**Fórmula**
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/007269.
Solicitante: BAYER CROPSCIENCE AG.
Nacionalidad solicitante: Alemania.
Dirección: ALFRED-NOBEL-STRASSE 50 40789 MONHEIM ALEMANIA.
Inventor/es: LUI, NORBERT, HEINRICH,JENS-DIETMAR.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C227/08 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 227/00 Preparación de compuestos que contienen grupos amino y carboxilo unidos a la misma estructura carbonada. › por reacción de amoniaco o de aminas con ácidos que contienen grupos funcionales.
- C07C229/30 C07C […] › C07C 229/00 Compuestos que contienen grupos amino y carboxilo unidos a la misma estructura carbonada. › siendo la estructura carbonada acíclica e insaturada.
- C07D307/58 C07 […] › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 307/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros que tienen un átomo de oxígeno como único heteroátomo del ciclo. › Un átomo de oxígeno, p. ej. butenoluro.
PDF original: ES-2463996_T3.pdf
Fragmento de la descripción:
Procedimiento para preparar 4-aminobut-2-enólidos La presente invención se refiere a un procedimiento para la preparación de 4-aminobut-2-enólidos, así como de los compuestos intermedios y de partida correspondientes que intervienen o se usan en el procedimiento según lainvención. Otro objeto de la presente invención son procedimientos para la preparación de los compuestosintermedios o de partida correspondientes.
Del documento EP 0539588 A1 se conocen determinados compuestos 4-aminobut-2-enólidos sustituidos como compuestos con actividad insecticida. Además, las solicitudes de patente WO 2007/115644, WO 2007/115643 y WO2007/115646 describen también compuestos correspondientes 4-aminobut-2-enólidos de actividad insecticida.
H. Böhme “Kondensationsprodukte aus gamma-Chloracetatessigester und primären aromatischen oder heteroaromatischen Aminen”, Arch. Pharm. 310, 1976, páginas 26 – 29 divulga la reacción de anilina con gammacloracetoacetato (Ia) en sustancia, es decir sin disolventes. Además los componentes se juntan en presencia de ácido sulfúrico y se agitan varios días a elevada temperatura. Sin embargo la reacción según la invención no se divulga.
En general, los compuestos enaminocarbonílicos se sintetizan a partir de ácido tetrónico y una amina, según el esquema 1 siguiente. Este modo de proceder se describe, por ejemplo, en el documento EP 0539588 A1, así comoen Heterocycles vol. 27, n° 8, páginas 1907 a 1923 (1988) .
Esquema 1:
En este procedimiento es desventajoso, en particular, que como compuesto de partida se necesita ácido tetrónico anhidro, cuya preparación es laboriosa y costosa.
De este modo, por lo general, el ácido tetrónico se prepara a partir de éster acetoacético a través de una bromación y una subsiguiente hidrogenación (véase Synthetic Communication, 11 (5) , páginas 385 a 390 (1981) ) . En ello, elrendimiento total de ácido tetrónico a partir de éster acetoacético es inferior al 40%, lo que hace que el procedimiento sea poco atractivo desde el punto de vista industrial.
En el documento CH-PS 503722 se describe otro procedimiento para la preparación de ácido tetrónico. En este sehace reaccionar éster 4-cloroacetoacético con una amina aromática para dar 3-arilaminocrotonolactona y el ácido tetrónico se libera a continuación mediante tratamiento con ácidos minerales. La desventaja de este procedimiento reside en que el aislamiento del ácido tetrónico solamente es posible por sublimación en alto vacío, lo que hace queeste procedimiento sea asimismo poco atractivo desde el punto de vista industrial.
En el documento EP 0153615 A se describe otro procedimiento para la preparación de ácido tetrónico, en el que se parte de ésteres 2, 4-dicloroacetoacéticos. Este procedimiento, igualmente de varias etapas y laborioso, suministra el compuesto deseado asimismo con un rendimiento total moderado de tan solo el 65%.
En Tetrahedron Letters, n° 31, páginas 2683 y 2684 (1974) se describe la preparación de ácido tetrónico y de uncompuesto enaminocarbonílico correspondiente. La síntesis descrita en este artículo se reproduce en el esquema 2 siguiente. Como reactante se usa aquí éster dimetílico de ácido acetilenodicarboxílico.
Esquema 2:
Además, del estado de la técnica se conoce un procedimiento para la preparación de 4-aminobut-2-enólidos a partir de tetronato de metilo (J. Heterocyclic Chem., 21, 1753 (1984) ) . Como material de partida para este procedimiento se usa éster de ácido 4-bromo-3-metoxibut-3-enocarboxílico, que es asimismo costoso.
Otro procedimiento parte de un éster 4-cloroacetoacético, que se hace reaccionar con aminas (Heterocycles, vol. 27, n° 8, 1988, páginas 1907 a 1923) . La reacción para dar aminofurano se realiza en un paso. A este respecto, la amina se añade junto con ácido acético glacial a una disolución de éster 4-cloroacetoacético en benceno y la mezcla resultante se calienta a reflujo durante varias horas. Los rendimientos de 4-metilamino-2 (5H) -furanona en esta síntesis son solamente del 40%.
Del documento EP 0123095 A se conoce un procedimiento en el que se prepara amida de ácido tetrónico a partir deéster de ácido 3-amino-4-acetoxicrotónico. El éster de ácido 3-amino-4-acetoxicrotónico es costoso y de preparación laboriosa, de manera que no es posible una síntesis rentable con este procedimiento.
Otro procedimiento para la preparación de ácido tetrónico a partir de ésteres malónicos y cloruro de cloroacetilo seconoce de J. Chem. Soc., Perkin Trans. 1 (1972) , n° 9/10, páginas 1225 a 1231. Este procedimiento suministra el compuesto objetivo que se desea con un rendimiento de tan solo el 43%.
En la solicitud de patente internacional WO 2007/115644 mencionada anteriormente se describe la preparación de 4-aminobut-2-enólidos, por ejemplo, de 4-[[ (6-cloropiridin-3-il) metil]- (3, 3-dicloroprop-2-en-1-il) amino]furan-2 (5H) -ona, mediante la reacción de 4-[[ (6-cloropiridin-3-il) metil]amino]furan-2 (5H) -ona con 3-bromo-1, 1-dicloroprop-1-eno (véanse los ejemplos de preparación, procedimiento 2, ejemplo (3) ) . El documento PCT/EP2007/002386 describe también la preparación de 4-aminobut-2-enólidos, por ejemplo, de 4-[[ (6-cloropiridin-3-il) metil]- (3, 3-dicloroprop-2-en1-il) amino]furan-2 (5H) -ona, mediante la reacción de 4-[ (2-fluoroetil) amino]furan-2 (5H) -ona con 2-cloro-5clorometilpiridina (véanse los ejemplos de preparación, procedimiento 3, ejemplo (4) ) . Preferentemente, las reacciones se realizan con hidruros de litio o de sodio. Por lo general, estos sustratos son costosos y, a la vez, dedifícil manejo por razones de seguridad. Por el contrario, en el procedimiento según la invención se usan bases económicas y de más fácil manejo en cuanto a tecnología de seguridad, por ejemplo NaOH.
El objetivo de la presente invención consistió en la puesta a disposición de un procedimiento nuevo y rentable parapreparar compuestos 4-aminobut-2-enólidos y para preparar compuestos de partida para este procedimiento.
Además se divulga un procedimiento para preparar compuestos de la fórmula general (IVa) o (IVb)
en la que A representa pirid-2-ilo o pirid-4-ilo o bien pirid-3-ilo, el cual, dado el caso, está sustituido en la posición 6 con flúor, cloro, bromo, metilo, trifluorometilo o trifluorometoxi, o piridazin-3-ilo, el cual, dado el caso, está sustituido en la posición 6 con cloro o metilo, o pirazin-3-ilo o 2-cloropirazin-5-ilo o 1, 3-tiazol-5-ilo, el cual, dado el caso, está sustituido en la posición 2 con cloro o metilo, o A representa un resto pirimidinilo, pirazolilo, tiofenilo, oxazolilo, isoxazolilo, 1, 2, 4-oxadiazolilo, isotiazolilo, 1, 2, 4triazolilo o 1, 2, 5-tiadiazolilo, el cual, dado el caso, está sustituido con flúor, cloro, bromo, ciano, nitro, alquilo C1-C4 (el cual, dado el caso, está sustituido con flúor y/o cloro) , alquiltio C1-C3 (el cual, dado el caso, está sustituidocon flúor y/o cloro) o alquilsulfonilo C1-C3 (el cual, dado el caso, está sustituido con flúor y/o cloro) ,
o A representa un resto en el que X representa halógeno, alquilo o haloalquilo, Y representa halógeno, alquilo, haloalquilo, haloalcoxi, azido o ciano,
R1 representa alquilo, haloalquilo, alquenilo, haloalquenilo, alquinilo, cicloalquilo, cicloalquilalquilo,
halocicloalquilo, alcoxi, alcoxialquilo, halocicloalquilalquilo o arilalquilo, R2 representa alquilo C1-C12, arilo C5-C8 o arilalquilo, preferentemente alquilo C1-C6, con preferencia especial metilo o etilo y
Hal representa cloro, bromo o yodo, 10 caracterizado porque se hace reaccionar un éster 4-haloacetoacético de la fórmula general (II)
en la que R2 y Hal tienen los significados mencionados anteriormente, a) con una amina de la fórmula (IIIa)
en la que R1 tiene el significado mencionado anteriormente, para dar un compuesto de la fórmula (IVa) , o b) con una amina de la fórmula (IIIb) H2N-CH2-A (IIIb) en la que A tiene el significado mencionado anteriormente, para dar un compuesto de la fórmula (IVb) . Objeto de la presente invención es un procedimiento según la reivindicación 1 para preparar 4-aminobut-2-enólidos 20 de la fórmula general (I)
en la que A y R1 tienen los significados mencionados anteriormente, caracterizado porque se hace reaccionar un éster 4haloacetoacético de la fórmula general (II)
en la que R2 y Hal tienen los significados mencionados anteriormente, a) con una amina de la fórmula (IIIa)
en la que R1 tiene el significado mencionado anteriormente, para dar un compuesto de la fórmula (IVa) ,
a continuación el compuesto de la fórmula (IVa) sufre una ciclación térmica en presencia de un... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la preparación de 4-aminobut-2-enólidos de fórmula (I)
en la que R1 representa alquilo C1-C12, haloalquilo C1-C12, alquenilo C2-C12, haloalquenilo C2-C12, alquinilo C2-C12, cicloalquilo C3-C8, cicloalquil C3-C8-alquilo (C1-C12) , halocicloalquilo C3-C8, alcoxi C1-C12, alcoxi C1-C12-alquilo (C1-C12) , halocicloalquil C3-C8-alquilo (C1-C12) o arilalquilo, o A representa pirid-2-ilo o pirid-4-ilo o representa pirid-3-ilo, que está sustituido dado el caso en la posición 6
con flúor, cloro, bromo, metilo, trifluorometilo o trifluorometoxi o representa piridazin-3-ilo, que está sustituido dado el caso en la posición 6 con cloro o metilo o representa pirazin-3-ilo o 2-cloro-pirazin-5-ilo o 1, 3-tiazol-5-ilo, que está sustituido dado el caso en la posición 2 con cloro o metilo, o A representa un resto pirimidinilo, pirazolilo, tiofenilo, oxazolilo, isoxazolilo, 1, 2, 4-oxadiazolilo, isotiazolilo, 1, 2, 4-triazolilo o 1, 2, 5-tiadiazolilo, que está sustituido dado el caso con flúor, cloro, bromo, ciano, nitro,
alquilo C1-C4, que está sustituido dado el caso con flúor y/o cloro, alquil C1-C3-tio que está sustituido dado el caso con flúor y/o cloro, o alquil C1-C3-sulfonilo que está sustituido dado el caso con flúor y/o cloro, o A representa un resto en el que X representa halógeno, alquilo C1-C12 o haloalquilo C1-C12
Y representa halógeno, alquilo C1-C12, haloalquilo C1-C12, haloalcoxi C1-C12, azido o ciano caracterizado porque en la etapa (i) se hace reaccionar éster de ácido 4-haloacético de fórmula general (II)
en la que R3 representa alquilo C1-C12, fenilo o arilalquilo, y Hal representa Cl, Br, o I,
en presencia de un disolvente a presión normal y a temperaturas de 20º C a 60º C 30 variante a) : con una amina de fórmula (IIIa) en la que R1 tiene el significado citado anteriormente, dando el compuesto de fórmula (IVa)
o variante b) : con una amina de fórmula (IIIb) H2N-CH2-A (IIIb) en la que A tiene el significado anteriormente citado, dando un compuesto de fórmula (IVb) ,
separándose en la variante a) y variante b) el disolvente por destilación o a vacío en el intervalo de temperatura de 20º C a 35º C;
y a continuación en la etapa (II) el compuesto de fórmula (IVa) se cicla térmicamente dando un compuesto de fórmula (Va) o el compuesto de fórmula (IVb) dando un compuesto de fórmula (Vb)
en las que A y R1 tienen los significados anteriormente citados, respectivamente en presencia de un disolvente a una temperatura de 40º C a 150º C, aislándose el compuesto de fórmula (Va) o (Vb) respectivamente mediante cristalización o por separación
del disolvente; y en la etapa (iii) variante a) : se hace reaccionar el compuesto de fórmula (Va) con un compuesto de fórmula (Va)
A-CH2-E (VIa)
en donde en la fórmula (VIa)
A tiene el significado anteriormente citado, y
E representa un grupo saliente que se selecciona entre cloro, bromo, yodo, mesilato, tosilato y SO2Me o (iii) variante b) : el compuesto de fórmula (Vb) se hace reaccionar con un compuesto de fórmula (VIb)
R1-E (VIb)
en donde en la fórmula (VIb)
R1 tiene el significado anteriormente citado, y
E representa un grupo saliente, que se selecciona entre cloro, bromo, yodo, mesilato, tosilato ySO2Me.
2. El procedimiento según la reivindicación 1, caracterizado porque la reacción del compuesto de fórmula (Va) se15 realiza con un compuesto de fórmula (VIa) o (Vb) con el compuesto de fórmula (VIb) en presencia de una base.
3. El procedimiento según la reivindicación 2, caracterizado porque la base es hidróxido de sodio o hidróxido de potasio.
4. El procedimiento según la reivindicación 2, caracterizado porque la base es una amina terciaria seleccionada entre trimetilamina, trietilamina, tributilamina, N, N-dimetilanilina, N, N-dimetilbencilamina, piridina, 2-metil-5
etilpiridina, N-metilpiperidina, N-metilpirrolidona, N, N-dimetilaminopiridina, diazabiciclooctano (DABCO) , diazabiciclononeno (DBN) y diazabicicloundeceno (DBU) .
5. El procedimiento según una de las reivindicaciones 2 a 4, caracterizado porque la relación molar de base a compuesto usado de fórmula (Va) o (Vb) es 0, 5 a 10.
6. El procedimiento según una de las reivindicaciones 1 a 5, caracterizado porque en la reacción del compuesto
de fórmula (Va) con el compuesto de fórmula (VIb) o el compuesto de fórmula (Vb) con el compuesto de fórmula (VIb) está presente un catalizador de transferencia de fase, que se selecciona entre compuestos de amonio cuaternario o de fosfonio cuaternario.
7. Procedimiento según una de las reivindicaciones 1 a 6, caracterizado porque la reacción (i) del compuesto defórmula (II) con la amina de fórmula (IIIa) o (IIIb) tiene lugar en presencia de un ácido de Lewis.
8. El procedimiento según la reivindicación 7, caracterizado porque el ácido de Lewis se selecciona entre ácido acético, ácido p-toluensulfónico y ácido trifluoroacético.
9. El procedimiento según una de las reivindicaciones 1 a 6, caracterizado porque en la reacción (i) del compuestode fórmula (II) con la amina de fórmula (IIIa) o (IIIb) la amina está presente en forma de una sal.
10. El procedimiento según una de las reivindicaciones 1 a 9 para la preparación de un compuesto de fórmula (I) en35 la que A representa 6-fluoro-pirid-3-ilo, 6-cloro-pirid-3-ilo, 6-bromo-pirid-3-ilo, 6-metil-pirid-3-ilo, 6-trifluorometilpirid-3-ilo, 6-trifluorometoxipirid-3-ilo, 6-cloro-1, 4-piridazin-3-ilo, 6-metil-1, 4-piridazin-3-ilo, 2-cloro-1, 6-tiazol5-ilo o 2-metil-1, 3-tiazol-5-ilo, 2-cloro-pirimidin-5-ilo, 2-trifluorometil-pirimidin-5-ilo, 5, 6-difluoro-pirid-3-ilo, 5cloro-6-fluoro-pirid-3-ilo, 5-bromo-6-fluoro-pirid-3-ilo, 5-yodo-6-fluoro-pirid-3-ilo, 5-fluoro-6-cloro-pirid-3-ilo,
5, 6-dicloro-pirid-3-ilo, 5-bromo-6-cloro-pirid-3-ilo, 5-yodo-6-cloro-pirid-3-ilo, 5-fluoro-6-bromo-pirid-3-ilo, 5 cloro-6-bromo-pirid-3-ilo, 5, 6-dibromo-pirid-3-ilo, 5-fluoro-6-yodo-pirid-3-ilo, 5-cloro-6-yodo-pirid-3-ilo, 5bromo-6-yodo-pirid-3-ilo, 5-metil-6-fluoro-pirid-3-ilo, 5-metil-6-cloro-pirid-3-ilo, 5-metil-6-bromo-pirid-3-ilo, 5metil-6-yodo-pirid-3-ilo, 5-difluorometil-6-fluoro-pirid-3-ilo, 5-difluorometil-6-cloro-pirid-3-ilo, 5-difluormetil-6bromo-pirid-3-ilo o 5-difluorometil-6-yodo-pirid-3-ilo, y
R1 representa alquilo C1-C5, alquenilo C2-C5, cicloalquilo C-3-C5, cicloalqui.
3. C5-alquilo o alcoxi C1-C6-alquilo (C1-C6) dado el caso sustituidos con flúor.
11. El procedimiento según una de las reivindicaciones 1 a 9 para la preparación de un compuesto de fórmula (I) enla que A representa 6-fluoro-pirid-3-ilo, 6-cloro-pirid-3-ilo, 6-bromopirid-3-ilo, 6-cloro-1, 4-piridazin-3-ilo, 2-cloro-1, 3
tiazol-5-ilo, 2-cloro-pirimidin-5-ilo, 5-fluoro-6-cloro-pirid-3-ilo, 5, 6-dicloro-pirid-3-ilo, 5-bromo-6-cloro-pirid-3ilo, 5-fluoro-6-bromo-pirid-3-ilo, 5-cloro-6-bromo-pirid-3-ilo, 5, 6-dibromo-pirid-3-ilo, 5-metil-6-cloro-pirid-3-ilo, 5-cloro-6-iodpirid-3-ilo o 5-difluormetil-6-cloro-pirid-3-ilo, y
R1 representa metilo, etilo, propilo, vinilo, alilo, propargilo, ciclopropilo, alcoxi C1-C6-alquilo (C1-C6) , 2-fluoroetilo, 2, 2-difluoro-etilo o 2-fluoro-ciclopropilo.
12. El procedimiento según una de las reivindicaciones 1 a 9 para la preparación de un compuesto de fórmula (I) en la que A representa 6-fluoro-pirid-3-ilo, 6-cloro-pirid-3-ilo, 6-bromo-pirid-3-ilo, 2-cloro-1, 3-tiazol-5-ilo, 5-fluoro-6cloro-pirid-3-ilo, 5-fluoro-6-bromo-pirid-3-ilo o 5, 6-dicloro-pirid-3-ilo, y
R1 representa metilo, etilo, n-propilo, n-prop-2-enilo, n-prop-2-inilo, ciclopropilo, metoxietilo, 2-fluorometilo o 2, 2-difluoro-etilo.
Patentes similares o relacionadas:
Nuevos análogos de la estrigolactona y su utilización para el tratamiento de plantas, del 20 de Julio de 2016, de INSTITUT NATIONAL DE LA RECHERCHE AGRONOMIQUE (INRA): Compuesto de fórmula general (I):**Fórmula** en la que: X representa un átomo de oxígeno, un átomo de azufre, NH o un radical N-alquilo, R1 y […]
PROCEDIMIENTO DE OBTENCIÓN DE LACTONAS ENANTIOMÉRICAMENTE PURAS CON CATALIZADORES SÓLIDOS, del 22 de Octubre de 2014, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a procedimiento para la síntesis de lactonas cíclicas enantioméricamente puras, como por ejemplo el (S)-γ-hidroximetil-α,β-butenólido […]
PROCEDIMIENTO DE OBTENCIÓN DE LACTONAS ENANTIOMÉRICAMENTE PURAS CON CATALIZADORES SÓLIDOS, del 25 de Septiembre de 2014, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a procedimiento para la síntesis de lactonas cíclicas enantioméricamente puras, como por ejemplo el (S)-y-hidroximetil-¿,ß-butenólido […]
Procedimiento para la preparación de compuestos enaminocarbonilos y su uso para la preparación de 4-aminobut-2-enólidos, del 20 de Noviembre de 2013, de BAYER CROPSCIENCE AG: Procedimiento para preparar compuestos de la fórmula (IVa) en la que R1 representa metilo, etilo, n-propilo, n-prop-2-enilo, n-prop-2-inilo, […]
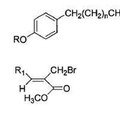 PROCEDIMIENTO PARA LA SÍNTESIS DE LACTONAS DERIVADAS DEL ÁCIDO p-HIDROXIFENIL PROPIÓNICO MEJORADO, del 22 de Octubre de 2012, de APOTEKNOS PARA LA PIEL S.L: La presente invención se refiere a mejoras a la patente principal P201001288 por "Procedimiento para la síntesis de lactonas derivadas del ácido […]
PROCEDIMIENTO PARA LA SÍNTESIS DE LACTONAS DERIVADAS DEL ÁCIDO p-HIDROXIFENIL PROPIÓNICO MEJORADO, del 22 de Octubre de 2012, de APOTEKNOS PARA LA PIEL S.L: La presente invención se refiere a mejoras a la patente principal P201001288 por "Procedimiento para la síntesis de lactonas derivadas del ácido […]
Profármacos de análogos de GABA, composiciones y sus usos, del 10 de Mayo de 2012, de XENOPORT, INC.: Un compuesto seleccionado entre acido (S) -3-{[ (α-isobutanoiloxietoxi) carbonil]aminometil}-5-metilhexanoico y sales farmaceuticamente aceptables, hidratos […]
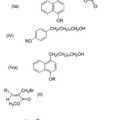 PROCEDIMIENTO PARA LA SINTESIS DE LACTONAS DERIVADAS DEL ACIDO p-HIDROXIFENIL PROPIONICO, del 7 de Mayo de 2012, de APOTEKNOS PARA LA PIEL S.L: Procedimiento para la síntesis de lactonas derivadas del ácido p-hidroxifenil propiónico, en forma de mezclas de diasteroisómeros cis/trans de fórmula (I) o (Ia),
****IMAGEN-01****
donde […]
PROCEDIMIENTO PARA LA SINTESIS DE LACTONAS DERIVADAS DEL ACIDO p-HIDROXIFENIL PROPIONICO, del 7 de Mayo de 2012, de APOTEKNOS PARA LA PIEL S.L: Procedimiento para la síntesis de lactonas derivadas del ácido p-hidroxifenil propiónico, en forma de mezclas de diasteroisómeros cis/trans de fórmula (I) o (Ia),
****IMAGEN-01****
donde […]
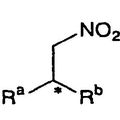 PROCEDIMIENTO PARA PRODUCIR UN COMPUESTO NITRO OPTICAMENTE ACTIVO, del 26 de Junio de 2009, de SUMITOMO CHEMICAL COMPANY, LIMITED
CARREIRA, ERICK M.: Procedimiento para producir un compuesto nitro ópticamente activo que presenta dos átomos de hidrógeno en su átomo de carbono alpha del mismo y que presenta […]
PROCEDIMIENTO PARA PRODUCIR UN COMPUESTO NITRO OPTICAMENTE ACTIVO, del 26 de Junio de 2009, de SUMITOMO CHEMICAL COMPANY, LIMITED
CARREIRA, ERICK M.: Procedimiento para producir un compuesto nitro ópticamente activo que presenta dos átomos de hidrógeno en su átomo de carbono alpha del mismo y que presenta […]