PROCEDIMIENTO DE PREPARACIÓN DE LAPACHOL Y DERIVADOS.
Procedimiento de síntesis de lapachol y sus derivados de fórmula I donde los significados para los distintos sustituyentes son los indicados en la descripción.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201031447.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC).
Nacionalidad solicitante: España.
Inventor/es: MOLINA ORDEN,MARIA TERESA, FERNÁNDEZ CID,IRIA.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C46/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › Preparación de quinonas.
- C07C50/32 C07C […] › C07C 50/00 Quinonas (para los métidos de quinonas, ver las cetonas insaturadas en las que un grupo cetona forma parte de un ciclo). › formando parte la estructura quinoide de un sistema cíclico condensado de dos ciclos.
- C07D311/92 C07 […] › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 311/00 Compuestos heterocíclicos que contienen ciclos de seis miembros que contienen un átomo de oxígeno como único heteroátomo, condensados con otros ciclos. › Naftopiranos; Naftopiranos hidrogenados.
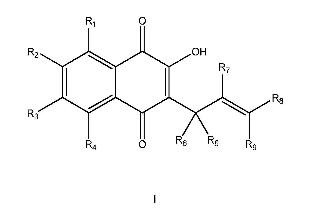
Fragmento de la descripción:
Procedimiento de preparación de lapachol y derivados.
La presente invención se refiere a un procedimiento de síntesis de lapachol y sus derivados, además la presente invención se refiere a la obtención del 1-lapachona y a-lapachona.
ESTADO DE LA TÉCNICA
El lapachol es una naftoquinona que se aisló por primera vez por E. Paterno de la Tabebuia avellanedae en el año 1882. El interés del lapachol radica en la gran variedad de aplicaciones terapéuticas en que se ha demostrado su actividad, tales como, antiulceroso, anticanceroso, antiedémico, antiinflamatorio, antimalárico, antiséptico, anticanceroso, antiviral, bactericida, fungicida y virucida.
Se han descrito numerosas síntesis del lapachol así como de dos derivados del mismo, la 1-lapachona y la alapachona. No sólo el lapachol, sino también sus derivados, a- y 1-lapachona poseen una importante actividad farmacológica. En particular, la 1-lapachona posee actividad antiangiogénica, antiinflamatoria y, muy especialmente, antitumoral, habiendo alcanzado ensayos clínicos en fase II para cáncer de próstata, siendo activa por sí sola o en combinación con otros antitumorales (genisteina, taxol) .
Ninguna de las síntesis descrita del lapachol supera el 45% de rendimiento global (véase por ejemplo las páginas 154 a 156 del artículo de Hidayat Hussain y colaboradores, ARKIVOC 2007 (ii) 145-171 y las referencias citadas en el mismo) .
Por tanto, sería deseable proporcionar un procedimiento de preparación del lapachol, 1-lapachona y a-lapachona más eficiente con un rendimiento superior al descrito hasta la fecha y con menor impacto ambiental.
DESCRIPCIÓN DE LA INVENCIÓN
Un aspecto de la invención se refiere a un procedimiento de síntesis de los compuestos de fórmula I que comprende una etapa de reacción entre un compuesto de fórmula II y un compuesto de fórmula III:
cada R1, R2, R3 y R4 independientemente representan hidrógeno, C1-8alquilo, hidroxiC1-8alquilo, haloC1-8alquilo, C18alcoxiC1-8alquilo, cianoC1-8alquilo, Cy1C1-8alquilo, C2-8alquenilo, C2-8alquinilo, halógeno, -CN, -NR10R10 -OR10 o Cy1, donde cada Cy1 está opcionalmente sustituido independientemente por uno o más R11;
cada R5, R6, R7, R8 y R9 independientemente representan hidrógeno, C1-8alquilo, hidroxiC1-8alquilo, haloC1-8alquilo, C1-8alcoxiC1-8alquilo, cianoC1-8alquilo, Cy1C1-8alquilo, halógeno, -CN, -NR10R10, -OR10 o Cy1, donde Cy1 está opcionalmente sustituido por uno o más R11;
cada R10 independientemente representa hidrógeno o C1-8alquilo;
cada R11 independientemente representa C1-8alquilo, hidroxiC1-8alquilo, haloC1-8alquilo, C1-8alcoxiC1-8alquilo, cianoC18alquilo, halógeno, -CN, -NR10R10 o -OR10; y cada Cy1 representa independientemente un anillo monocíclico de 3 a 7 miembros o bicíclico de 6 a 11 miembros que puede ser carbocíclico o heterocíclico en cuyo caso puede contener de 1 a 4 heteroátomos seleccionados de N, S y O, donde dicho anillo puede ser saturado, parcialmente insaturado o aromático, y puede estar unido al resto de la molécula a través de cualquier átomo de C o N disponible, y donde uno o más átomos de C o S del anillo están opcionalmente oxidados formando grupos CO, SO o SO2.
La presente invención también se refiere al procedimiento de síntesis de las sales y los solvatos de los compuestos de fórmula I tal y como se ha definido anteriormente.
Algunos compuestos de fórmula I pueden poseer centros quirales, los cuales pueden dar lugar a diversos estereoisómeros. La presente invención se refiere a cada uno de los estereoisómeros individuales así como a sus mezclas.
Otro aspecto de la presente invención se refiere a un procedimiento de síntesis de un compuesto de fórmula IV que comprende:
i) . la etapa de síntesis de un compuesto de fórmula I tal y como se ha definido anteriormente; y ii) . la etapa de síntesis de un compuesto de fórmula IV a partir de un compuesto de fórmula I y un ácido calentando a una temperatura entre 20 y 50 º C, preferiblemente entre 25 y 45 º C, y aún más preferiblemente a 30
º C:
comprende:
i) . la etapa de síntesis de un compuesto de fórmula I tal y como se ha definido anteriormente; y ii) . la etapa de síntesis de un compuesto de fórmula V a partir de un compuesto de fórmula I y un ácido calentado a una temperatura entre 50 y 90 º C, preferiblemente a unos 70 º C:
R1O R1O
R9
OH R2
O
R2
R7
R8
H
R8
R3
R3
R7
R4 O R5R6R9 R4 O R5R6
I V
donde R1, R2, R3, R4, R5, R6, R7, R8, y R9 tienen el significado descrito anteriormente.
En las definiciones anteriores, el término C1-8alquilo, como grupo o parte de un grupo, significa un grupo alquilo de cadena lineal o ramificada que contiene de 1 a 8 átomos de C e incluye los grupos metilo, etilo, propilo, isopropilo, butilo, isobutilo, sec-butilo, tert-butilo, pentilo, hexilo, heptilo y octilo.
Un grupo C2-8alquenilo significa una cadena alquílica lineal o ramificada que contiene de 2 a 8 átomos de C, y que además contiene uno o dos dobles enlaces. Ejemplos incluyen los grupos etenilo, 1-propenilo, 2-propenilo, isopropenilo, 1-butenilo, 2-butenilo, 3-butenilo, 1, 3-butadienilo, pentenilo, hexenilo, heptenilo y octenilo.
Un grupo C2-8alquinilo significa una cadena alquílica lineal o ramificada que contiene de 2 a 8 átomos de C, y que además contiene uno o dos triples enlaces. Ejemplos incluyen los grupos etinilo, 1-propinilo, 2-propinilo, 1-butinilo, 2butinilo, 3-butinilo, 1, 3-butadiinilo, pentinilo, hexinilo, heptinilo y octinilo.
Un grupo C1-8alcoxi, como grupo o parte de un grupo, significa un grupo -OC1-8alquilo, donde la parte C1-8alquilo tiene el mismo significado descrito anteriormente. Ejemplos incluyen metoxi, etoxi, propoxi, isopropoxi, butoxi, isobutoxi, sec-butoxi, tert-butoxi, pentoxi, hexiloxi, heptiloxi y octiloxi.
Un radical halógeno o su abreviatura halo significa fluoro, cloro, bromo o yodo.
Un grupo hidroxiC1-8alquilo significa un grupo resultante de la sustitución de uno o más átomos de hidrógeno de un grupo C1-8alquilo por uno o más grupos hidroxi. Ejemplos incluyen, entre otros, hidroximetilo, 1-hidroxietilo, 2hidroxietilo, 1, 2-dihidroxietilo, 3-hidroxipropilo, 2-hidroxipropilo, 1-hidroxipropilo, 2, 3-dihidroxipropilo, 4-hidroxibutilo, 3-hidroxibutilo, 2-hidroxibutilo y 1-hidroxibutilo.
Un grupo haloC1-8alquilo significa un grupo resultante de la sustitución de uno o más átomos de hidrógeno de un grupo C1-8alquilo por uno o más átomos de halógeno (es decir, fluoro, cloro, bromo o yodo) , que pueden ser iguales o diferentes. Ejemplos incluyen, entre otros, los grupos trifluorometilo, fluorometilo, 1-cloroetilo, 2-cloroetilo, 1fluoroetilo, 2-fluoroetilo, 2-bromoetilo, 2-yodoetilo, 2, 2, 2-trifluoroetilo, pentafluoroetilo, 3-fluoropropilo, 3-cloropropilo, 2, 2, 3, 3-tetrafluoropropilo, 2, 2, 3, 3, 3-pentafluoropropilo, heptafluoropropilo, 4-fluorobutilo y nonafluorobutilo.
Un grupo C1-8alcoxiC1-8alquilo significa un grupo resultante de la sustitución de uno o más átomos de hidrógeno de un grupo C1-8alquilo por uno o más grupos C1-8alcoxi según se han definido anteriormente, que pueden ser iguales o diferentes. Ejemplos incluyen, entre otros, los grupos metoximetilo, etoximetilo, propoximetilo, isopropoximetilo, butoximetilo, isobutoximetilo, sec-butoximetilo, tert-butoximetilo, dimetoximetilo, 1-metoxietilo, 2-metoxietilo, 2etoxietilo, 1, 2-dietoxietilo, 1-butoxietilo, 3-metoxipropilo, 2-butoxipropilo, 1-metoxi-2-etoxipropilo, 2-sec-butoxietilo, 3tert-butoxipropilo y 4-metoxibutilo.
Un grupo cianoC1-8alquilo significa un grupo resultante de la sustitución de uno o más átomos de hidrógeno de un grupo C1-8alquilo por uno o más grupos ciano. Ejemplos incluyen, entre otros, los grupos cianometilo, dicianometilo, 1-cianoetilo, 2-cianoetilo, 3-cianopropilo, 2, 3-dicianopropilo y 4-cianobutilo.
Un grupo Cy1 se refiere a un anillo monocíclico de 3 a 7 miembros o bicíclico de 6 a 11 miembros que puede ser carbocíclico o heterocíclico. Cuando es heterocíclico puede contener de 1 a 4 heteroátomos seleccionados de N, S y O. Cuando Cy1 es un anillo bicíclico,...
Reivindicaciones:
1. Procedimiento de síntesis de los compuestos de fórmula I que comprende una etapa de reacción entre un compuesto de fórmula II y un compuesto de fórmula III:
cada R5, R6, R7, R8 y R9 independientemente representan hidrógeno, C1-8alquilo, hidroxiC1-8 alquilo, haloC18alquilo, C1-8alcoxiC1-8alquilo, cianoC1-8alquilo, Cy1C1-8alquilo, halógeno, -CN, -NR10R10, -OR10 o Cy1, donde Cy1 está opcionalmente sustituido por uno o más R11;
cada R10 independientemente representa hidrógeno o C1-8alquilo;
cada R11 independientemente representa C1-8alquilo, hidroxiC1-8alquilo, haloC1-8alquilo, C1-8alcoxiC1-8alquilo, cianoC1-8alquilo, halógeno, -CN, -NR10R10 o -OR10; y cada Cy1 representa independientemente un anillo monocíclico de 3 a 7 miembros o bicíclico de 6 a 11 miembros que puede ser carbocíclico o heterocíclico en cuyo caso puede contener de 1 a 4 heteroátomos seleccionados de N, S y O, donde dicho anillo puede ser saturado, parcialmente insaturado o aromático, y puede estar unido al resto de la molécula a través de cualquier átomo de C o N disponible, y donde uno o más átomos de C
o S del anillo están opcionalmente oxidados formando grupos CO, SO o SO2.
2. Procedimiento según la reivindicación 1, donde cada R1, R2, R3 y R4 independientemente representan hidrógeno, C1-8alquilo, C2-8alquenilo, C2-8alquinilo, halógeno, -CN, -NR10R10 -OR10 o Cy1, donde cada Cy1 está opcionalmente sustituido independientemente por uno o más R11.
3. Procedimiento según la reivindicación 2, , donde cada R1, R2, R3 y R4 independientemente representan hidrógeno, C1-8alquilo, halógeno, -CN, -NR10R10 -OR10 o Cy1, donde cada Cy1 está opcionalmente sustituido independientemente por uno o más R11.
4. Procedimiento según cualquiera de las reivindicaciones 2 ó 3 donde donde cada R1, R2, R3 y R4 independientemente representan hidrógeno, C1-8alquilo, halógeno, -CN, -NR10R10 o -OR10.
5. Procedimiento según cualquiera de las reivindicaciones 2 a 4 donde cada R1, R2, R3 y R4 independientemente representan hidrógeno o C1-8alquilo, preferiblemente hidrógeno o metilo, y aún más preferiblemente hidrógeno.
6. Procedimiento según cualquiera de las reivindicaciones 1 a 5, donde cada R5, R6, R7, R8 y R9 independientemente representan hidrógeno, C1-8alquilo, halógeno, -CN, -NR10R10, -OR10 o Cy1, donde Cy1 está opcionalmente sustituido por uno o más R11.
7. Procedimiento según la reivindicación 6, donde cada R5, R6, R7, R8 y R9 independientemente representan hidrógeno, C1-8alquilo, halógeno, -CN, -NR10R10 o -OR10.
8. Procedimiento según cualquiera de las reivindicaciones 6 ó 7, donde cada R5, R6, R7, R8 y R9 independientemente representan hidrógeno o C1-8alquilo, preferiblemente hidrógeno o metilo.
9. Procedimiento según cualquiera de las reivindicaciones 6 a 8, donde:
cada R5, R6 y R7, independientemente representan hidrógeno; y cada R8 y R9 independientemente representan C1-8alquilo, preferiblemente metilo.
10. Procedimiento de síntesis de un compuesto de fórmula IV que comprende: i) . la etapa de síntesis de un compuesto de fórmula I obtenido por el procedimiento de cualquiera de las reivindicaciones 1 a 9; y ii) . la etapa de síntesis de un compuesto de fórmula IV a partir de un compuesto de fórmula I y un ácido calentando a una temperatura entre 20 y 50 º C, preferiblemente entre 25 y 45 º C, y aún más preferiblemente a 30 º C:
donde R1, R2, R3, R4, R5, R6, R7, R8, y R9I.
11. Procedimiento de síntesis de un compuesto de fórmula V que comprende: i) . la etapa de síntesis de un compuesto de fórmula I obtenido por el procedimiento de cualquiera de las reivindicaciones 1 a 9; y 10 ii) . la etapa de síntesis de un compuesto de fórmula V a partir de un compuesto de fórmula I y un ácido calentado a una temperatura entre 50 y 90 º C, preferiblemente a unos 70 º C: R1 O R1 O R9
O R8
R2 R2
R5 R6
H R3 R3 R7 R4 O R9 R4 OR5R6
R8
IV donde R1, R2, R3, R4, R5, R6, R7, R8, y R9 tienen el significado descrito para un compuesto de fórmula I.
12. Procedimiento según cualquiera de las reivindicaciones 10 u 11 donde el ácido se selecciona de ácido sulfúrico 15 o ácido clorhídrico.
OFICINA ESPAÑOLA DE PATENTES Y MARCAS
Nº solicitud: 201031447
ESPAÑA
Fecha de presentación de la solicitud: 29.09.2010
Fecha de prioridad:
INFORME SOBRE EL ESTADO DE LA TECNICA
51 Int. Cl. : Ver Hoja Adicional DOCUMENTOS RELEVANTES
Categoría 56 Documentos citados Reivindicaciones afectadas X HOOKER, S. C. "The Constitution of Lapachol and its derivatives. Part V. The Structure of Paterno's Isaopachone''. Journal of the American Chemical Society, 1936, Vol. 58, página 1190. Ver página 1191, columna 1, párrafo 2, Esquema, nota 11. 10-12 X BONIFAZI, E. L. et al. "Antiproliferative activity of synthetic naphtoquinones related to lapachol. First synthesis of 5-hydroxylapachol". Bioorganic & Medicinal Chemistr y , 2010, Vol. 18, páginas 2621-2630. Ver página 2622, columna 2, párrafo 3; página 2623, Esquemas 3 y 5. 10, 12 X SALAS, C. et al. "Tr y panosoma cruzi: Activities of lapachol and aand 1-lapachone derivatives against epimastigote and tr y pomastigote forms". Bioorganic & Medicinal Chemistr y , 2008, Vol. 16, página.66. 674. Ver página 672, apartado 4.1.4. 11, 12 A CLAESSENS, S. et al. "Synthesis of mollugin". Tetrahedron, 2006, Vol. 62, páginas 8419-8424. Ver Esquema 2. 1-12 A WO 9621355 A1 (BRITISH TECHNOLOGY GROUP LIMITED) 18.07.1996, reivindicaciones 1, 34, 38; Tabla 9, compuesto 31; ejemplo.
2. 29, 30-31. 1-9 Categoría de los documentos citados X: de particular relevancia Y: de particular relevancia combinado con otro/s de la misma categoría A: refleja el estado de la técnica O: referido a divulgación no escrita P: publicado entre la fecha de prioridad y la de presentación de la solicitud E: documento anterior, pero publicado después de la fecha de presentación de la solicitud El presente informe ha sido realizado • para todas las reivindicaciones • para las reivindicaciones nº : Fecha de realización del informe 02.04.2012 Examinador N. Martín Laso Página 1/4
INFORME DEL ESTADO DE LA TÉCNICA
Nº de solicitud: 201031447
CLASIFICACIÓN OBJETO DE LA SOLICITUD C07C46/00 (2006.01)
C07C50/32 (2006.01) C07D311/92 (2006.01) Documentación mínima buscada (sistema de clasificación seguido de los símbolos de clasificación)
C07C, C07D
Bases de datos electrónicas consultadas durante la búsqueda (nombre de la base de datos y, si es posible, términos de búsqueda utilizados) INVENES, EPODOC, WPI, TXT, BIOSIS, NPL, XPESP, CAS.
Informe del Estado de la Técnica Página 2/4
OPINIÓN ESCRITA
Nº de solicitud: 201031447
Fecha de Realización de la Opinión Escrita: 02.04.2012
Declaración
Novedad (Art. 6.1 LP 11/1986) Reivindicaciones Reivindicaciones 1-9 10-12 SI NO Actividad inventiva (Art. 8.1 LP11/1986) Reivindicaciones Reivindicaciones 1-9 10-12 SI NOSe considera que la solicitud cumple con el requisito de aplicación industrial. Este requisito fue evaluado durante la fase de examen formal y técnico de la solicitud (Artículo 31.2 Ley 11/1986) .
Base de la Opinión.
La presente opinión se ha realizado sobre la base de la solicitud de patente tal y como se publica.
Informe del Estado de la Técnica Página 3/4
OPINIÓN ESCRITA
Nº de solicitud: 201031447
1. Documentos considerados.
A continuación se relacionan los documentos pertenecientes al estado de la técnica tomados en consideración para la realización de esta opinión.
Documento Número Publicación o Identificación Fecha Publicación D01 HOOKER, S. C. "The Constitution of Lapachol and its derivatives. Part V. The structure of Paterno's Isaopachone''. Journal of the American Chemical Society, 1936, Vol. 58, página 1190. 1936 D02 BONIFAZI, E. L. et al. "Antiproliferative activity of synthetic naphtoquinones related to lapachol. First synthesis of 5hydroxylapachol". Bioorganic & Medicinal Chemistr y , 2010, Vol. 18, páginas 2621-2630. 23.02.2010 D03 SALAS, C. et al. "Tr y panosoma cruzi: Activities of lapachol and alfa-and beta-lapachone derivatives against epimastigote and tr y pomastigote forms". Bioorganic & Medicinal Chemistr y , 2008, Vol. 16, página.66. 674. 18.10.2007 D04 CLAESSENS, S. et al. "Synthesis of mollugin", Tetrahedron, 2006, Vol. 62, páginas 8419-8424. 07.07.2006 D05 WO 9621355 A1 (BRITISH TECHNOLOGY GROUP LIMITED) 18.07.1996
2. Declaración motivada según los artículos 29.6 y 29.7 del Reglamento de ejecución de la Ley 11/1986, de 20 de marzo, de Patentes sobre la novedad y la actividad inventiva; citas y explicaciones en apoyo de esta declaración
La solicitud se refiere al procedimiento de síntesis de naftoquinonas de formula general I a partir de hidroxinaftalenodionas de formula general II mediante alquilación con ácidos 1, y-insaturados y al procedimiento de preparación de naftoquinonas de formula general IV y V a partir de las naftoquinonas de formula general I.
El documento D01 divulga la preparación de las naftoquiononas a-Lapachona y 1-Lapachona partir de la naftoquinona Lapachol. La a-Lapachona se obtiene mediante calentamiento de Lapachol con ácido clorhídrico .
5. 60 º C y la 1-Lapachona puede obtenerse mediante calentamiento de Lapachol con ácido sulfúrico bien a 25º C o a 100º C (página 1191, columna 1, párrafo 2, Esquema, nota 11) .
Dado que el procedimiento de obtención de la naftoquinona de partida (Lapachol) no confiere a dicho producto características técnicas que le diferencien del mismo compuesto divulgado en el estado de la técnica, la invención definida en las reivindicaciones 10-12 de la solicitud se encuentra recogida en el documento D01, careciendo por tanto de novedad (Art. 6.1 LP 11/1986) .
El documento D02 divulga la preparación de la naftoquinona 1-Lapachona mediante tratamiento de la naftoquinona Lapachol con ácido sulfúrico diluido a temperatura ambiente (página 2622, columna 2, párrafo 3; página 2623, Esquemas 3 y 5) .
La invención definida en las reivindicaciones 10 y 12 de la solicitud es conocida del documento D02, por lo tanto carece de novedad (Art. 6.1 LP 11/1986) .
El documento D03 divulga la síntesis de la naftoquinona a-Lapachona a partir de Lapachol mediante calentamiento con ácido clorhídrico a 70º C durante 3 horas (página 672, apartado 4.1.4) .
Dado que la invención definida en las reivindicaciones 11 y 12 de la solicitud se encuentra divulgada en el documento D03, dicha invención carece de novedad (Art. 6.1 LP 11/1986) .
Sin embargo, en relación a las reivindicaciones 1-9 de la solicitud, aunque se recogen en el estado de la técnica distintos métodos de obtención de naftoquinonas a partir de hidroxinaftalenodionas mediante alquilación radicalaria (ver por ejemplo documentos D02: Esquema 3; D04: Esquema 2 ; D05: reivindicaciones 1, 34 y 38, Tabla 9, compuesto 31, ejemplo.
2. 29.
3. 31) ninguno de dichos documentos divulga ni dirige al experto en la materia hacia el desarrollo de un método de preparación de naftoquinonas de formula general I a partir de hidroxinaftalenodionas de formula general II en el que la alquilación se lleve a cabo con ácidos que sean 1, y-insaturados, sin llevar a cabo la necesaria experimentación.
Por lo tanto, la invención definida en las reivindicaciones 1-9 de la solicitud es nueva y posee actividad inventiva (Art. 6.1 y 8.1 LP 11/1986) .
Informe del Estado de la Técnica Página 4/4
Patentes similares o relacionadas:
Procedimiento para la ciclización biocatalítica de geranillinalool y los productos de ciclización obtenidos al respecto, del 4 de Julio de 2019, de BASF SE: Procedimiento para la ciclización biocatalítica de un compuesto de la fórmula (I)**Fórmula** en presencia de una ciclasa, que exhibe una secuencia […]
Materiales fotocrómicos, del 8 de Mayo de 2019, de TRANSITIONS OPTICAL, INC.: Un material fotocrómico que comprende un producto de reacción de: (a) al menos un monómero cíclico de apertura de anillo elegido de un éster cíclico […]
Materiales fotocrómicos con velocidad de desvanecimiento mejorada, del 4 de Abril de 2019, de TRANSITIONS OPTICAL, INC.: Un material fotocromico que esta esencialmente libre de grupos polimerizables insaturados, comprendiendo dicho material fotocromico: a) un indeno[2',3':3,4]nafto[1,2-b]pirano; […]
Compuestos fotocrómicos, del 21 de Marzo de 2019, de TRANSITIONS OPTICAL, INC.: A compuesto fotocrómico que comprende: (a) al menos un grupo fotocrómico PC que representa un pirano, y (b) al menos un agente de […]
Compuestos fotocrómicos, del 13 de Marzo de 2019, de TRANSITIONS OPTICAL, INC.: Un compuesto fotocromico no termicamente reversible representado por una de Formula X y Formula XI: **(Ver fórmula)** en donde: (a) A se selecciona entre nafto, benzo, […]
Compuestos fotocrómicos, del 8 de Noviembre de 2017, de TRANSITIONS OPTICAL, INC.: Un compuesto fotocrómico: (I) que comprende: (A) al menos un grupo fotocrómico seleccionado entre un pirano, una oxazina y un fúlgido; y (B) al menos un […]
Naftopiranos condensados con indeno fotocrómicos, del 18 de Febrero de 2015, de TRANSITIONS OPTICAL, INC.: Un material fotocrómico que comprende un naftopirano condensado a indeno que comprende un grupo B unido a la posición 3 del mismo y un grupo B' unido a la posición 3 del […]
 Compuestos de hidroxi sulfonato de quinona y sus usos, del 17 de Diciembre de 2014, de ARQULE, INC.: Un compuesto de fórmula I:**Fórmula**
o una sal y/o un enantiómero / diastereómero individual farmacéuticamente aceptable del mismo; en la que G es un catión.
Compuestos de hidroxi sulfonato de quinona y sus usos, del 17 de Diciembre de 2014, de ARQULE, INC.: Un compuesto de fórmula I:**Fórmula**
o una sal y/o un enantiómero / diastereómero individual farmacéuticamente aceptable del mismo; en la que G es un catión.