PROCEDIMIENTO DE INMOVILIZACION DE UNA GLUTAMATO DESHIDROGENASA.
Procedimiento de inmovilización de una glutamato deshidrogenasa.
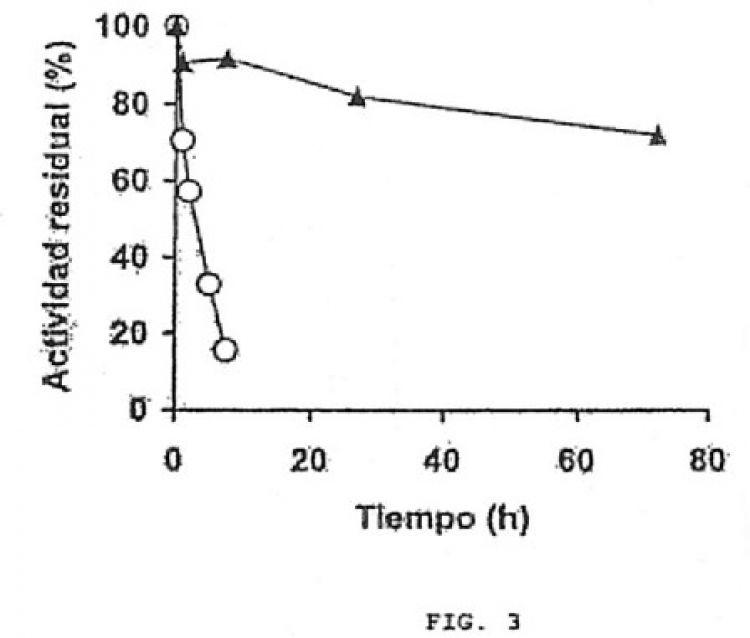
Esta solicitud describe la preparación de un derivado de una glutamato deshidrogenasa (GDH) de Thermus spp inmovilizado-estabilizado por unión covalente multipuntual. La enzima soluble ya es muy estable desde pH 6 a pH 10, incluso a 60ºC, reconoce NAD, NADH, NADP, y NADPH. Su inmovilización en soportes glioxil permite la estabilización tanto de su estructura multimérica como de la rigidez de cada monómero, aumentando aún más su termoresistencia, y ampliando el rango de utilización a pH inferiores a 5 (donde la enzima soluble se inactiva por disociación). El derivado inmovilizado es resistente a disolventes, alta temperatura, pHs drásticos, etc. Este derivado inmovilizado de la GDH, por lo tanto tendría excelentes posibilidades de utilización como enzima regeneradora de cofactores en procesos de reducción-oxidación enzimáticos o como biosensor
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200702294.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (TITULAR AL 70%)
UNIVERSIDAD AUTONOMA DE MADRID (TITULAR AL 30%).
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: GUISAN SEIJAS,JOSE MANUEL, FERNANDEZ-LAFUENTE,ROBERTO, MATEO GONZALEZ,CESAR, BERENGUER CARLOS, JOSE, CAVA VALENCIANO,FELIPE, BOLIVAR BOLIVAR,JUAN MANUEL, ROCHA MARTIN,JAVIER.
Fecha de Solicitud: 16 de Agosto de 2007.
Fecha de Publicación: .
Fecha de Concesión: 9 de Septiembre de 2010.
Clasificación Internacional de Patentes:
- C12N11/10 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 11/00 Enzimas fijadas sobre un soporte o inmovilizadas; Células microbianas fijadas sobre un soporte o inmovilizadas; Su preparación. › siendo el soporte un hidrato de carbono.
- C12N11/14 C12N 11/00 […] › Enzimas o células microbianas inmovilizadas sobre o en un soporte inorgánico.
- C12N9/06B1B
Clasificación PCT:
- C12N11/10 C12N 11/00 […] › siendo el soporte un hidrato de carbono.
- C12N11/14 C12N 11/00 […] › Enzimas o células microbianas inmovilizadas sobre o en un soporte inorgánico.
- C12N9/06 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre compuestos que contienen nitrógeno como dadores (1.4, 1.5, 1.7).
Fragmento de la descripción:
Procedimiento de inmovilización de una glutamato deshidrogenasa.
Sector de la técnica
La presente invención se encuadra en el sector de la química fina y farmacéutica, más concretamente dentro del campo de la biocatálisis para la regeneración de cofactores (pudiendo usarse para la regeneración de NADH, NADPH, NAD+ O NADP+). También se refiere al campo de los biosensores, y específicamente a biosensores en procesos fermentativos, control de aguas, etc. Así, la presente invención se refiere a la preparación de una GDH de Thermus spp inmovilizada-estabilizada, así como su uso en biotecnología, biocatálisis, fermentación, biomedicina, medio-ambiente, alimentación, control de aguas, etc.
Estado de la técnica
La enzima glutamato deshidrogenasa (GDH) y el sistema enzimático dual, glutamina sintetasa (GS) y glutamato sintasa (GOGAT), son las rutas más importantes mediante las cuales se asimila el amonio (Reitzer y Magasanik (1987), American Society for Microbiology: 302-320). GDH es una enzima extremadamente importante que une el metabolismo de los carbohidratos con el del nitrógeno (Smith et al. (1975), The enzymes 11: 293-367), y la función fisiológica de las GDHs como enzimas anabólicas y/o catabólicas se define generalmente por su especificidad por el cofactor. La comparación de las GDHs de bacterias con las de arqueas muestra que las GDHs microbianas pueden dividirse en tres tipos dependiendo del coenzima usado: NADP dependientes (EC 1.4.1.4) (Aalen et al. (1997), Arch. Microbiol. 168: 536-539; Ha et al. (2003), J. Mol. Catal. B: Enzymatic 26: 231-240; Kobayashi et al. (1995), J. Biochem. 118: 587-592; Yip et al. (1998), Eur. J. Biochem. 255: 336-346), NAD dependientes (EC 1.4.1.2) (Kujo y Ohshima (1998), Appl. Environ. Microbiol. 64: 2152-2157), y GDHs con doble especificidad para el coenzima (EC 1.4.1.3), siendo estas últimas las más frecuentes entre eucariotas.
La enzima GDH tiene dos aplicaciones biotecnológicas principales: como catalizador en biotransformaciones de reducción-oxidación (red-ox) regenerando el cofactor reducido (usando ácido glutámico) u oxidado (utilizando alfa-ceto glutárico y amoniaco) y como biosensor (Chenault et al. (1988), Biotechnology and genetic engineering reviews 6: 221-245; Ha et al. (2003), J. Mol. Catal. B: Enzymatic 26: 231-240; Van der Donk y Zhao (2003), Current Opinion in Biotechomology 14: 421:426; Zhao y Van der Donk (2003), Current Opinion in Biotechomology 14: 583-589).
En la primera aplicación, en biocatálisis, esta enzima se acoplaría a otras enzimas red-ox que catalizarían una reacción de interés utilizando cofactores nicotínicos oxidados o reducidos (NAD, NADH, NAP, NADPH), encargándose de su regeneración a partir de un sustrato como el ácido glutámico (para regenerar cofactores reducidos) o el ácido alfa-ceto glutárico y amoniaco (para regenerar cofactores oxidados). La regeneración de cofactor es conveniente ya que de otra forma la reacción transcurriría de forma estequiométrica (y los cofactores son relativamente caros) y sería complicado dirigir la reacción hacia transformaciones cuantitativas del producto deseado (Chenault et al. (1988), Biotechnology and genetic engineering reviews 6: 221-245; Van der Donk y Zhao (2003), Current Opinion in Biotechomology 14: 421:426; Zhao y Van der Donk (2003), Current Opinion in Biotechomology 14: 583-589)].
La segunda aplicación de la enzima podría ser como biosensor. La aplicación principal sería en la detección y control de la concentración de ácido glutámico, pero también se ha descrito que esta enzima puede ser utilizada para detectar metales pesados, amoniaco, urea, etc, usualmente acoplándola a otras enzimas (Bertocchi et al. (1996), Biosens. Bioelectron. 11: 1-10); Rodríguez et al. (2004), Anal. Bioanal. Chem. 380: 284-292; Rodríguez et al. (2004), Biosens. Bioelectrn. 19: 1157-1167).
En la mayoría de los casos, las GDHs son bastante específicas para el cofactor (NAD o NADP), por lo que resulta necesario utilizar una enzima para cada caso Aalen et al. (1997), Arch. Microbiol. 168: 536-539; Ha et al. (2003), J. Mol. Catal. B: Enzymatic 26: 231-240; Kobayashi et al. (1995), J. Biochem. 118: 587-592; Yip et al. (1998), Eur. J. Biochem. 255: 336-346). Además, algunas GDH funcionan de forma óptima solo en un sentido (normalmente oxidando el ácido glutámico). Por ello, sería interesante disponer de enzimas que fueran capaces de reconocer ambos cofactores.
El uso de enzimas de microorganismos termófilos puede tener ciertas ventajas en ambas aplicaciones, como por ejemplo una mayor estabilidad térmica, en ocasiones correlacionada con una mayor estabilidad frente a disolventes y otros agentes inactivantes (Cowan (1997), Comp. Biochem. Phys. A 118: 429-438; Daniel y Cowan (2000), Cell Mol. Life Sci. 57: 250-264; Jaenicke et al. (1996), Adv. Prot. Chem. 48: 181-269; Owusu y Cowan (1989), Enzyme Microb. Technol. 11: 568-574). De hecho, se han descrito varias GDHs de origen termófilo que muestran una gran termoestabilidad (Aalen et al. (1997), Arch. Microbiol. 168: 536-539; Britton et al. (1999), J. Mol. Biol. 293: 1121-1132; Díaz et al. (2006), Extremophiles 10: 105-115; Ha et al. (2003), J. Mol. Catal. B: Enzymatic 26: 231-240;Hudson et al. (1993), Biochim. Biophys. Acta 1202: 244-250; Kort et al. (1997), Extremophiles 1: 52-60; Kujo y Ohshima (1998), Appli. Environ. Microbiol. 64: 2152-2157; Robb et al. (2001), Methods Enzymol. 331: 26-41; Ruiz et al. (2003), J. Prot. Chem. 22: 295-301).
Por otro lado, el uso de enzimas inmovilizados sobre soportes sólidos porosos tiene ventajas, aunque para ambas aplicaciones propuestas en esta patente para las GDHs las enzimas se encuentran habitualmente "inmovilizadas" por atrapamiento. En el caso del uso como biocatalizadores, las enzimas red-ox suelen utilizarse atrapadas en reactores de ultrafiltración (utilizando cofactores poliméricos) [Hummel (1999), Trends Biotechnol. 17: 487-492; Leonida (2001), Curr. Med. Chem. 8: 345-369; Nakamura et al. (1988), Electro-Enzymology Coenzyme Regeneration: 87-161). Sin embargo, se ha demostrado que la inmovilización de enzimas en sólidos porosos tiene muchas ventajas (Bolivar et al. (2006), Biomacromolecules 6: 1027-1030; Bolivar et al. (2006), J. Biotechnol. 125: 85-94): se evita cualquier proceso intermolecular (interacción con burbujas de gas, agregación, etc), permite el uso de concentraciones muy altas de enzimas eliminando el riesgo de precipitación, es posible evitar la adsorción de las proteínas a la membrana del reactor, etc. Las enzimas red-ox también se "atrapan" en sistemas bifásicos acuosos (donde está la enzima y el cofactor) mientras que sustratos y productos estarían repartidos en ambas fases (Eckstein et al. (2004), Biocat. Biotrans. 22: 89-96). El uso de enzimas pre-inmovilizadas evitará interacciones deletéreas entre la enzima y la superficie hidrofóbica de las gotas de disolvente (Bolivar et al. (2006), Biomacromolecules 6: 1027-1030; Bolivar et al. (2006), J. Biotechnol. 125: 85-94).
De una forma similar, las enzimas normalmente se usan de forma inmovilizada cuando se emplean como biosensores, pero por atrapamiento en polímeros con los que se "pinta" la superficie del sensor (Basu et al. (2006), Bioelectron. 21: 1968-1972; Bertocchi et al. (1996), Biosens. Bioelectron. 11: 1-10); Doong and Shih (2006), Biosens. Bioelectron. 22: 185-191; Rodríguez et al. (2004), Anal. Bioanal. Chem. 380: 284-292; Rodríguez et al. (2004), Biosens. Bioelectrn. 19: 1157-1167). También para este tipo de aplicaciones la pre-inmovilización de las enzimas en soportes porosos tiene un cierto interés. En primer lugar, el tamaño de la partícula del sólido será muy grande, permitiendo atrapar la enzima en cualquier tipo de entramado polimérico, por ejemplo sol-geles de gran tamaño de poro (y por lo tanto donde la difusión de sustratos será más sencilla). Además, al tener la enzima dentro de un poro podemos evitar la interacción de la misma con el polímero, que quizás no sea muy compatible con la actividad y estabilidad de las enzimas (Betancor (2005), Biomacromolecules 6: 1027-1030).
Evidentemente las ventajas de usar una enzima pre-inmovilizada para ambas aplicaciones aumentan mucho si el proceso de inmovilización supone una cierta estabilización de las mismas, por ejemplo por enlace covalente multipuntual o multi-subunidad (Fernández-Lafuente et al. (2001), Biomacromolecules 2: 95-104; Gupta (1991),...
Reivindicaciones:
1. Procedimiento de inmovilización de una glutamato deshidrogenasa de Thermus thermophilus caracterizado porque la enzima se estabiliza por unión covalente multipuntual y multi-subunidades sobre soportes activados con grupos glioxil y porque comprende las siguientes etapas:
2. Procedimiento según reivindicación 1 en el que el soporte es agarosa, vidrio poroso o soportes de base silícea.
3. Procedimiento según las reivindicaciones 1 y 2 en el que la inmovilización y la incubación se realizan entre pH 9.5 y 11.
4. Procedimiento según las reivindicaciones anteriores en el que la enzima se deja reaccionar con el soporte entre 1 h y 24 h.
5. Procedimiento según las reivindicaciones anteriores en el que la temperatura de inmovilización y de incubación está entre 4ºC y 50ºC.
6. Procedimiento según las reivindicaciones anteriores en el que el agente reductor de aldehído es el borohidruro sódico.
7. Procedimiento según las reivindicaciones 1 a 6 caracterizado porque la glutamato deshidrogenasa inmovilizada-estabilizada presenta actividad tanto con NAD(H) como con NADP(H) y se utiliza en la regeneración de cofactores oxidados o reducidos.
8. Procedimiento según la reivindicación 7 en el que la enzima inmovilizada-estabilizada finalmente se utiliza para regenerar NAD.
9. Procedimiento según la reivindicación 7 en el que la enzima inmovilizada-estabilizada se utiliza para regenerar NADH.
10. Procedimiento según la reivindicación 7 en el que la enzima inmovilizada-estabilizada se utiliza para regenerar NADP.
11. Procedimiento según la reivindicación 7 en el que la enzima inmovilizada-estabilizada se utiliza para regenerar NADPH.
12. Procedimiento según las reivindicaciones 1-6 en el que la preparación enzimática se atrapa en sol-geles u otros polímeros para depositar en el sensor de biosensores (por ej. de ácido glutámico, metales pesados, amoniaco, urea, etc).
13. Un biocatalizador de Glutamato deshidrogenasa de Thermus thermophilus inmovilizada-estabilizada por el procedimiento según las reivindicaciones 1 a 12.
14. Uso de una glutamato deshidrogenasa de Thermus thermophilus, inmovilizada-estabilizada según las reivindicaciones 1 a 12, como enzima regeneradora de cofactores en procesos de reducción-oxidación enzimáticos.
15. Uso de una glutamato deshidrogenasa de Thermus thermophilus, inmovilizada-estabilizada según las reivindicaciones 1 a 12, como biosensor, por ej. de ácido glutámico, metales pesados, amoniaco, urea, etc...
Patentes similares o relacionadas:
Un método para liofilizar células encapsuladas, composiciones adecuadas para congelar células encapsuladas y los usos de dichas composiciones, del 9 de Octubre de 2019, de Austrianova Singapore Pte Ltd: Un método de liofilización de células encapsuladas, comprendiendo el método al menos dos pasos de incubación consecutivos, en el que las células encapsuladas […]
Sistema de encapsulación para la protección de probióticos durante el procesamiento, del 12 de Junio de 2019, de PEPSICO, INC.: Un producto de bebida que comprende: al menos un líquido acuoso; y cápsulas sin revestimiento que comprenden una mezcla gelificada de alginato y aislado […]
Métodos para la preparación de hidrogeles mediante el uso de enzimas lipasas, del 22 de Mayo de 2019, de SPERMVITAL AS: Uso de una lipasa y un sustrato que es hidrolizable por la lipasa y un agente que libera cationes divalentes en la preparación de un hidrogel de alginato, en donde el sustrato […]
Materiales y métodos para inmovilizar, aislar y concentrar células usando superficies carboxiladas, del 10 de Abril de 2019, de QIAGEN GAITHERSBURG, INC: Un método para determinar la presencia de un ácido nucleico diana en una muestra que comprende una célula de cuello uterino y un agente fijador que es […]
Inmovilización de psicosa-epimerasa y método para producir D-psicosa utilizando la misma, del 14 de Septiembre de 2016, de CJ CHEILJEDANG CORPORATION: Método para preparar D-psicosa a partir de D-fructosa mediante el uso de una psicosa-epimerasa derivada de Agrobacterium tumefaciens y expresada […]
Micropartículas a base de almidón para la liberación de agentes dispuestos en su interior, del 22 de Junio de 2016, de Paladin Labs Inc: Un procedimiento para producir micropartículas que estabilizan y/o controlan la liberación de un agente dispuesto en su interior, comprendiendo el […]
 Glicoproteína hialuronidasa soluble (sHASEGP), proceso para prepararla, usos y composiciones farmacéuticas que la comprenden, del 6 de Enero de 2016, de HALOZYME, INC: Una composición farmacéutica que comprende un polipéptido hialuronidasa soluble activo a pH neutro humano (sHASEGP) y un agente anticanceroso para […]
Glicoproteína hialuronidasa soluble (sHASEGP), proceso para prepararla, usos y composiciones farmacéuticas que la comprenden, del 6 de Enero de 2016, de HALOZYME, INC: Una composición farmacéutica que comprende un polipéptido hialuronidasa soluble activo a pH neutro humano (sHASEGP) y un agente anticanceroso para […]
 Cápsula sin uniones, del 23 de Septiembre de 2015, de Morishita Jintan Co., Ltd: Cápsula sin uniones que se puede almacenar de forma estable durante un largo periodo de tiempo en forma de cápsula de dos capas sin uniones, que comprende
- una capa interior […]
Cápsula sin uniones, del 23 de Septiembre de 2015, de Morishita Jintan Co., Ltd: Cápsula sin uniones que se puede almacenar de forma estable durante un largo periodo de tiempo en forma de cápsula de dos capas sin uniones, que comprende
- una capa interior […]