PROCEDIMIENTO DE ESTERIFICACION DE ALMIDON.
Un procedimiento para preparar un éster orgánico de almidón que comprende mezclar un material de almidón con un disolvente líquido iónico para disolver el almidón y después el tratamiento del almidón disuelto con un agente esterificante orgánico para formar un éster orgánico de almidón y,
posteriormente, la separación del éster orgánico de almidón de la disolución
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FI2004/000523.
Solicitante: KEMIRA OYJ.
Nacionalidad solicitante: Finlandia.
Dirección: PORKKALANKATU 3,00180 HELSINKI.
Inventor/es: AKSELA, REIJO, MYLLYMAKI,VESA.
Fecha de Publicación: .
Fecha Concesión Europea: 24 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C08B31/04 QUIMICA; METALURGIA. › C08 COMPUESTOS MACROMOLECULARES ORGANICOS; SU PREPARACION O PRODUCCION QUIMICA; COMPOSICIONES BASADAS EN COMPUESTOS MACROMOLECULARES. › C08B POLISACARIDOS; SUS DERIVADOS (polisacáridos que contienen menos de seis radicales sacáridos unidos entre sí por enlaces glucosídicos C07H; procesos de fermentación o procesos que utilizan enzimas C12P 19/00; producción de celulosa D21). › C08B 31/00 Preparación de derivados químicos del almidón (derivados químicos de amilosa C08B 33/00; derivados químicos de amilopectina C08B 35/00). › de ácidos orgánicos.
- C08J3/09B4
Clasificación PCT:
- C08B31/04 C08B 31/00 […] › de ácidos orgánicos.
- C08J3/09 C08 […] › C08J PRODUCCION; PROCESOS GENERALES PARA FORMAR MEZCLAS; TRATAMIENTO POSTERIOR NO CUBIERTO POR LAS SUBCLASES C08B, C08C, C08F, C08G o C08H (trabajo, p. ej. conformado, de plásticos B29). › C08J 3/00 Procesos para el tratamiento de sustancias macromoleculares o la formación de mezclas. › en líquidos orgánicos.
Clasificación antigua:
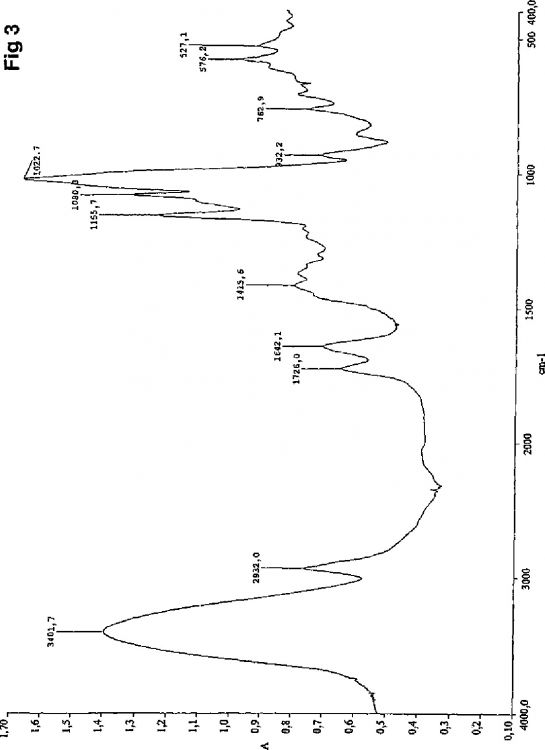
Fragmento de la descripción:
Procedimiento de esterificación de almidón.
Campo de la invención
La presente invención se refiere a un procedimiento nuevo para la preparación de ésteres orgánicos de almidón.
Antecedentes de la técnica
Almidón
A diferencia de otros carbohidratos y polímeros comestibles, el almidón se presenta como partículas discretas denominadas gránulos de almidón. En general, estos gránulos están compuestos de dos tipos de moléculas, amilosa y amilopectina. De estas, la amilosa es un (1,4)-a-D-glucano lineal, mientras que la amilopectina es una estructura ramificada de tipo arbusto que contiene tanto enlaces (1,4)-a-D entre restos de D-glucosa como puntos de ramificación (1,6)-a-D, Ullmann's Encyclopedia of Industrial Chemistry, vol A25, 1994, págs. 1-18. Las fórmulas siguientes muestran estructuras representativas de amilosa y amilopectina.
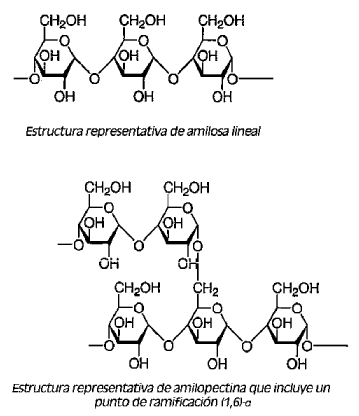
Los almidones normales contienen aproximadamente el 75% de moléculas de amilopectina y el resto consiste en amilosa. La amilopectina es una molécula de gran longitud con pesos moleculares en el intervalo de uno a varios millones. La amilosa, de estructura lineal, es considerablemente más pequeña y los pesos moleculares se encuentran normalmente en el intervalo de 5.000 a 200.000.
Los almidones comerciales se obtienen de semillas, en particular de maíz, trigo, arroz, tapioca, arrurruz, palma de sagú y patata. La cebada también se utiliza como fuente de almidón nativo, especialmente en Escandinavia. El diámetro de los gránulos de almidón de estas fuentes varía de 1 a 100 µm. El almidón de arroz tiene los gránulos más pequeños (3-9 µm), el diámetro de los gránulos de almidón de patata está en el intervalo de 15 a 100 µm y el de los gránulos de almidón de maíz entre 5 y 26 µm, con un diámetro medio de 15 µm. Además, típicamente, los gránulos de almidón de trigo tienen un diámetro de 3 a 35 µm y los de almidón de cebada, de 5 a 35 µm. Kirk-Othmer, Encyclopedia of Chemical Technology, 1997, 4.a edición, vol. 22, págs. 699-719 y Ketola H., Anderson T., Papermaking Chemistry, 1999, libro 4, págs. 269-274.
Debido a que sus pesos moleculares son extremadamente altos, así como a su composición química, que consta tanto de amilosa como especialmente de la arbustiva amilopectina, estos polisacáridos ramificados son prácticamente insolubles en otros disolventes diferentes del agua. Y en agua, los gránulos de almidón deben someterse a cocción antes de liberar sus moléculas hidrosolubles. Por lo general, no forman disoluciones verdaderas en agua debido a sus tamaños moleculares y a las interacciones intermoleculares; más bien forman dispersiones moleculares. La mayoría de los derivados de almidón pueden prepararse a partir de cualquier almidón nativo pero, por razones de solubilidad y tamaño molecular, se producen fundamentalmente a partir de almidón de patata y, en los Estados Unidos, de almidón de maíz ceroso.
Por encima de una cierta temperatura, característica de cada tipo de almidón y conocida como temperatura de gelatinización, los granos de almidón se rompen y forman un gel. La viscosidad aumenta hasta un máximo y después disminuye asintóticamente hasta un valor límite a medida que las moléculas de polímero solubilizadas se dispersan en agua. La solubilización completa de las moléculas individuales de un grano de almidón solamente tiene lugar por encima de 100ºC, Ullmann's Encyclopedia of Industrial Chemistry, vol A26, 1995, págs. 246-248.
El efecto del tratamiento térmico sobre los almidones depende fuertemente de si tiene lugar en exceso de agua, con limitación de agua, a presión o en cocción por extrusión. En exceso de agua, parece que el hinchamiento del almidón es un proceso en dos etapas que consta de un hinchamiento inicial de los gránulos seguido de la disolución de dichos gránulos. Ambas etapas son irreversibles. En condiciones de limitación de agua, las respuestas térmicas han sido interpretadas como debidas a la fusión de las cristalitas del almidón. Al aplicar la cocción por extrusión, los gránulos de almidón se disgregan físicamente, permitiendo de este modo una penetración más rápida del agua en el gránulo. En contraste con la gelatinización normal, parece ser que la reacción predominante durante la extrusión es la fragmentación del almidón (dextrinización), Kirk-Othmer, Encyclopedia of Chemical Technology, 1997, 4.a edición, vol. 22, págs. 699-719.
Ésteres orgánicos de almidón
Se han preparado y patentado un gran número de ésteres orgánicos de almidón, pero solamente unos pocos se fabrican y usan comercialmente en la actualidad. Prácticamente, estos son acetatos de almidón (es decir, almidón acetilado y, en pequeña medida, succinatos de almidón.
Los acetatos de almidón pueden tener un grado de sustitución alto o bajo. El grado de sustitución (GS) de los ésteres de almidón es una medida del número medio de grupos hidroxilo en cada unidad de glucosa anhidra derivatizados por grupos sustituyentes. Dado que cada unidad de glucosa anhidra tiene tres grupos hidroxilo disponibles para sustitución, el máximo GS posible es 3. Los materiales con un GS inferior (0,3-1,0), es decir, con un contenido de acetilo de hasta el 15%, son solubles en agua a 50-100ºC. Los acetatos de almidón con grados de sustitución de aproximadamente 0,5 tienen aproximadamente la misma solubilidad que el almidón normal. Aquellos con un GS alto (2-3), por lo tanto, con un contenido de acetilo superior al 40%, son solubles en disolventes orgánicos de menor polaridad (hidrocarburos aromáticos, cetonas, nitroalcanos, etc.) e insolubles en agua, éter dietílico, alcoholes alifáticos e hidrocarburos alifáticos. Los acetatos de almidón con un grado de sustitución tan alto tienen densidades, rotaciones específicas y temperaturas de fusión aumentadas. Sin embargo, la mayoría de los productos comerciales actuales están en realidad muy poco sustituidos (GS 0,01-0,2).
La importancia industrial de los acetatos de bajo GS resulta de su capacidad para estabilizar disoluciones poliméricas acuosas. Los acetatos de bajo GS inhiben la asociación de polímeros de amilosa y reducen la asociación de las cadenas exteriores de mayor longitud de amilopectina. Además tienen menores intervalos de temperaturas de gelatinización, una mayor viscosidad de pasta cocida caliente, una más fácil dispersión en la cocción, así como menor tendencia a la retrogradación después de transformarse en pasta y enfriarse.
La retrogradación puede explicarse como una insolubilización irreversible de la pasta de almidón con la formación de un precipitado o gel, dependiendo de la concentración, y se conoce comúnmente como "set back". Esto es importante en aplicaciones alimentarias, pero la extremadamente buena estabilidad de la viscosidad obtenida por la acetilación también es muy bien recibida en aplicaciones de la industria papelera. Como apresto superficial, mejora la capacidad de impresión y proporciona una fuerza superficial uniforme, porosidad, resistencia a disolventes y resistencia a la abrasión. Además, los acetatos de almidón de bajo GS se emplean como apresto de urdimbre en materiales textiles para proporcionar una buena adhesión, resistencia a la tracción, así como flexibilidad de los hilos.
Los acetatos de alto GS se emplean en el moldeo de termoplásticos y también como plastificantes en películas. Las películas de un acetato de alto GS semejante, moldeadas a partir de una disolución de cloroformo, son flexibles, lustrosas, transparentes e incoloras. Estas propiedades son útiles, por ejemplo, para materiales de embalaje. El triacetato de amilosa puede hilarse también para obtener fibras fuertes, Kirk-Othmer, Encyclopedia of Chemical Technology, 1997, 4.a edición, vol. 22, págs. 699-719 y Ullmann's Encyclopedia of Industrial Chemistry, vol A25, 1994, págs. 1-18.
Acetilación del almidón
En la bibliografía se encuentran varios procedimientos para preparar acetatos de almidón, Kirk-Othmer, Encyclopedia of Chemical Technology, 1997, 4.a edición, vol. 22, págs. 699-719 y Ullmann's Encyclopedia of Industrial Chemistry, vol A25, 1994, págs. 1-18. Típicamente, la mayoría de los procesos emplean anhídrido acético, con o sin catalizadores. Comercialmente, el almidón acetilado de bajo GS (0,5) se prepara en un sistema que emplea anhídrido acético y álcali acuoso a pH 7-11 y temperatura ambiente. Sin embargo, este procedimiento solamente puede emplearse...
Reivindicaciones:
1. Un procedimiento para preparar un éster orgánico de almidón que comprende mezclar un material de almidón con un disolvente líquido iónico para disolver el almidón y después el tratamiento del almidón disuelto con un agente esterificante orgánico para formar un éster orgánico de almidón y, posteriormente, la separación del éster orgánico de almidón de la disolución.
2. El procedimiento según la reivindicación 1 en el que se aplica irradiación con microondas para facilitar la disolución y esterificación.
3. El procedimiento según las reivindicaciones 1 ó 2, en el que se aplica presión para facilitar la disolución y esterificación.
4. El procedimiento según la reivindicación 1, en el que el disolvente líquido iónico se funde a una temperatura inferior a 200ºC.
5. El procedimiento según la reivindicación 1, en el que el catión del disolvente líquido iónico se selecciona del grupo que consta de
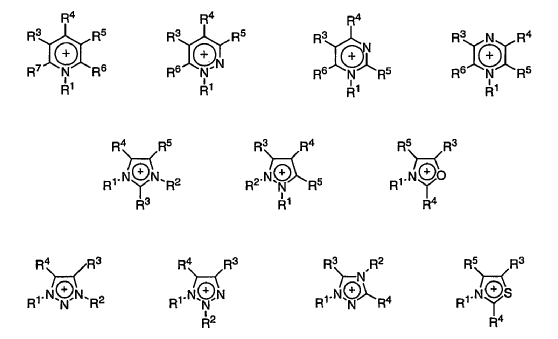
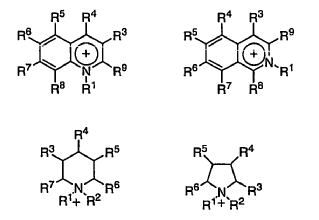
en que R1 y R2 son, independientemente, un grupo alquilo C1-C6 o alcoxialquilo C2-C6, y R3, R4, R5, R6, R7, R8 y R9 son, independientemente, hidrógeno, un grupo alquilo C1-C6, alcoxialquilo C2-C6 o alcoxi C1-C6 y en que el anión del disolvente líquido iónico es halógeno, pseudohalógeno o carboxilato C1-C6.
6. El procedimiento según la reivindicación 5 en el que dicho catión comprende
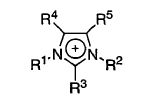
en que cada uno de R3-R5 son hidrógeno y R1 y R2 son iguales o distintos y representan alquilo C1-C6, y dicho anión es halógeno, preferentemente cloruro.
7. El procedimiento según la reivindicación 1, en el que el material de almidón es almidón nativo o almidón hidrolizado.
8. El procedimiento según la reivindicación 1, en el que el éster orgánico de almidón se separa de la disolución mediante la adición de una sustancia no disolvente del éster orgánico de almidón con el fin de precipitar el éster orgánico de almidón.
9. El procedimiento según la reivindicación 8, en el que dicha sustancia no disolvente es un alcohol, una cetona, acetonitrilo, un poliglicol, un éter o agua.
10. El procedimiento según la reivindicación 1, en el que el éster orgánico de almidón se separa por extracción con una sustancia no disolvente del disolvente líquido iónico.
11. El procedimiento según la reivindicación 1, en el que el agente esterificante orgánico es un ácido carboxílico C1-C11, preferentemente un ácido carboxílico C1-C6, o un derivado reactivo de este.
12. El procedimiento según la reivindicación 11, en el que el ácido carboxílico C1-C6 o un derivado reactivo de este es ácido fórmico, ácido acético, ácido propanoico, ácido butanoico, anhídrido acético, anhídrido propanoico o anhídrido butanoico.
Patentes similares o relacionadas:
Tinta de impresión y composiciones de revestimiento que contienen derivados de almidón y almidón modificado, del 13 de Noviembre de 2019, de SUN CHEMICAL CORPORATION: Una tinta de impresión o composición de revestimiento, que comprende uno o más almidones hidrolizados, en la que al menos uno de los almidones tiene […]
Emulsionante, del 29 de Marzo de 2017, de COOPERATIE AVEBE U.A: Utilización de un almidón hidrófobo como emulsionante, obteniéndose dicho almidón hidrófobo mediante un procedimiento que comprende las etapas de a) eterificación, […]
Microesferas de almidón hidrolizado con ligandos endógenos cargados, del 4 de Mayo de 2016, de Magle AB: Una microesfera biodegradable que tiene un diámetro de 10 a 2000 μm que comprende almidón hidrolizado reticulado sobre el cual se ha conjugado, mediante […]
Almidón de tapioca bajo en amilosa y reticulado con adipato, del 15 de Octubre de 2014, de CORN PRODUCTS DEVELOPMENT INC: Uso de un adipato de dialmidón de tapioca acetilado bajo en amilosa en el que el almidón tiene un contenido de amilosa de menos del 10 % en peso en productos de papel, […]
Microprocesamiento en mezclas de reacción heterogéneas, del 12 de Febrero de 2014, de CARGILL INCORPORATED: Un procedimiento para preparar un polisacárido químicamente modificado y dicho procedimiento comprende lassiguientes etapas: a) Tomar una suspensión que comprende […]
Nuevos polímeros cuaternarios, del 23 de Septiembre de 2013, de ARCHIMEDES DEVELOPMENT LIMITED: Polímeros cuaternarios que tienen la fórmula general:**Fórmula**en la que **Fórmula** T es NH u O, X1, X2 y X3 son independientemente:**Fórmula** en el caso en que T […]
Composición acuosa que contiene al menos un almidón aniónico gelatinizado soluble, del 23 de Mayo de 2012, de ROQUETTE FRERES: Composición acuosa que contiene: - al menos un almidón aniónico gelatinizado soluble, que presenta una densidad de cargas comprendida entre -150 μeq/g en seco y […]
PROCEDIMIENTO DE PREPARACIÓN DE ÉSTERES DE CARNITINA Y USO DE LOS MISMOS, del 9 de Enero de 2012, de Chemigate Oy: Un procedimiento para la preparación de un éster de hidroxi polímero de carnitina, caracterizado porque un hidroxi polímero se hace reaccionar con una ß-lactona de carnitina.