PROCEDIMIENTO PARA EL ANALISIS DE PEPTIDOS DE ORIGEN NATURAL Y PROTEINAS PEQUEÑAS MEDIANTE ESPECTROMETRIA DE MASAS.
Un procedimiento para el análisis de uno o más o todos los péptidos de origen natural de peso molecular ≤
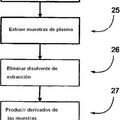
10 kDa y/o proteínas pequeñas de peso molecular ≤10 kDa presentes en una muestra de plasma o suero, que comprende: a) un volumen del fluido biológico se mezcla con 7 a 9 volúmenes de una disolución acuosa que contiene acetonitrilo al 50% y TFA al 0,1%, b) se centrifuga, c) el sobrenadante se separa y se concentra, d) se desala y se limpia, e) se analiza mediante espectrometría de masas
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06386024.
Solicitante: FOUNDATION FOR BIOMEDICAL RESEARCH OF THE ACADEMY OF ATHENS
TSANGARIS, GEORGE
VOUGAS, CONSTANTINOS.
Nacionalidad solicitante: Grecia.
Dirección: SORANOU EFESIOU 4 115 27 ATHENS GRECIA.
Inventor/es: FOUNTOULAKIS,MICHAEL, TSANGARIS,GEORGE, VOUGAS,CONSTANTINOS.
Fecha de Publicación: .
Fecha Solicitud PCT: 13 de Julio de 2006.
Fecha Concesión Europea: 23 de Junio de 2010.
Clasificación Internacional de Patentes:
- G01N33/68A12
Clasificación PCT:
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.

Fragmento de la descripción:
CAMPO TÉCNICO AL QUE SE DIRIGE LA INVENCIÓN
Esta invención se refiere a un procedimiento para la separación e identificación por medio de espectrometría de masas de péptidos y proteínas pequeñas de 1.000-10.000 Da (110 kDa) de tamaño, a los que se hace referencia como péptidos de origen natural y proteínas pequeñas (NOP/SP), presentes en fluidos biológicos como plasma, suero, líquido amniótico, líquido cefalorraquídeo, orina, saliva, etc.
Mediante la aplicación de este procedimiento, los NOP/SP se separan de las proteínas de peso molecular superior a 10 kDa presentes en los fluidos biológicos sin necesidad de procedimientos complicados que requieren mucho tiempo, como el fraccionamiento y enriquecimiento, y se analizan por espectrometría de masas. Este procedimiento ofrece la posibilidad de analizar los NOP/SP mediante la espectrometría de masas MALDI-TOF, que es rápida y potencialmente automatizable. Además, el análisis mencionado anteriormente puede mejorarse adicionalmente por medio de la cuantificación de los NOP/SP. Todos estos hechos hacen que este procedimiento sea adecuado para el análisis de gran número de muestras en un corto espacio de tiempo y para su aplicación en el ámbito del diagnóstico, a través del análisis cualitativo o cuantitativo de uno o más NOP/SP, bien en el contexto de los marcadores biológicos específicos indicadores de enfermedades o bien en el contexto de la comparación de perfiles de proteínas entre muestras normales y muestras procedentes de estados de enfermedad.
C. UTILIDAD DE LA TÉCNICA MENCIONADA ANTERIORMENTE
C.1. Introducción
C.1.1. Proteómica
El término "proteómica" fue acuñado inicialmente en 1996 por Marc Wilkins y tiene su origen en la abreviatura de las palabras proteína y genoma. Este término describe el total del contenido de proteínas de un sistema biológico en
un momento o estado dados. Desde de ese momento, las metodologías y técnicas que permiten el análisis de las proteínas, como la bioinformática y la espectrometría de masas, han evolucionado rápidamente. Algunas de estas, como la electroforesis bidimensional en gel de poliacrilamida (2DPAGE), han adquirido una popularidad especial. La proteómica se ha utilizado ampliamente en el ámbito académico, así como en el sector de la industria farmacéutica, dado que se cree firmemente que va a ser un factor de investigación puntero en la era posgenómica.
El campo principal de la proteómica es el análisis completo del contenido de proteínas de una muestra. La estrategia general establecida en el análisis proteómico incluye cuatro etapas: aislamiento de las proteínas de la muestra, separación de las proteínas, detección de las proteínas y, finalmente, identificación de las proteínas. Además de las técnicas analíticas anteriormente mencionadas, el procedimiento de identificación de proteínas incluye software específico para el análisis de las imágenes de los geles de poliacrilamida, lo que incluye la comparación de geles, la cuantificación de proteínas en el gel y el almacenamiento y gestión de los datos.
C.1.2. Metodología de la proteómica
C.1.2.A. Separación de proteínas
La metodología aplicada para el aislamiento de las proteínas de una muestra depende de dicha muestra. También depende del procedimiento que se va a usar para la separación e identificación de las proteínas. En caso de que la separación de las proteínas vaya a tener lugar mediante la estrategia general y bien establecida de isoelectroenfoque, el aislamiento de las proteínas finaliza con la solubilización de las proteínas en una disolución de desnaturalización específica que fundamentalmente contiene urea en una concentración de hasta 8 M y que adicionalmente podría contener tiourea, CHAPS, 1,4-DTT, Tris, EDTA e inhibidores de proteasas. En el caso de fluidos biológicos, las proteínas ya se encuentran en disolución. La muestra se
centrifuga con el fin de eliminar todo el material celular insoluble y otros elementos insolubles. A continuación, una muestra que contiene 1 mg de proteína total se diluye en un volumen apropiado de la disolución de desnaturalización mencionada anteriormente antes de proceder con el tratamiento. Debido al hecho de que la concentración de proteína depende del tipo de fluido biológico, en el caso de fluidos muy diluidos, como el líquido amniótico o la orina, las muestras se concentran después de la centrifugación y antes de su dilución con la disolución de desnaturalización. La concentración de la muestra puede conseguirse mediante precipitación de proteínas, ultrafiltración, etc.
En el caso de material biológico en estado sólido (tejidos, células, muestras de biopsias, etc.), es necesario extraer las proteínas por disolución antes de cualquier otro paso. Esto se consigue mediante homogeneización (presión mecánica, ultrasonidos, etc.) en un volumen pequeño de la disolución de desnaturalización mencionada anteriormente o de otros tipos de disoluciones. Después de esto se llevan a cabo las etapas ya mencionadas de centrifugación y dilución en la disolución de desnaturalización para preparar la muestra para su análisis posterior.
Finalmente, para el aislamiento de grupos de proteínas específicos de una muestra biológica pueden aplicarse técnicas de fraccionamiento específicas como la cromatografía
o la inmunoprecipitación antes de proceder con el tratamiento.
C.1.2.B. Separación de proteínas mediante electroforesis bidimensional en gel de acrilamida (2D-PAGE)
El procedimiento general clásico para la separación y detección de proteínas que se usa actualmente en proteómica es la electroforesis en gel 2D-SDS-PAGE. El procedimiento se basa en el aislamiento paralelo de las proteínas en función de su carga eléctrica y peso molecular. El procedimiento tiene como resultado la separación y visualización de cientos de proteínas a la vez, lo que es algo que ningún otro procedimiento puede conseguir en este momento. Inicialmente,
la técnica incluye el isoelectroenfoque (IEF) de las proteínas, lo que significa la separación de las proteínas en función de su carga eléctrica y, finalmente, su separación en función de su peso molecular.
Literalmente, el IEF es un procedimiento de equilibrado, durante el que se fuerza el movimiento de las proteínas a lo largo de una tira portadora de derivados de acrilamida (inmovilinas) de pH diferencial (tira de gradiente de pH inmovilizado, IPG) bajo el efecto de un campo eléctrico intenso. Las proteínas se mueven y se concentran en los puntos de la banda en los que se neutraliza su carga (punto isoeléctrico). Hay tiras IPG que cubren un amplio intervalo de unidades de pH, como pH 3-10 (7-24 cm de longitud), así como tiras adecuadas para el análisis de intervalos de pH muy estrechos como pH 3,5-4,5. Una de las ventajas de las tiras IPG es que la cantidad de muestra de proteína que puede analizarse es relativamente elevada. Las condiciones exactas del IEF dependen de una serie de factores, tales como la cantidad de la muestra por analizar, la aplicación de la muestra sobre la tira IPG, el potencial eléctrico y la duración del isoelectroenfoque.
La separación de proteínas en función de su peso molecular como una segunda dimensión se consigue mediante el uso de un gel de poliacrilamida. Este gel puede ser de una concentración constante de acrilamida o formar un gradiente, dependiendo del peso molecular esperado para las proteínas en estudio. Los geles de uso más corriente tienen una concentración constante de acrilamida del 12% y un gradiente de concentración de acrilamida del 9-16% para la separación de proteínas de un peso molecular en el intervalo de 10-200 kDa.
C.1.2.C. Detección de proteínas
Después de la separación de las proteínas en el gel de acrilamida, estas se detectan por tinción en el gel mediante colorantes sensibles, cuya elección depende del procedimiento de identificación posterior. Los colorantes de uso más corriente son azul de Coomassie y plata. Estos colorantes se
eligen cuando va a usarse la espectrometría de masas para la identificación de las proteínas.
Dada la heterogeneidad proteínica en los geles 2D, las proteínas están representadas normalmente por más de una mancha, lo que resulta en un número de productos génicos traducidos muy superior al número de genes que los codifican en realidad. Se ha observado en eucariotas que es posible que un solo gen codifique de...
Reivindicaciones:
1. Un procedimiento para el análisis de uno o más o todos los péptidos de origen natural de peso molecular ≤10 kDa y/o proteínas pequeñas de peso molecular ≤10 kDa presentes en una muestra de plasma o suero, que comprende: a) un volumen del fluido biológico se mezcla con 7 a 9 volúmenes de una disolución acuosa que contiene acetonitrilo al 50% y TFA al 0,1%, b) se centrifuga, c) el sobrenadante se separa y se concentra, d) se desala y se limpia, e) se analiza mediante espectrometría de masas.
2. Un procedimiento para el análisis de uno o más o todos los péptidos de origen natural de peso molecular ≤10 kDa y/o proteínas pequeñas de peso molecular ≤10 kDa presentes en una muestra de orina, líquido amniótico, líquido cefalorraquídeo, saliva o lágrimas, que comprende: a) un volumen del fluido biológico se mezcla con 7 a 9 volúmenes de una disolución acuosa que contiene acetonitrilo al 50% y TFA al 0,1%, b) se concentra, c) se centrifuga y se separa el sobrenadante, d) se desala y se limpia, e) se analiza mediante espectrometría de masas.
3. Un procedimiento en el que, según las reivindicaciones 1 y 2, la disolución obtenida después de finalizar la etapa
(c) se desala y se limpia por medio de un material de retención adecuado.
4. Un procedimiento en el que, según la reivindicación 3, el material de retención se empaqueta en una punta de pipeta
o una columna de cromatografía.
5. Un procedimiento en el que, según las reivindicaciones 1 a 4, la disolución obtenida al finalizar la etapa (c) se separa en fracciones.
6. Un procedimiento en el que, según la reivindicación 5, el fraccionamiento se lleva a cabo mediante cromatografía, en
particular mediante HPLC y/o LC.
7. Un procedimiento en el que, según las reivindicaciones 1 y 2, el análisis incluye la separación y/o la identificación y/o la especificación cualitativa y/o la especificación cuantitativa de uno o más o todos los péptidos de origen natural de peso molecular ≤10 kDa y/o proteínas pequeñas de peso molecular ≤10 kDa.
8. Un procedimiento en el que, según la reivindicación 7, la especificación cuantitativa de uno o más o todos los péptidos de origen natural de peso molecular ≤10 kDa y/o proteínas pequeñas de peso molecular ≤10 kDa se lleva a cabo mediante el uso de uno o más controles internos.
9. Un procedimiento en el que, según las reivindicaciones 7 y 8, el análisis de uno o más o todos los péptidos de origen natural de peso molecular ≤10 kDa y/o proteínas pequeñas de peso molecular ≤10 kDa se lleva a cabo mediante el uso de algoritmos especializados.
10. Un procedimiento en el que, según las reivindicaciones 1 y 2, la tecnología de espectrometría de masas es MALDI-TOF, SELDI-TOF, ESI-TOF, ESI-IT, ESI-FT, ESI-QqTOF y ESI-QqQ.
11. Un procedimiento en el que, según las reivindicaciones 1 y 2, el procedimiento completo o parte de este se realiza mediante sistemas robóticos.
12. Un procedimiento según las reivindicaciones 1 a 11 para la detección y análisis de marcadores biológicos indicativos de estados patológicos.
13. Un procedimiento según las reivindicaciones 1 a 12 para el diagnóstico de estados patológicos a través de la comparación, evaluación y/o análisis de patrones y/o perfiles de proteínas.
14. El uso del procedimiento según las reivindicaciones 1 a 13 para la detección y análisis de marcadores biológicos.
15. El uso del procedimiento según las reivindicaciones 1 a 5 14 para el diagnóstico de estados patológicos.
16. El uso de la disolución acuosa que contiene acetonitrilo al 50% y TFA al 0,1% en el procesamiento de fluidos biológicos, mediante la mezcla de 7 a 9 volúmenes de esa disolución con un volumen del fluido biológico, con el fin de la separación y/o la identificación y/o la especificación cualitativa y/o la especificación cuantitativa de uno o más o todos los péptidos de origen natural de peso molecular ≤10 kDa y/o proteínas pequeñas de peso molecular ≤10 kDa.
17. El uso de la disolución acuosa que contiene acetonitrilo al 50% y TFA al 0,1% según la reivindicación 16, en el que el fluido biológico es plasma, suero, líquido amniótico, líquido cefalorraquídeo, orina, saliva, lágrimas.
Patentes similares o relacionadas:
SELECCIÓN DE PACIENTES CON CÁNCER DE CABEZA Y CUELLO PARA TRATAMIENTO CON FÁRMACOS DIRIGIDOS A LA VÍA EGFR, del 22 de Noviembre de 2011, de Biodesix Inc: Un procedimiento para determinar si un paciente con carcinoma de células escamosas de cabeza y cuello (CCECC) tiene probabilidades de beneficiarse del tratamiento con […]
PROCEDIMIENTO DE CRIBADO, del 21 de Septiembre de 2011, de KING'S COLLEGE LONDON GUY'S & ST THOMAS' NHS FOUNDATION TRUST: Un procedimiento para detectar una variante de proteína conocida en una muestra que comprende: (i) digerir la proteína para producir una serie […]
MEDIOS Y MÉTODO PARA PREDECIR DIABETES TIPO II, del 16 de Mayo de 2011, de METANOMICS GMBH: Un método para diagnosticar diabetes tipo 2 o predisposición por lo tanto comprende: (a) determinar 1,5-Anhidrosorbitol, ácido Eicosenoico (C20:1) y Pentadecanol en […]
 VECTORES DE EXPRESIÓN QUE CODIFICAN EPÍTOPOS DE ANTÍGENOS Y MÉTODOS PARA SU DISEÑO, del 12 de Mayo de 2011, de MANNKIND CORPORATION: Polipéptido que comprende la SEQ ID n.º 4 o la SEQ ID n.º 5
VECTORES DE EXPRESIÓN QUE CODIFICAN EPÍTOPOS DE ANTÍGENOS Y MÉTODOS PARA SU DISEÑO, del 12 de Mayo de 2011, de MANNKIND CORPORATION: Polipéptido que comprende la SEQ ID n.º 4 o la SEQ ID n.º 5
MEDIOS Y MÉTODO PARA PREDECIR DIABETES TIPO II, del 10 de Mayo de 2011, de METANOMICS GMBH: Un método para diagnosticar una predisposición a la diabetes tipo 2 que comprende: (a) determinar metabolitos en una muestra de plasma, suero o […]
MÉTODO PARA LA DETERMINACIÓN DE FACTORES DE RIESGO CARDIOVASCULARES EN SANGRE DESECADA, del 7 de Abril de 2011, de GERMEDIQ FORSCHUNGS- UND ENTWICKLUNGSGESELLSCHAFT MBH: Método para la determinación de factores de riesgo cardiovascular en muestras biológicas que comprende las etapas de a) alterar la muestra a una muestra de sangre […]
 CUANTIFICACION DE NIVELES DE CARTININA EN PACIENTES DE DIALISIS, del 16 de Abril de 2010, de SIGMA-TAU PHARMACEUTICALS, INC: Un procedimiento para cuantificar los niveles de concentración de carnitina libre, acilcarnitinas totales y carnitina total en muestras […]
CUANTIFICACION DE NIVELES DE CARTININA EN PACIENTES DE DIALISIS, del 16 de Abril de 2010, de SIGMA-TAU PHARMACEUTICALS, INC: Un procedimiento para cuantificar los niveles de concentración de carnitina libre, acilcarnitinas totales y carnitina total en muestras […]
Inmunomoduladores, del 29 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula (I) **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de **(Ver fórmula)** en donde: […]