NUEVAS CROMENOQUINONAS MODULADORAS DE RECEPTORES CANNABINOIDES CB2 CON ACTIVIDAD ANTITUMORAL.
Nuevas cromenoquinonas moduladoras de receptores cannabinoides CB2 con actividad antitumoral.
La presente invención proporciona nuevos cannabinoides derivados de cromenopirazol-orto-quinona representados por la fórmula (I), composiciones farmacéuticas que contienen estos compuestos y su uso como moduladores del receptor cannabinoide CB2, por lo que son especialmente útiles para el tratamiento del cáncer y de los tumores malignos.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201430372.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC).
Nacionalidad solicitante: España.
Inventor/es: JAGEROVIC,NADINE, MORALES LÁZARO,Paula, GOYA LAZA,María del Pilar, GÓMEZ CAÑAS,María, BLASCO BENITO,Sandra, SÁNCHEZ GARCÍA,María Cristina, FERNÁNDEZ RUÍZ,José Javier.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/4162 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensados con sistemas heterocíclicos.
- C07D491/052 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 491/00 Compuestos heterocíclicos que contienen en el sistema cíclico condensado, a la vez uno o más ciclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo, y uno o más ciclos que tienen átomos de nitrógeno como únicos heteroátomos del ciclo, no previstos en los grupos C07D 451/00 - C07D 459/00, C07D 463/00, C07D 477/00 ó C07D 489/00. › teniendo el ciclo que contiene el oxígeno seis miembros.
Fragmento de la descripción:
Nuevas cromenoquinonas moduladoras de receptores cannabinoides CB2 con actividad antitumoral.
Sector de la Técnica
La presente invención se engloba en el campo de la farmacología. Específicamente, la presente invención se refiere a compuestos derivados de cromeno[4,3-c]pirazol-8,9-dionas, que modulan selectivamente el receptor cannabinoide CB2 y que son útiles para el tratamiento del cáncer y de los tumores malignos.
Estado de la Técnica Anterior
El cáncer es una de las principales causas de muerte, a pesar de la existencia de tratamientos que incluyen la quimioterapia, la cirugía y la radioterapia. Por lo tanto, se están realizando investigaciones sobre las causas, el diagnóstico y el tratamiento del cáncer. Una gran parte de estos estudios tienen como objetivo la obtención de nuevos agentes antitumorales activos y seguros para administrarlos a pacientes que padecen cáncer.
Los endocannabinoides, junto con sus receptores y su sistema de síntesis y degradación constituyen el sistema endocannabinoide. Durante los diez últimos años, se han conseguido avances importantes sobre el papel que juega este sistema en los procesos fisiológicos y patológicos. Los cannabinoides, ya sean endógenos, naturales o sintéticos, actúan sobre los receptores cannabinoides y pueden proporcionar beneficios terapéuticos en diversas patologías. Hoy en día en algunos países se utilizan clínicamente tres medicamentos basados en el tetrahidrocannabinol o derivados (Marinol®, Sativex® y Cesamet®) para aliviar los síntomas relacionados con el tratamiento del cáncer, de la esclerosis múltiple o de la infección por SIDA. Además, en estos últimos años un número creciente de estudios realizados in vitro e in vivo en animales de laboratorio han puesto de manifiesto las propiedades antitumorales de los cannabinoides. Éstos pueden inhibir la proliferación de células cancerosas, su diseminación metastática y provocar la muerte por apoptosis de células tumorales de diversos orígenes (carcinomas, sarcomas, linfomas, leucemias, mielomas, melanomas) (Velasco G. et al, Nat. Rev. Cáncer2012, 12, 436-444).
La supervivencia por cáncer de mama sensibles a hormonas (ER+/PR+), Her2 positivos y triple negativos ha mejorado notablemente durante estos veinte últimos años. Sin embargo, sigue siendo el tumor maligno más frecuente entre las mujeres. Por otra parte, existe una creciente evidencia que los cannabinoides pueden actuar como antitumorales en diversos subtipos de cáncer de mama (Caffarel M. M. et al, Cáncer Treat. Rev. 2012, 38, 911-918). Estos estudios se basan en resultados obtenidos en células tumorales de mama humanas y en distintos modelos animales de cáncer. Teniendo en cuenta que el receptor cannabinoide CB2 está implicado en el efecto antitumoral de los cannabinoides y que la activación del receptor cannabinoide CB1 a nivel del sistema nervioso central es la responsable de los efectos psicotrópicos asociados al consumo de estas sustancias, se hace necesaria la búsqueda de ligandos selectivos del receptor cannabinoide CB2 con actividad antitumoral que no desencadenen este tipo de efectos secundarios adversos.
Quinonas derivadas de estructuras cannabinoides con propiedades antitumorales ya han sido descritas pero todas llevan estructuras de para-quinona, es decir, los dos grupos carbonilo se encuentran en las posiciones 1 y 4 del anillo quinolínico. En W02005067917 se describen para-quinonas derivadas del cannabidiol, del A8-tetrahidrocannabinol y del cannabinol. Sin embargo, estas para-quinonas de naturaleza tricíclica, a pesar de mostrar propiedades antiproliferativas en líneas celulares de cáncer humano, no se unen a los receptores
cannabinoides según precisan sus autores, excluyendo un mecanismo antitumoral de tipo cannabinoide.
Otras para-quinonas derivadas del cannabidiol y su uso en el tratamiento de cánceres han sido reivindicadas en W02008107878 donde se describe la actividad anti-proliferativa pero en ningún caso se ha encontrado que presenten actividad cannabinoide y/o de unión a los receptores cannabinoides. Es decir, la introducción de una para-quinona en estas estructuras de tipo cannabinoide da lugar a la pérdida de las propiedades cannabinoides.
Para-quinonas con estructura cannabinoide que modulan los receptores PPARg han sido descritas recientemente en EP2551255 para el tratamiento de enfermedades inflamatorias, metabólicas y diabetes tipo II.
Más recientemente, en W02014013117 los autores de la presente invención describen antitumorales con estructura de tipo cromenopirazol-para-diona con afinidad moderada por los receptores cannabinoides CB1 y CB2. Sin embargo, el efecto antiproliferativo de dichos compuestos, estudiado in vitro en líneas celulares derivadas de carcinoma hepatocelular y de cáncer de próstata, está parcialmente mediado por los receptores cannabinoides CB1 y no por los receptores CB2 (Morales P. etal, Eu. J. Med. Chem. 2013, 70, 111-119).
En WO2010109050, el grupo de investigación de los autores de la presente invención describe cromenopirazóles de estructura no quinónica como cannabinoides con actividad analgésica, sin que se les hayan atribuido propiedades antitumorales.
La presente invención se enfrenta al problema de proporcionar nuevos compuestos útiles para el tratamiento del cáncer y de los tumores malignos que minimicen los efectos secundarios adversos característicos de los fármacos anticancerosos empleados en la actualidad como, por ejemplo, la aparición de neuropatías. Dicho problema se pretende resolver mediante una nueva familia de compuestos caracterizados por su estructura de tipo cromenopirazol-orto-quinona que actúan por apoptosis de las células tumorales a través de diversos mecanismos de señalización celular relacionados con el receptor cannabinoide CB2 y por estrés oxidativo. Estos compuestos modulan selectivamente dicho receptor, evitando por una parte los efectos adversos de naturaleza psicotrópica que aparecen cuando se modula el receptor cannabinoide CB1 en el cerebro y por otra, minimizando la aparición de neuropatías gracias a las propiedades antiinflamatorias características de los cannabinoides.
Breve descripción
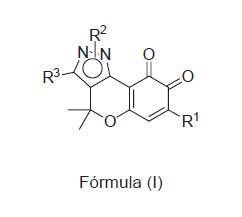
La presente invención se refiere a un compuesto de fórmula general (I)
R1 se selecciona entre hidrógeno, alquilo CrC18, cicloalquilo C3-C7, heterocicloalquilo C3-C7, alquenilo C2-Ci8, arilo C5-Ci8 y heteroarilo C5-Ci8, opcionalmente sustituidos, halógeno, -CN, -N02, -N(R4)2, -OR4, -COR4, -COOR4, -CON(R4)2 y -S02R4;
**(Ver fórmula)**Fórmula (I)
donde,
R2 se selecciona entre hidrógeno, alquilo CrCi8, cicloalquilo C3-C7, heterocicloalquilo C3-C7, alquenilo C2-C18, arilo C5-C18 y heteroarilo C5-C18, opcionalmente sustituidos;
- R3 se selecciona entre hidrógeno, alquilo CrCi8, cicloalquilo C3-C7, heterocicloalquilo C3-C7, alquenilo C2-Ci8, arilo C5-C18 y heteroarilo C5-C18, opcionalmente sustituidos, - CN, -N02, -OR4, -N(R4)2, -COR4, -COOR4, -CON(R4)2 y -S02R4;
- R4 se independientemente entre hidrógeno, alquilo C1-C5, cicloalquilo C3-C7, heterocicloalquilo C3-C7, alquenilo C2-C5, arilo C5-C18 y heteroarilo C5-C18, opcionalmente sustituidos;
o un tautómero, profármaco, sal o solvato farmacéuticamente aceptable del mismo.
Además, la presente invención también hace referencia al uso del compuesto de fórmula (I) o de una composición farmacéutica del mismo, para la preparación de un medicamento para el tratamiento de un cáncer o un tumor maligno.
Es asimismo, objeto de la presente invención el procedimiento de obtención del compuesto de fórmula general (I) mediante una reacción de oxidación del correspondiente derivado fenólico precursor del compuesto de fórmula (I) con ácido o-yodoxibenzoico.
Descripción de la invención
Sorprendentemente, los autores de la presente invención han encontrado que los compuestos de fórmula (I) actúan como antitumorales.
Además, los compuestos de fórmula (I) descritos en la presente invención presentan una ventaja técnica respecto a otros antitumorales conocidos que viene dada por su selectividad frente al receptor cannabinoide CB2. Dicha selectividad evita la aparición de efectos secundarios de naturaleza psicotrópica asociados a la modulación en el cerebro del receptor cannabinoide CB1.
Otra ventaja técnica de estos compuestos puede resultar del propio mecanismo de acción. La modulación del receptor CB2 por parte de los compuestos de fórmula general (I) debe proporcionar las propiedades antiinflamatorias propias de los cannabinoides. Por tanto, los compuestos de la presente invención podrían disminuir e incluso eliminar los efectos neuropáticos que actualmente presentan los fármacos antitumorales usados...
Reivindicaciones:
1. Un compuesto de fórmula general (I)
**(Ver fórmula)**.o
R'
Fórmula (I)
donde,
R1 se selecciona entre hidrógeno, alquilo CrCi8, cicloalquilo C3-C7, heterocicloalquilo C3-C7, alquenilo C2-Ci8, -O-alquilo C1-C5, arilo C5-Ci8 y heteroarilo C5-Ci8, opcionalmente sustituidos, halógeno, -CN, -N02, -N(R4)2, -COR4, -COOR4, -CON(R4)2 y-S02R4;
R2 se selecciona entre hidrógeno, alquilo CrCi8, cicloalquilo C3-C7, heterocicloalquilo C3-C7, alquenilo C2-Ci8, arilo C5-Ci8 y heteroarilo C5-Ci8, opcionalmente sustituidos;
R3 se selecciona entre hidrógeno, alquilo CrCi8, cicloalquilo C3-C7, heterocicloalquilo C3-C7, alquenilo C2-Ci8, arilo C5-Ci8 y heteroarilo C5-Ci8, opcionalmente sustituidos, -CN, N02, - N(R4)2, -COR4, -COOR4, -CON(R4)2 y -S02R4;
R4 se selecciona independientemente entre hidrógeno, alquilo C1-C5, cicloalquilo C3-C7, heterocicloalquilo C3-C7, alquenilo C2-C5, arilo C5-Ci8 y heteroarilo Cs-Ci8, opcionalmente sustituidos;
o una sal o solvato farmacéuticamente aceptable del mismo.
2. Un compuesto según la reivindicación 1, donde
R1 se selecciona entre hidrógeno, alquilo CrCi8, cicloalquilo C3-C7 y alquenilo C2-Ci8, opcionalmente sustituidos;
R2 se selecciona entre hidrógeno, alquilo CrCi8, cicloalquilo C3-C7, alquenilo C2-Ci8 y arilo C5- Ci8, opcionalmente sustituidos;
R3 se selecciona entre hidrógeno, alquilo C1-C5, cicloalquilo C3-C7 y alquenilo C2-C5, opcionalmente sustituidos;
o una sal o solvato farmacéuticamente aceptable del mismo.
3. Un compuesto según la reivindicación anterior, de fórmula general (II)
n-n o
**(Ver fórmula)**Fórmula (II)
donde R1, R2 y R3 se definen como en la reivindicación 2; o una sal o solvato farmacéuticamente aceptable del mismo.
4. Un compuesto según la reivindicación 2, de fórmula general (III)
**(Ver fórmula)**Fórmula (III)
donde R1, R2 y R3 se definen como en la reivindicación 2;
o una sal o solvato farmacéuticamente aceptable del mismo.
5. Un compuesto según una cualquiera de las reivindicaciones 1 a 4, donde R3 se selecciona entre hidrógeno y alquilo CrCi8 opcionalmente sustituido.
6. Un compuesto según la reivindicación anterior donde R3 es hidrógeno.
7. Un compuesto según una cualquiera de las reivindicaciones 1 a 6, donde R1 es un alquilo CrC18 opcionalmente sustituido.
8. Un compuestos según la reivindicación anterior donde R1 se selecciona entre metilo, etilo, propilo, butilo, hexilo, heptiloy 1,1-dimetilheptilo.
9. Un compuesto según la reivindicación anterior donde R1 es 1,1-dimetilheptilo.
10. Un compuesto según una cualquiera de las reivindicaciones 1 a 9, donde R2 es un grupo seleccionado entre hidrógeno y alquilo CrCi8 opcionalmente sustituido.
11. Un compuesto según la reivindicación anterior donde R2 se selecciona entre hidrógeno, metilo, etilo y propilo.
12. Un compuesto según cualquiera de las reivindicaciones 1 a 11, que se selecciona del grupo que consiste en:
a) 7-(1,1-dimetilheptil)-1,4-dihidro- 4,4-dimetilcromeno[4,3-c]pirazol-8,9-diona;
b) 7-(1,1-dimetilheptil)-2,4-dihidro-2,4,4-trimetilcromeno[4,3-c]pirazol-8,9-diona;
c) 7-(1,1-dimetilheptil)-1-etil-2,4-dihidro-4,4-dimetilcromeno[4,3-c]pirazol-8,9-diona;
o una sal o solvato farmacéuticamente aceptable del mismo.
13. Una composición farmacéutica que comprende al menos un compuesto según se ha definido en cualquiera de las reivindicaciones 1 a 12 y al menos un adyuvante o vehículo farmacéuticamente aceptable.
14. Composición según la reivindicación anterior que además comprende otro principio activo.
15. Uso de un compuesto según cualquiera de las reivindicaciones 1 a 12 para la
5 fabricación de un medicamento.
16. Uso de un compuesto según cualquiera de las reivindicaciones 1 a 12 o de una composición farmacéutica según cualquiera de las reivindicaciones 13 a 14 para la fabricación de un medicamento para el tratamiento de un cáncer o un tumor maligno.
17. Uso según la reivindicación anterior donde el cáncer o tumor maligno se selecciona entre carcinoma, sarcoma, linfoma, leucemia, mieloma y melanoma.
18. Uso según la reivindicación anterior donde el carcinoma se selecciona entre cánceres
15 de mama sensibles a hormonas (ER+/PR+), cánceres de mama Her2 positivos y cáncer de
mama triple negativo.
19. Uso según la reivindicación anterior donde el cáncer de mama es el cáncer de mama triple negativo.
20. Un procedimiento de obtención de un compuesto de fórmula general (I), caracterizado porque comprende una reacción de oxidación de un compuesto de fórmula general (IV) con ácido o-yodoxibenzoico
**(Ver fórmula)**R1
Fórmula (IV)
donde los sustituyentes R1, R2 y R3 se definen como en la reivindicación 1.
Patentes similares o relacionadas:
Composiciones y métodos anti-HCMV, del 22 de Julio de 2020, de Evrys Bio, LLC: Una composición que comprende un compuesto de la Fórmula I: **(Ver fórmula)** en donde: Ar es **(Ver fórmula)** en donde cada anillo cíclico de 5 o 6 miembros […]
Compuestos tricíclicos y sus usos en medicina, del 8 de Abril de 2020, de Sunshine Lake Pharma Co., Ltd (100.0%): Un compuesto que tiene la fórmula (I) o un estereoisómero, un isómero geométrico, un tautómero, un N-óxido, un hidrato, un solvato o una sal farmacéuticamente […]
Formas sólidas de un compuesto antiviral, del 12 de Febrero de 2020, de Gilead Pharmasset LLC: El fosfato de {(2S)-1-[(2S, 5S)-2-(9-{2-[(2S, 4S)-1-{(2R)-2-[(metoxicarbonil)amino]-2-fenilacetilo}-4- (metoximetil)pirrolidin-2-il]-1H-imidazol-5-il}-1,11-dihidroisocromeno[4',3':6,7]nafto[1,2-d]imidazol-2-il)-5-…
Derivados de piperidina como inhibidor de señalización wnt, del 4 de Diciembre de 2019, de KYOWA HAKKO KIRIN CO., LTD.: Un compuesto heterocíclico de anillo condensado representado por la fórmula general (I) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** [en donde […]
Derivados de (2-(5-isoindolin-2-il)pirimidin-4-il)-amina como inhibidores de Rho-quinasa para tratar enfermedades autoinmunes, del 20 de Noviembre de 2019, de Kadmon Corporation, LLC: Un compuesto de fórmula II: **(Ver fórmula)** R2 se selecciona del grupo que consiste en arilo, heteroarilo, C3-C7 cicloalquilo, un anillo heterocíclico de tres a doce […]
Conjugado de fármaco-anticuerpo dirigido contra HER2, del 15 de Octubre de 2019, de DAIICHI SANKYO COMPANY, LIMITED: Un conjugado de fármaco-anticuerpo en el que un compuesto antitumoral representado por la siguiente fórmula: se conjuga con un anticuerpo anti-HER2 a través de un […]
Derivados de pirrolo[2,3-d]pirimidina útiles para inhibir la Janus cinasa, del 18 de Septiembre de 2019, de PFIZER INC.: Un compuesto o una sal farmacéuticamente aceptable del mismo, seleccionado entre el grupo que consiste en: N-[cis-3-({[3-(difluorometil)azetidin-1-il]sulfonil}metil)ciclobutil]-N-metil-7H-pirrolo[2,3-d]pirimidin-4-amina; […]
Derivados de pirazolona como donadores de nitroxilo, del 21 de Agosto de 2019, de Cardioxyl Pharmaceuticals Inc: Un compuesto de fórmula (la)**Fórmula** o una sal farmacéuticamente aceptable del mismo, en donde: R1 es alquilo C1-C6 o fenilo sin sustituir; […]