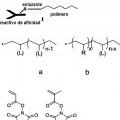
Marcadores elementales de cadena principal polimérica.
Un método para el análisis de un analito, que comprende:
(i) incubar un analito con un marcador elemental o un reactivo de afinidad con marcaje elemental,
en donde el marcador elemental o el reactivo de afinidad se une con el analito,
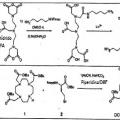
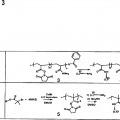
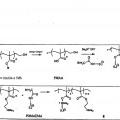
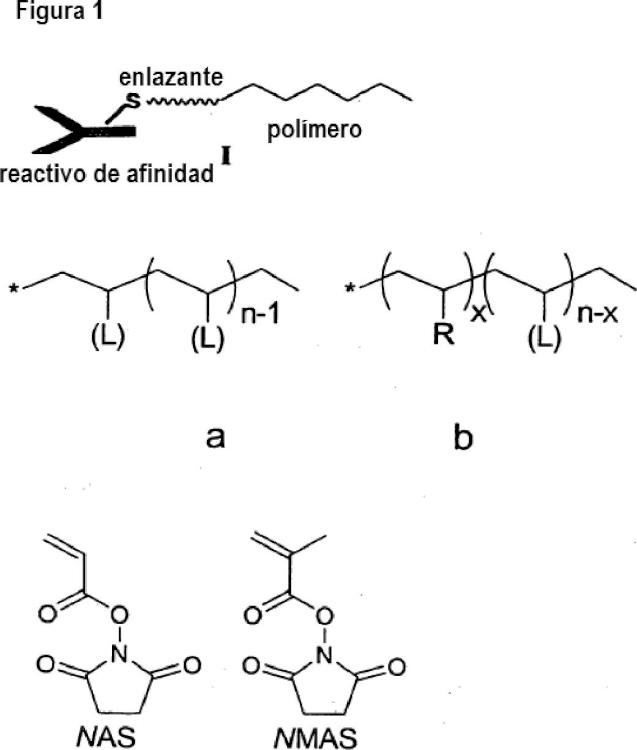
en donde, el marcador elemental comprende un polímero, o el reactivo de afinidad con marcaje elemental es marcado con un marcador elemental que comprende un polímero,
en donde, el polímero comprende al menos un grupo colgante de unión a metal, que comprende al menos un átomo de metal o es capaz de unirse a al menos un átomo de metal;
(ii) separar el reactivo de afinidad marcado no unido del reactivo de afinidad marcado unido o elementos de marcador no unidos de los elementos de marcador unidos; y
(iii) analizar el elemento unido al reactivo de afinidad unido al analito o elementos de marcador unidos mediante análisis elemental.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E11008035.
Solicitante: Fluidigm Canada Inc.
Inventor/es: WINNIK,MITCHELL A, NITZ,MARK, BARANOV,VLADIMIR, LOU,XUDONG.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C08F220/36 QUIMICA; METALURGIA. › C08 COMPUESTOS MACROMOLECULARES ORGANICOS; SU PREPARACION O PRODUCCION QUIMICA; COMPOSICIONES BASADAS EN COMPUESTOS MACROMOLECULARES. › C08F COMPUESTOS MACROMOLECULARES OBTENIDOS POR REACCIONES QUE IMPLICAN UNICAMENTE ENLACES INSATURADOS CARBONO - CARBONO (producción de mezclas de hidrocarburos líquidos a partir de hidrocarburos de número reducido de átomos de carbono, p. ej. por oligomerización, C10G 50/00; Procesos de fermentación o procesos que utilizan enzimas para la síntesis de un compuesto químico dado o de una composición dada, o para la separación de isómeros ópticos a partir de una mezcla racémica C12P; polimerización por injerto de monómeros, que contienen uniones insaturadas carbono-carbono, sobre fibras, hilos, hilados, tejidos o artículos fibrosos hechos de estas materias D06M 14/00). › C08F 220/00 Copolímeros de compuestos que tienen uno o más radicales alifáticos insaturados, teniendo solamente cada uno un enlace doble carbono-carbono, y estando solamente terminado por un radical carboxi o una sal, anhídrido, éster, amida, imida o nitrilo del mismo. › que contienen oxígeno en adición al oxígeno del carboxi.
- C08F8/42 C08F […] › C08F 8/00 Modificación química por tratamiento posterior (polímeros injertados, polímeros en bloque, reticulados con monómeros insaturados o con polímeros C08F 251/00 - C08F 299/00; de cauchos de dieno conjugados C08C). › Introducción de átomos de metal o grupos que contienen metal.
- G01N33/53 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Ensayos inmunológicos; Ensayos en los que interviene la formación de uniones bioespecíficas; Materiales a este efecto.
PDF original: ES-2553141_T3.pdf
Patentes similares o relacionadas:
Dispositivos modulares para puntos de atención y usos de los mismos, del 29 de Julio de 2020, de Labrador Diagnostics LLC: Un sistema para la detección automatizada de un analito a partir de una muestra de fluido corporal, que comprende: un dispositivo de fluidos que comprende: […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Anticuerpos del OPGL, del 15 de Julio de 2020, de AMGEN FREMONT INC.: Un anticuerpo, que comprende una cadena pesada y una cadena ligera, donde: a) la cadena pesada comprende: 1) una secuencia de aminoácidos recogida […]
ANTICUERPO MONOCLONAL O UNA PORCIÓN DE UNIÓN A ANTÍGENO DEL MISMO QUE SE UNE A LA PROTEÍNA L DEL VIRUS PARAINFLUENZA HUMANO (PIV); MÉTODO Y KIT PARA DETECTAR AL VIRUS PIV, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína L del virus parainfluenza humano (PIV), donde dichos […]
ANTICUERPOS MONOCLONALES ESPECÍFICOS PARA EL ANTÍGENO PB2 DEL VIRUS DE LA INFLUENZA HUMANA (FLU), SECUENCIAS NUCLEOTÍDICAS; MÉTODO Y KIT DE DIAGNÓSTICO DE INFECCIÓN PRODUCIDA POR FLU, del 2 de Julio de 2020, de PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE: La invención presenta la generación de anticuerpos monoclonales, o fragmentos de los mismos, que reconocen la proteína PB2 del virus de la influenza humana (Flu), […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Un ensayo de la respuesta inmunológica mediada por células, del 17 de Junio de 2020, de Cellestis Limited: Un método para medir una actividad de respuesta inmunológica mediada por células, comprendiendo dicho método: (a) proporcionar una composición de incubación […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]