Línea celular vero adaptada para crecer en suspensión, procedimiento para su obtención y vacunas virales.
La presente invención se relaciona con una línea celular Vero que puede crecer en un cultivo libre de suero y proteínas,
en suspensión, en ausencia de materiales de soporte para su adherencia, ycon la producción de vacunas virales usando dicha línea celular.Más específicamente, la presente invención esta relacionada con el establecimiento de una línea celular que puede crecer en un cultivo en suspensión sin la necesidad de que dichas células se adhieran a un material de soporte. Además, la presente invención provee un proceso para obtener dicha línea celular Vero y un procesopara producir vacunas virales con dicha línea celular. La presente invención también se refiere a los virus obtenidos por dicho proceso y las vacunas formuladas por dichos virus.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/ES2006/070143.
Solicitante: ZELLTEK S.A.
Nacionalidad solicitante: Argentina.
Dirección: LISANDRO DE LA TORRE, 3124 - DPTO. 2 - 3000 SANTA FE - SANTA FE ARGENTINA.
Inventor/es: DAELLI,Marcelo Gustavo, FORNO,Angela Guillermina, KRATJE,Ricardo, ETCHEVERRIGARAY,Marina, PAILLET,Cristian.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N5/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00).
- C12N5/071 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos de vertebrados, p.ej. células o tejidos humanos.
- C12N5/09 C12N 5/00 […] › Células tumorales.
- C12N7/00 C12N […] › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
PDF original: ES-2385930_T3.pdf
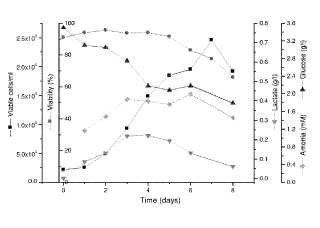
Fragmento de la descripción:
LÍNEA CELULAR VERO ADAPTADA PARA CRECER EN SUSPENSIÓN, PROCEDIMIENTO PARA SU OBTENCIÓN Y VACUNAS VIRALES
Campo técnico de la invención La presente invención versa acerca de una línea celular que puede ser cultivada en un cultivo libre de suero fetal bovino (FCS) y en suspensión sin un portador, y acerca de la producción de vacunas virales usando dicha línea celular. Más en particular, la presente invención se refiere al establecimiento de una línea celular que puede ser desarrollada en un cultivo libre de proteínas y en suspensión, sin la necesidad de que las células se adhieran a ningún portador, y a un procedimiento para producir vacunas virales con dicha línea celular. La presente invención se relaciona, además, con los virus obtenidos usando el procedimiento de la invención y con las vacunas formuladas con dichos virus.
Antecedentes de la invención Para la producción de vacunas virales se usan huevos de gallina, cerebros de ratón, células primarias o líneas celulares establecidas para propagar el virus (Principles of Virology. Molecular Biology, pathogenesis and control, 2001) . Estas técnicas convencionales tienen varios problemas:
1) El uso de huevos de gallina requiere la gestión de la crianza de pollos, debiendo ajustarse la gestión de los huevos fertilizados a una programación de producción de vacunas, y procedimientos laboriosos, que incluyen una exhaustiva purificación para eliminar por completo componentes derivados de las proteínas del huevo (Tree et al., 2001) .
2) Las líneas celulares requieren, en general, la adición de suero fetal bovino como un factor de crecimiento celular. Por lo tanto, existe un riesgo asociado de contaminación con agentes de infección y priones y, además, el FCS de alta calidad es muy caro, un hecho que suma un coste considerable a la vacuna.
3) Entre las líneas celulares establecidas en las que pueden propagarse diversos tipos de virus, las células Vero (células epiteliales de riñón del mono verde africano) se usan de forma generalizada para la producción de vacunas de alta calidad para seres humanos y animales (Butler et al., 2000; Franzzati-
Gallina et al., 2001; patente estadounidense nº 4.664.912; Montagnon, 1989; Montagnon et al., 1981) .
Además, las células Vero son las únicas células recomendadas para preparar virus para la producción de vacunas mediante genética inversa en el documento: “WHO guidance on development of influenza vaccine reference viruses by reverse genetics”. 2005.6, página 3.
Sin embargo, la células Vero tienen una tendencia a adherirse a las superficies. Así, el uso de células Vero para cultivos a gran escala, debido a la necesidad de reactores con una superficie muy grande o a la necesidad de introducción de portadores celulares en el cultivo, resulta sumamente costoso.
El suero fetal bovino se usa a menudo para la propagación de líneas celulares de mamíferos. Sin embargo, cuando se usan células de mamífero para la producción de proteínas recombinantes o la producción de virus, existe una presión creciente a eliminar el suero del procedimiento de fabricación. Algunas de las razones motivadoras para implementar una tecnología de cultivo celular libre de suero son el coste del suero, la variabilidad entre lotes de suero y la calidad del suero, inquietudes regulatorias relativas a los agentes biológicos en el suero y la preocupación de eliminar las proteínas del suero en el tratamiento corriente abajo. También existe una necesidad reconocida, por razones de reducción de costos y de aumento de escala del proceso, del uso de líneas celulares adaptadas al desarrollo en suspensión. Existe una necesidad urgente de desarrollar procedimientos más económicos para la producción de vacunas de calidad a bajo costo para hacerlas disponibles en el mundo entero.
Se han realizado muchos desarrollos para obtener líneas celulares Vero en suspensión para obtener un virus para la fabricación de vacunas (US 4.664.912, US 4.525.349, US 5.719.051; Higher production of rabies virus in serum-free medium cell cultures on microcarriers. Frazzati-Gallina NM. J Biotechnol., 14 de diciembre de 2001, 92 (1) :67-72) . Sin embargo, estos documentos describen, en general, el uso de portadores y microportadores para obtener suspensiones de líneas celulares Vero dependientes del anclaje.
En el estado de la técnica, nunca se ha documento una línea celular Vero para obtener un virus para la fabricación de vacunas, adaptada al desarrollo en suspensión, en ausencia de materiales de soporte para su adherencia (portadores o microportadores) , adaptada al desarrollo en un medio de cultivo libre de suero fetal bovino y capaz de desarrollarse también en un medio libre de proteínas. Por otra parte, hay referencia a líneas celulares Vero que pueden desarrollarse en suspensiones que forman agregados celulares (“The growth of Vero cells in suspension as cell-aggregates in serum-free media”. Cytotechnology. 1992; 10 (2) :169-74. Litwin J.) . Litwin describe un procedimiento para cultivar células Vero en suspensión como agregados celulares en medios libres de suero. Sin embargo, los agregados celulares son difíciles de infectar con virus y, por lo tanto, no son adecuados para la producción de vacunas (como puede leerse en la solicitud de patente US 2005153419-A) . No hay informe alguno de células Vero que puedan desarrollarse en suspensión como células individuales sin formar agregados en cultivos de alta densidad.
Para obviar las desventajas de la técnica anterior tal como se expone en lo que antecede, la presente invención ha establecido ahora una línea celular Vero novedosa que puede ser cultivada sin FCS, sin proteína y en suspensión comprendiendo células aisladas en ausencia de agregados celulares. Esta línea celular puede ser usada en la producción a gran escala de vacunas en reactores estándar de fermentación en ausencia de materiales de soporte para su adherencia (sin la necesidad de ningún tipo de soporte celular, tal como portadores o microportadores en el medio de cultivo) . Para los expertos en la técnica, las suspensiones de células individuales tienen ventajas conocidas con respecto a la suspensión de agregados; por ejemplo, mejora de la eficiencia en los sistemas de producción de virus que implican biorreactores de alta densidad. La presente invención también establece un procedimiento para producir una vacuna viral cultivando células Vero en suspensión sin FCS y luego infectando las células con el virus que va a usarse en la producción de la vacuna. La vacuna así producida es de bajo costo y tiene un perfil de alta seguridad.
Resumen de la invención La línea celular Vero, tema de la presente invención, útil para la producción de virus para la formulación de vacunas, está adaptada al desarrollo en suspensión, en ausencia de materiales de soporte para su adherencia y en un cultivo libre de suero fetal bovino. Además, esta línea celular está adaptada para desarrollarse en un cultivo libre de proteínas. Esta línea celular también está adaptada para desarrollarse en una suspensión como células aisladas, en ausencia de agregados celulares. Específicamente, esta línea celular está depositada en la Colección Alemana de Microorganismos y Cultivos Celulares (DSMZ, Braunschweig, Alemania) con el nombre sVero p66 y cuyo número asignado por la Autoridad Internacional de Depósito es DSM ACC2791.
En otra realización preferente de esta invención, se da a conocer un procedimiento para obtener un virus para la formulación de vacunas, que es constituyente de otro propósito de esta invención, comprendiendo las etapas siguientes:
a. desarrollar una línea celular Vero adaptada para desarrollarse en suspensión, en ausencia de materiales de soporte para su adherencia y, preferentemente, en ausencia de proteínas hasta una concentración de 11×105 a 30×106 células por ml de medio de cultivo;
b. infectar la línea celular de la etapa “a” con dicho virus con una multiplicidad óptima de infección (M.O.I.) de 0, 001 a 10; y
c. recoger el virus producido durante la infección, preferentemente por centrifugación.
En realizaciones preferentes de esta invención, dicho virus se selecciona del grupo que comprende el virus de la inmunodeficiencia humana, como el VIH-1 y el VIH-2; el virus de la poliomielitis; el virus de la hepatitis A, el virus de Coxsackie humano; el rinovirus; el ecovirus; el virus de la encefalitis equina; el virus de la rubéola, los virus del dengue, el virus de la encefalitis, el virus... [Seguir leyendo]
Reivindicaciones:
1. Una línea celular VERO adaptada para desarrollarse en suspensión, en ausencia de materiales de soporte, para su adherencia y en un medio de cultivo libre de suero fetal bovino, siendo dicha línea la línea depositada en la Colección Alemana de Microorganismos y Cultivos Celulares (DSMZ, Braunschweig, Alemania) con el nombre sVero p66 y cuyo número asignado por la Autoridad Internacional de Depósito es DSM ACC2791.
2. La línea celular de la reivindicación 1, estando adaptada la línea celular para desarrollarse en un medio de cultivo libre de proteínas.
3. La línea celular de la reivindicación 1 en la que dicha suspensión comprende células aisladas en ausencia de agregados celulares.
4. La línea celular de la reivindicación 1, siendo dicha línea útil para la producción de virus para la formulación de vacunas.
5. Un procedimiento para producir virus para formular vacunas, comprendiendo el procedimiento las etapas de:
a. desarrollar la línea celular VERO adaptada para desarrollarse en suspensión de la reivindicación 1 hasta una concentración celular de 1×105 a 30×106 células por ml de medio de cultivo;
b. infectar la línea celular de la etapa “a” con dicho virus con una multiplicidad óptima de infección de 0, 001 a 10; y c. recoger la producción de virus producida durante la infección.
6. El procedimiento de la reivindicación 5 en el que dicha línea celular VERO adaptada para desarrollarse en suspensión de la reivindicación 1 está adaptada para desarrollarse en un medio de cultivo libre de suero fetal 20 bovino y libre de proteínas.
7. El procedimiento de la reivindicación 5 en el que dicho virus está seleccionado del grupo que comprende el virus de la inmunodeficiencia humana, como el VIH-1 y el VIH-2; el virus de la poliomielitis; el virus de la hepatitis A, el virus de Coxsackie humano; el rinovirus; el ecovirus; el virus de la encefalitis equina; el virus de la rubéola, los virus del dengue, el virus de la encefalitis, el virus de la fiebre amarilla, los coronavirus, el virus de la estomatitis vesicular, el virus de la rabia, el virus del Ébola, los virus paragripales, el virus de las paperas, el virus del sarampión, el virus sincitial respiratorio, el virus de la gripe, el virus Hanta, los bunyavirus, el virus de la fiebre hemorrágica, el reovirus, el rotavirus, los parvovirus, el virus del papiloma, el poliomavirus, los adenovirus, los virus del herpes simple (VHS) 1 y 2, el virus de la varicela-zóster, el citomegalovirus (CMV) , el virus de la viruela, el virus vacuna, los poxvirus, el virus de la fiebre porcina africana y el agente no clasificado de la hepatitis delta y los agentes de las hepatitis no A y no B.
8. El procedimiento de la reivindicación 5 en el que dicho virus es el virus de la poliomielitis.
9. El procedimiento de la reivindicación 5 en el que dicho virus es el virus de la rabia.
10. El procedimiento de la reivindicación 5 en el que dicho virus es el virus de la hepatitis A.
11. El procedimiento de la reivindicación 5 en el que dicho virus es el virus de la fiebre amarilla.
12. El procedimiento de la reivindicación 5 en el que dicho virus es el virus de la gripe.
13. El procedimiento de la reivindicación 5 en el que dicha etapa “c” comprende una centrifugación.
Patentes similares o relacionadas:
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Nueva especie de tobamovirus, del 17 de Junio de 2020, de Nunhems B.V: Un tobamovirus cuyo genoma comprende al menos 83% de identidad de secuencia con la SEQ ID NÚM.: 1 y en el que el virus causa síntomas sistémicos en plantas homocigotas […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Métodos para la transducción y el procesamiento de células, del 27 de Mayo de 2020, de Juno Therapeutics, Inc: Un método de transducción, que comprende incubar, en una cavidad interna de una cámara de centrífuga, una composición de entrada que comprende células y partículas […]
Composiciones para tratar MPSI, del 22 de Abril de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector que lleva un casete de expresión que comprende un gen de la alfa-L-iduronidasa humana (hIDUA) que tiene la secuencia de nucleótidos de SEQ ID NO: […]
Métodos mejorados para producir terapias celulares adoptivas, del 22 de Abril de 2020, de Bluebird Bio, Inc: Un método in vitro para producir un producto terapéutico de células T que comprende: a) proporcionar una población de células mononucleares […]
Nuevo bacteriófago y composición que comprende el mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ25 (KCCM11463P) que tiene una capacidad específica para matar Escherichia coli patógena aviar.