FORMA DE DOSIFICACION ORAL PARA LA LIBERACION CONTROLADA DE FARMACOS.
Una forma de dosificación oral, que comprende:
(i) un núcleo erosionable,
núcleo que comprende una base débil farmacéuticamente activa o una sal o solvato de la misma farmacéuticamente aceptable; y
(ii) un recubrimiento erosionable en torno a dicho núcleo, recubrimiento que comprende una o más aberturas que se extienden de modo sustancialmente completo a través de dicho recubrimiento pero que no penetran en dicho núcleo y que comunican el medio de uso con dicho núcleo;
caracterizada porque la liberación de la base débil farmacéuticamente activa o de una sal o solvato de la misma farmacéuticamente aceptable a partir de la forma de dosificación ocurre sustancialmente a través de dicha(s) abertu-ra(s) por erosión de dicho núcleo erosionable y a través de la erosión de dicho recubrimiento erosionable en condiciones predeterminadas de pH
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB03/00594.
Solicitante: GLAXO GROUP LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: GLAXO WELLCOME HOUSE, BERKELEY AVENUE,GREENFORD, MIDDLESEX UB6 0NN.
Inventor/es: MARTINI,LUIGI,GLAXOSMITHKLINE, LI,CHI LEUNG,GLAXOSMITHKLINE, RE,VINCENZO GLAXOSMITHKLINE, WILLY,HELEN,ANNE GLAXOSMITHKLINE.
Fecha de Publicación: .
Fecha Concesión Europea: 20 de Enero de 2010.
Clasificación Internacional de Patentes:
- A61K9/20K
Clasificación PCT:
- A61K9/44 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en impresiones, relieves, ranuras o perforaciones.
Clasificación antigua:
- A61K9/44 A61K 9/00 […] › en impresiones, relieves, ranuras o perforaciones.
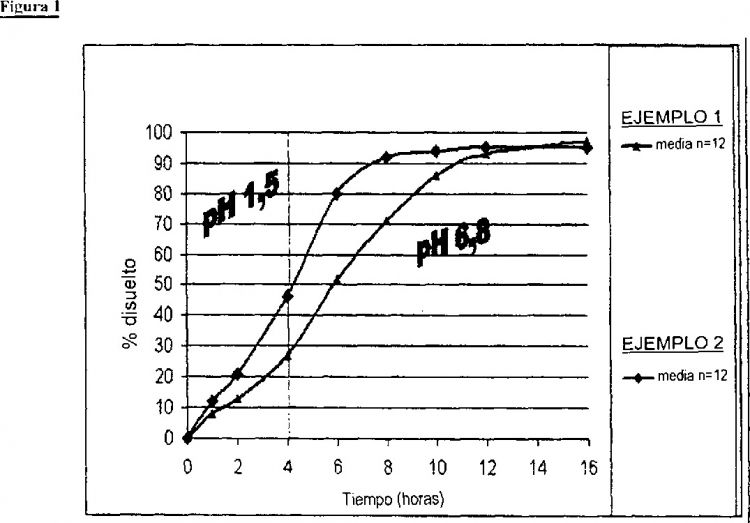
Fragmento de la descripción:
Forma de dosificación oral para la liberación controlada de fármacos.
Campo de la invención
La invención se refiere a una forma de dosificación oral que proporciona liberación controlada de un agente farmacéutico activo en diferentes medios corporales, a un procedimiento para preparar dicha forma de dosificación y al uso de dicha forma de dosificación en medicina.
Antecedentes de la invención
El uso de un recubrimiento para controlar la velocidad de liberación de un agente activo ha sido centro de atención y se han desarrollado muchos dispositivos diferentes para tal fin. Por ejemplo, en la solicitud internacional de patente, número de publicación WO 01/05430, se describe un dispositivo de suministro de fármaco que permite el suministro de sustancias farmacológicas que presentan solubilidad dependiente del pH, en particular compuestos que son más solubles a bajos niveles de pH (por debajo de pH 2) que a niveles casi neutros (mayores que aproximadamente pH 5). Tales dispositivos de liberación se caracterizan por la presencia de un recubrimiento que es impermeable e insoluble en el fluido ambiental de uso.
En la solicitud internacional de patente, número de publicación WO 95/30422, se describe una serie de formas de dosificación de liberación controlada de azitromicina. En particular. En particular, se describen una serie de formas de dosificación que reducen la exposición del tracto GI superior (es decir, el estómago) a altas concentraciones de azitromicina, por el uso de un recubrimiento dependiente del pH. Tales formas de dosificación no ofrecen aberturas a través de las cuales pueda ocurrir la liberación de la sustancia farmacológica.
La patente de EE.UU. número 6.099.859 describe un comprimido de liberación controlada para el suministro de un fármaco antihiperglucémico, que comprende un núcleo osmóticamente activo que contiene el fármaco y una membrana semipermeable, en el que la membrana semipermeable es permeable al paso de agua y fluidos biológicos y es impermeable al paso de la sustancia farmacológica. La membrana semipermeable contiene al menos una vía para la liberación del fármaco antihiperglucémico.
En la patente de EE.UU. número 5.004.614, se describen dispositivos adicionales que utilizan un recubrimiento para controlar la velocidad de liberación de un agente activo. En esta patente, se describe un núcleo de comprimido provisto de un recubrimiento externo que es sustancialmente impermeable al fluido ambiental. Dicho recubrimiento exterior puede prepararse a partir de materiales que o son insolubles o son solubles en los fluidos ambientales. Cuando se utiliza un material soluble, el recubrimiento es de espesor suficiente para que el núcleo no quede expuesto al fluido ambiental antes de que haya transcurrido la liberación controlada del agente activo. A través de este recubrimiento externo impermeable, se han creado una o más aberturas, de modo que se facilita a los fluidos ambientales una ruta de acceso al núcleo. Por lo tanto, al ser ingerido el comprimido recubierto, el fluido gastrointestinal puede entrar a través de la(s) abertura(s) y entrar en contacto con el núcleo, o penetrar en él, para liberar el agente activo. El resultado es que el agente activo es liberado de manera controlada y solamente por la(s) abertura(s). La geometría preferida es tal que hay un orificio circular en ambas caras superior e inferior del comprimido recubierto. La(s) abertura(s) en cuestión ocupa(n) una superficie que constituye aproximadamente 10 a 60 por ciento de la superficie de las caras del comprimido recubierto. Se encuentra que la velocidad de liberación del fármaco está directamente relacionada con el diámetro de la(s) abertura(s) y con la solubilidad del núcleo matricial y del agente activo, lo que permite la posibilidad de que haya diversos perfiles de liberación de fármacos correspondientes a una liberación de orden cero o de primer orden.
Esta invención se basa en el hallazgo de que los recubrimientos sustancialmente impermeables de la patente de EE.UU. 5.004.614 no son adecuados para la liberación controlada de todos los agentes activos, especialmente de las bases débiles farmacéuticamente activas, o sus sales y solvatos farmacéuticamente aceptables. Tales agentes activos presentan una acusada solubilidad dependiente del pH, es decir, son más solubles a un pH en el entorno de 2, asociado con regiones asentadas en el estómago, si se compara con su solubilidad en las condiciones generalmente neutras del intestino delgado, pH en torno a 7.
El documento GB-A-2150830 describe un dispensador osmótico de fármacos que tiene una pared entérica semipermeable que rodea a una formulación de fármaco.
Se ha encontrado que, para la administración de una base débil farmacéuticamente activa o una base o solvato de la misma farmacéuticamente aceptable, en que es deseable que la liberación del compuesto activo tenga lugar en más de un medio de pH, es beneficioso que el recubrimiento sea erosionable o soluble de una manera dependiente del pH.
Compendio de la invención
Por consiguiente, en su aspecto más amplio la presente invención proporciona una forma de dosificación oral que comprende un núcleo erosionable que contiene una base débil farmacéuticamente activa o una sal o un solvato farmacéuticamente aceptable de la misma, teniendo el núcleo un recubrimiento con una o más aberturas que conducen al núcleo, caracterizado porque el recubrimiento es erosionable en condiciones de pH predeterminadas.
La presente invención proporciona además una forma de dosificación oral, que comprende:
caracterizada porque la liberación de la base débil farmacéuticamente activa o de una sal o solvato de la misma farmacéuticamente aceptable a partir del núcleo erosionable ocurre sustancialmente a través de dicha(s) abertura(s) y a través de la erosión de dicho recubrimiento erosionable en condiciones predeterminadas de pH.
Para evitar dudas, tal como se usa aquí la expresión base débil
significará cualquier base cuyo ácido conjugado tenga un pKa menor que 11,5; de acuerdo con The Pharmaceutical Handbook, 19th Edition, 1980. La expresión base débil farmacéuticamente aceptable
se interpretará en consecuencia. Adecuadamente, las bases débiles farmacéuticamente activas y sus sales o solvatos farmacéuticamente aceptables para uso en la presente invención presentan una marcada solubilidad dependiente del pH. Preferiblemente, las bases débiles farmacéuticamente aceptables o sus sales o solvatos farmacéuticamente aceptables para uso en la presente invención son más solubles en el intervalo de pH de 1 a 3, comparada con su solubilidad en el intervalo de pH de 4,5 a 8. Las bases débiles farmacéuticamente aceptables preferidas o sus sales o solvatos farmacéuticamente aceptables para uso en la presente invención son más solubles en las condiciones ácidas encontradas en el estómago de los mamíferos que en las condiciones casi neutras del intestino de los mamíferos.
Las bases débiles farmacéuticamente activas adecuadas para uso en la presente invención incluyen: 1-(3-Clorofenil)-2-[(1,1-dimetiletil)amino]-1-propanona (bupropion
), 1,2,3,9-Tetrahidro-9-metil-3-[(2-metil-1H-imidazol-1-il)metil]-4H-carbazol-4-ona (ondansetron
), (3S-trans)-3-[(1,3-Benzodioxol-5-iloxi)metil]-4-(4-fluorofenil)piperidina (paroxetina
), a1-[[1,1-Dimetiletil)amino]metil]-4-hidroxi-1,3-bencenodimetanol (salbutamol
) y sus sales y/o solvatos farmacéuticamente aceptables.
La solicitud de patente europea con número de publicación 0306228A1 se refiere a ciertos derivados de tiazolidindiona que se dice que tienen actividad antihiperglucémica e hipolipidémica. Una tiazolidindiona particular descrita en EP 0306228A1 es 5-[4-[2-(N-metil-N-(2-piridil)amino)etoxi]bencil]tiazolidin-2,4-diona (aquí en lo sucesivo Compuesto A
). La solicitud internacional de patente con número de publicación WO 94/05659 describe ciertas sales del Compuesto A, incluida la sal maleato en el Ejemplo1 del mismo.
Reivindicaciones:
1. Una forma de dosificación oral, que comprende:
caracterizada porque la liberación de la base débil farmacéuticamente activa o de una sal o solvato de la misma farmacéuticamente aceptable a partir de la forma de dosificación ocurre sustancialmente a través de dicha(s) abertu-ra(s) por erosión de dicho núcleo erosionable y a través de la erosión de dicho recubrimiento erosionable en condiciones predeterminadas de pH.
2. Una forma de dosificación oral según la reivindicación 1, en la que el recubrimiento erosionable se erosiona pH > 4,5.
3. Una forma de dosificación oral según la reivindicación 2, en la que el recubrimiento erosionable se erosiona en el intervalo de pH de 4,5 a 8.
4. Una forma de dosificación oral según la reivindicación 3, en la que el recubrimiento erosionable se erosiona en el intervalo de pH de 5 a 7.
5. Una forma de dosificación oral según cualquier reivindicación precedente, en la que el material de recubrimiento erosionable se selecciona entre polímeros de polimetacrilato, poli(acetato-ftalato de vinilo) coprocesado, acetato-trimelitato de celulosa, acetato-ftalato de celulosa, laca, polímeros de ftalato de hidroxipropilmetilcelulosa y sus copolímeros, y mezclas de ellos.
6. Una forma de dosificación oral según cualquier reivindicación precedente, en la que el recubrimiento erosionable comprende plastificantes o agentes antipegajosos.
7. Una forma de dosificación oral según cualquier reivindicación precedente, en la que el revestimiento erosionable tiene un espesor en el intervalo de 0,05 a 0,5 mm.
8. Una forma de dosificación oral según cualquier reivindicación precedente, en la que los tamaños de la(s) aber- tura(s) están en el intervalo de 5 mm a 8 mm.
9. Una forma de dosificación oral según la reivindicación 8, en la que los tamaños de las aberturas tienen un diámetro de 1, 2, 4 u 8 mm.
10. Una forma de dosificación oral según cualquier reivindicación precedente, en la que la o las aberturas en el revestimiento erosionable comprende aproximadamente 10 a 70% de la superficie exterior total de la forma de dosificación.
11. Una forma de dosificación oral según cualquier reivindicación precedente, en la que el revestimiento erosionable comprende dos aberturas.
12. Una forma de dosificación oral según la reivindicación 1, en la que la forma de dosificación oral es un comprimido que tiene dos caras principales una opuesta a la otra, teniendo cada cara una abertura a través del revestimiento.
13. Una forma de dosificación oral según cualquier reivindicación precedente, en la que el núcleo erosionable está en una forma que consta de varias capas.
14. Una forma de dosificación oral según la reivindicación 13, en la que el núcleo erosionable es una bicapa.
15. Una forma de dosificación oral según cualquier reivindicación precedente, en la que el núcleo es predominantemente hidroxipropilmetilcelulosa y lactosa.
16. Una forma de dosificación oral según cualquier reivindicación precedente, que comprende un recubrimiento hermético.
17. Una forma de dosificación oral según la reivindicación 16, en la que el recubrimiento hermético es un subrecubrimiento respecto del recubrimiento erosionable.
18. Una forma de dosificación oral según cualquier reivindicación precedente, en la que la base débil farmacéuticamente aceptable se selecciona entre los compuestos principales
de la invención o una sal o solvato farmacéuticamente aceptable de los mismos.
19. Una forma de dosificación según la reivindicación 18, en la que la base débil farmacéuticamente aceptable es 5-[4-[2-(N-metil-N-(2-piridil)amino)etoxi]bencil]tiazolidin-2,4-diona o una sal o solvato farmacéuticamente aceptable de la misma.
20. Una forma de dosificación según la reivindicación 18, que comprende 2 a 12 mg de 5-[4-[2-(N-metil-N-(2-piridil)amino)etoxi]bencil]tiazolidin-2,4-diona o una sal o solvato farmacéuticamente aceptable de la misma.
21. Una forma de dosificación oral según la reivindicación 19 o 20, en la que la 5-[4-[2-(N-metil-N-(2-piridil)amino)etoxi]bencil]tiazolidin-2,4-diona está presente en forma de sal maleato.
22. Una forma de dosificación oral según la reivindicación 18, en la que la base débil farmacéuticamente aceptable es valaciclovir.
23. Una forma de dosificación según la reivindicación 1, en la que el núcleo comprende 7,1% en p/p de sal maleato de 5-[4-[2-(N-metil-N-(2-piridil)amino)etoxi]bencil]tiazolidin-2,4-diona, 30,0% en p/p de HPMC, 60,9% de lactosa, 0,5% en p/p de dióxido de silicio coloidal y 1,5% en p/p de estearato de magnesio.
24. Una forma de dosificación según la reivindicación 1, en la que el núcleo comprende 7,1% en p/p de sal maleato de 5-[4-[2-(N-metil-N-(2-piridil)amino)etoxi]bencil]tiazolidin-2,4-diona, 20,0% en p/p de HPMC, 70,9% de lactosa, 0,5% en p/p de dióxido de silicio coloidal y 1,5% en p/p de estearato de magnesio.
25. Un procedimiento para la preparación de una forma de dosificación oral según la reivindicación 1, cuyo procedimiento comprende:
Patentes similares o relacionadas:
SISTEMAS MODULARES PARA LA LIBERACIÓN CONTROLADA DE UNA SUSTANCIA CON CONTROL DE ESPACIO Y TIEMPO, del 13 de Diciembre de 2011, de UNIVERSITA' DEGLI STUDI DI PARMA: Módulo para liberación controlada de fármaco en el tracto gastrointestinal, compuesto por una matriz de polímeros biocompatibles, un principio activo […]
 FORMAS DE DOSIFICACIÓN DE LIBERACIÓN MODIFICADA CON DOS NÚCLEOS Y UNA ABERTURA, del 24 de Marzo de 2011, de MCNEIL-PPC, INC.: Una forma de dosificación que comprende al menos un ingrediente activo, un primer núcleo, y un segundo núcleo, estando cada uno de dichos primer y segundo núcleos rodeados […]
FORMAS DE DOSIFICACIÓN DE LIBERACIÓN MODIFICADA CON DOS NÚCLEOS Y UNA ABERTURA, del 24 de Marzo de 2011, de MCNEIL-PPC, INC.: Una forma de dosificación que comprende al menos un ingrediente activo, un primer núcleo, y un segundo núcleo, estando cada uno de dichos primer y segundo núcleos rodeados […]
 FORMULACION DE LIBERACION CONTROLADA QUE TRAMADOL FORMULACION DE LIBERACION CONTROLADA QUE CONTIENE TRAMADOL, del 19 de Octubre de 2010, de EURO-CELTIQUE S.A.: Uso de tramadol en la fabricación de una preparación analgésica de liberación controlada para una administración oral de una vez al día, en […]
FORMULACION DE LIBERACION CONTROLADA QUE TRAMADOL FORMULACION DE LIBERACION CONTROLADA QUE CONTIENE TRAMADOL, del 19 de Octubre de 2010, de EURO-CELTIQUE S.A.: Uso de tramadol en la fabricación de una preparación analgésica de liberación controlada para una administración oral de una vez al día, en […]
 PRODUCTO PARA EL TRATAMIENTO DE INFLAMACIONES, HERIDAS Y/O AFTAS EN LA ZONA BUCAL Y UTILIZACION DE DICHO PRODUCTO, del 21 de Julio de 2010, de LOHMANN & RAUSCHER GMBH & CO. KG: Producto para el tratamiento de inflamaciones, heridas y/o aftas en la región bucal, compuesto por un material principalmente bioabsorbible que contiene […]
PRODUCTO PARA EL TRATAMIENTO DE INFLAMACIONES, HERIDAS Y/O AFTAS EN LA ZONA BUCAL Y UTILIZACION DE DICHO PRODUCTO, del 21 de Julio de 2010, de LOHMANN & RAUSCHER GMBH & CO. KG: Producto para el tratamiento de inflamaciones, heridas y/o aftas en la región bucal, compuesto por un material principalmente bioabsorbible que contiene […]
 SISTEMA TERAPEUTICO PARA LA LIBERACION CONTROLADA DE INGREDIENTES ACTIVOS, del 20 de Mayo de 2010, de JAGOTEC AG: Un sistema terapéutico para la liberación controlada de uno o más ingredientes activos, con una abertura programada previamente, caracterizado por el hecho de que comprende […]
SISTEMA TERAPEUTICO PARA LA LIBERACION CONTROLADA DE INGREDIENTES ACTIVOS, del 20 de Mayo de 2010, de JAGOTEC AG: Un sistema terapéutico para la liberación controlada de uno o más ingredientes activos, con una abertura programada previamente, caracterizado por el hecho de que comprende […]
 COMPRIMIDO DE LIBERACION CONTROLADA POR VIA ORAL CON NUCLEO UNITARIO, del 11 de Noviembre de 2009, de ANDRX PHARMACEUTICALS, INC.: Un comprimido farmacéutico de liberación controlada comprendiendo:
(a) un núcleo comprendiendo:
(i) de un 50 a un 98% de una biguanida como un fármaco antihiperglicémico; […]
COMPRIMIDO DE LIBERACION CONTROLADA POR VIA ORAL CON NUCLEO UNITARIO, del 11 de Noviembre de 2009, de ANDRX PHARMACEUTICALS, INC.: Un comprimido farmacéutico de liberación controlada comprendiendo:
(a) un núcleo comprendiendo:
(i) de un 50 a un 98% de una biguanida como un fármaco antihiperglicémico; […]
 ENVASE DE TIRAS, del 16 de Marzo de 2009, de DRUGTECH CORPORATION: Un aparato dispensador desechable para proporcionar soporte terapéutico óptimo a un animal aumentando el cumplimiento de un régimen de dosis complejo y facilitando la administración […]
ENVASE DE TIRAS, del 16 de Marzo de 2009, de DRUGTECH CORPORATION: Un aparato dispensador desechable para proporcionar soporte terapéutico óptimo a un animal aumentando el cumplimiento de un régimen de dosis complejo y facilitando la administración […]
Forma farmacéutica con perfil de liberación de orden cero fabricada por impresión tridimensional, del 3 de Enero de 2018, de MASSACHUSETTS INSTITUTE OF TECHNOLOGY: Un comprimido de liberación controlada fabricado por impresión tridimensional, que comprende: una región más interior impresa tridimensionalmente , y […]