Cepa de corinebacteria que tiene mejorada la productividad de 5¿-xantosina monofosfato y procedimiento de producción de 5¿-xantosina monofosfato usando la misma.
Uso de una cepa de Corinebacteria para la producción de xantosina 5'-monofosfato,
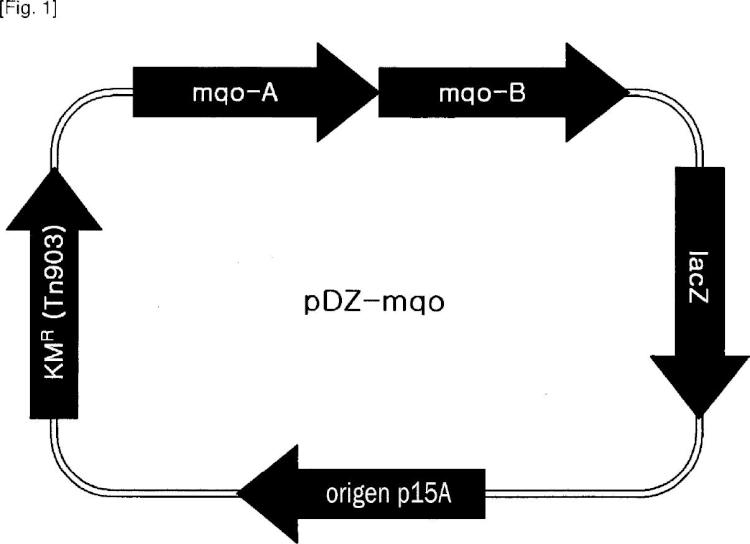
en el que la cepa de Corinebacteria tiene una actividad malato deshidrogenasa más alta que su actividad endógena de tipo silvestre, mediante el aumento del número de copias del gen mqo que codifican la malato deshidrogenasa, o mediante la sustitución o modificación de un promotor de un gen mqo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/KR2009/007559.
Solicitante: CJ CHEILJEDANG CORPORATION.
Nacionalidad solicitante: República de Corea.
Dirección: 292, Ssangnim-dong Jung-gu Seoul, 100-400 REPUBLICA DE COREA.
Inventor/es: KIM,Hye-Won, LEE,Ji-Hye, CHO,JINMAN, LEE,JINNAM, OH,YOON SEOK, PARK,JANG HEE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N1/20 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Bacterias; Sus medios de cultivo.
- C12P19/02 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 19/00 Preparación de compuestos que contienen radicales sacárido (ácido cetoaldónico C12P 7/58). › Monosacáridos.
- C12P19/34 C12P 19/00 […] › Polinucleótidos, p. ej. ácidos nucleicos, oligorribonucleótidos.
PDF original: ES-2553571_T3.pdf
Patentes similares o relacionadas:
Método para producir carne capaz de reducir el consumo de ácidos grasos saturados, del 22 de Julio de 2020, de Biobalance Co., Ltd: Lactobacillus plantarum BB-PLT (NITE BP-02097).
Composición adecuada para proteger microorganismos, del 15 de Julio de 2020, de SOCIETE DES PRODUITS NESTLE S.A.: Una composición que comprende un material soporte formado por un polisacárido, al menos un antioxidante y una combinación de aminoácidos seleccionados entre cisteína y […]
Consorcio de microorganismos y su uso para reducir la demanda química de oxígeno del fluido consumido para trabajar metales, del 15 de Julio de 2020, de FORD MOTOR COMPANY LIMITED: Un consorcio de microorganismos que comprende, consiste o consiste esencialmente en Rhizobium radiobacter NCIMB 42280, Bacillus subtilis NCIMB […]
PROCEDIMIENTO DE OBTENCIÓN DE SUBPRODUCTOS A PARTIR DE RESIDUOS DE CAFÉ Y APLICACIONES DE LOS MISMOS, del 13 de Julio de 2020, de UNIVERSIDAD DE GRANADA: Procedimiento de obtención de subproductos a partir de residuos de café y aplicaciones de los mismos. La presente invención consiste en un proceso […]
UNA FORMULACIÓN PARA LA PROTECCIÓN CONTRA LA BACTERIOSIS DEL KIWI, CAUSADA POR LA BACTERIA PSEUDOMONAS SYRINGAE PV. ACTINIDIAE (PSA), del 9 de Julio de 2020, de UNIVERSIDAD DE CONCEPCION: La tecnología corresponde a una formulación para la protección contra la bacteriosis del kiwi, causada por la bacteria Pseudomonas syringae […]
Novedosa cepa de Gluconacetobacter diazotrophicus (Gd) y uso de la misma en agricultura, del 8 de Julio de 2020, de Azotic Technologies Ltd: Una cepa fijadora de nitrógeno de Gluconacetobacter diazotrophicus (Gd) depositada por CABI en el Reino Unido con el número de acceso del depósito IMI 504958.
Selección y uso de cepas de bacilos tolerantes al frío como fitoestimuladores biológicos, del 8 de Julio de 2020, de Abitep GmbH: Composición para estimular el crecimiento de plantas de cultivo, caracterizada por el hecho de que contiene la cepa tolerante al frío Bacillus atrophaeus ABI02A […]
PROCEDIMIENTO PARA REDUCIR EL CONTENIDO DE HISTAMINA EN VINOS, del 7 de Julio de 2020, de PAGO DE CARRAOVEJAS, S.L: Procedimiento para reducir el contenido de histamina en vinos. La invención consiste en un proceso a través del cual, seleccionando una serie de poblaciones de bacterias […]