Alfa-fetoproteína recombinante, procedimiento y medios para la preparación de la misma, composiciones basadas en la misma y uso de la misma.
Un plásmido pKX recombinante que comprende:
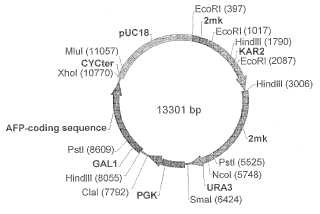
un módulo de expresión de SEQ ID NO:
1 que codifica una alfa-fetoproteína humana madura (SEQ ID NO: 2), un fragmento del plásmido bacteriano pUC18, una región de inicio de la replicación de un plásmido de levadura de 2 μm, un gen KAR2 que proporciona el correcto ensamblado de la proteína y la secreción del producto deseado a un medio de cultivo, un gen PDI1 que proporciona la correcta formación de enlaces disulfuro, un marcador de levadura URA3 selectivo y PGK1 selectivo.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/RU2005/000369.
Solicitante: Tatulov, Eduard Borisovich.
Nacionalidad solicitante: Federación de Rusia.
Dirección: Aviatorov ul. 8/1 - 148/149 Moscow 119619 FEDERACION RUSA.
Inventor/es: TATULOV,EDUARD BORISOVICH, BENEVOLENSKY,Sergei Vladimirovich, MARCHENKO,Alexei Nikolaevich, KOZLOV,Dmitry Georgievich, ZATSEPIN,Sergei Sergeevich, SHINGAROVA,Lyudmila Nikolaevna, DUDICH,Igor V, SEMENKOVA,Lidiya N, DUDICH,Dmitry I, DUDICH,Elena I.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N15/81 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › para levaduras.
PDF original: ES-2384863_T3.pdf
Fragmento de la descripción:
Alfa-fetoproteína recombinante, procedimiento y medios para la preparación de la misma, composiciones basadas en la misma y uso de la misma
Campo de la invención
La invención se refiere a la industria microbiológica y médica, la ingeniería genética y la biotecnología. Se pretende una a-fetoproteína (AFP) recombinante según la presente invención, que retiene la actividad de la AFP humana y se obtiene a partir de suero, para uso en oncología, inmunoterapia y cosmetología.
Antecedentes de la invención
La alfa-fetoproteína (AFP) es el componente principal del suero sanguíneo embrionario de mamíferos, que se sintetiza por hígado embrionario y saco vitelino durante el desarrollo perinatal. Inmediatamente después del nacimiento, se reduce bruscamente el nivel de AFP en el suero y su expresión se vuelve indetectable en individuos adultos sanos (Deutsch H.F., 1991, Adv. Canc. Res. 56, 253-312) . Se renueva la síntesis de AFP con el desarrollo maligno de tumores hepáticos y teratoblastomas germinogénicos, y podría ser detectable en menor grado en el caso de lesión química y mecánica del hígado acompañada de regeneración, por ejemplo, durante hepatitis vírica aguda o cirrosis (Mizejewsky G.J., 2002, Expert Rev. Anticancer. Ther. 2: 89-115) .
La AFP humana es una glucoproteína consistente en 590 aminoácidos y que comprende aproximadamente un 4% de componente carbohidrato (Morinaga T., et al., 1983, Proc. Natl. Acad. Sci., U.S.A., 80, 4604-4608; Pucci P. et al., 1991, Biochemistr y 30, 5061-5066) . Una de las propiedades principales de la AFP es la captación no covalente de diferentes sustancias químicas de bajo peso molecular, tales como ácidos grasos poliinsaturados, hormonas esteroideas, metales, retinoides, antibióticos hidrofóbicos y otros (Aussel S. y Masseyeff R., 1994, Biochem. Biophys. Res. Commun. 119: 1122-1127; Deutsch H.F., 1994, J. Tumor Marker Oncol., 9: 11-14) . En las etapas tempranas del desarrollo embrionario, la AFP reemplaza a la albúmina como vehículo de transporte de ácidos grasos y otras sustancias de bajo peso molecular (Deutsch H.F., 1991, Adv. Canc. Res. 56, 253-312) .
La molécula de AFP consiste en tres dominios estructurales globulares unidos por 15 enlaces disulfuro intercatenarios que aumentan significativamente la complejidad del proceso de ensamblado de la estructura terciaria de una proteína (Morinaga T., et al., 1983, Proc. Natl. Acad. Sci. U.S.A., 80, 4604-4608; Pucci P., et al., 1991, Biochemistr y 30, 5061-5066) . Además, es un elemento estructural importante de la molécula de AFP el componente carbohidrato, que proporciona una correcta recepción y funcionamiento de la molécula (Deutsch H.F., 1991, Adv. Canc. Res. 56, 253-312) .
Además de la cadena polipeptídica consistente en 590 residuos aminoacídicos, la estructura de la molécula de AFP embrionaria sérica o la secretada por células de hepatocarcinoma incluye un grupo oligosacarídico ligado a asparagina según la glucosilación de tipo N (Yamashita K. et al., 1993, Cancer Res. 53: 2970-2975) . La estructura de una cadena oligosacarídica de AFP es heterogénea y depende de diferentes factores: la etapa de desarrollo del hepatocarcinoma o la etapa de desarrollo del embrión. Los oligosacáridos afectan a las propiedades estructurales de la molécula de AFP, y podrían incluirse en el contenido de determinantes antigénicos y centros de unión a receptor (Deutsch H.F., 1991, Adv. Canc. Res. 56, 253-312) . A diferencia de la AFP sérica, la AFP recombinante expresada en células bacterianas no está glucosilada, lo que es una distinción característica del producto caracterizado en los trabajos de Murgita (patentes de EE.UU. 6.331.611, 6.627.440, 6.416.734) y, en consecuencia, tiene propiedades estructurales y funcionales que la distinguen del análogo sérico y también de la AFP recombinante expresada en sistemas de levadura. Es conocido que, durante la expresión de proteínas heterólogas en levaduras, se lleva a cabo su glucosilación con respecto a los mismos residuos aminoacídicos que en el análogo sérico, pero la estructura de los oligosacáridos mismos difiere significativamente con respecto a la constitución, longitud y ramificación de la cadena, lo que predetermina también ciertas distinciones en las propiedades estructurales y funcionales de las correspondientes proteínas (Hard K. et al., 1998, FEBS Lett. 248: 111) .
45 La AFP puede absorberse selectivamente por células que expresan receptores específicos de AFP (AFPR) , tales como células embrionarias, citoblastos, células inmunitarias activadas, células cancerosas o células transformadas por ciertos tipos de retrovirus (Uriel J. et al., 1989, en Jizejewsky G.I., Jakobson H.I. (eds) : “Biological Properties of Alpha-Fetoprotein”. Boca Ratón, CRC Press, vol. 2: 103-117) . Las células maduras normales pierden la capacidad de absorber AFP y no expresan AFPR específicos. En vista de esta propiedad de la AFP, se han propuesto 50 procedimientos para el uso terapéutico de AFP con el fin de orientar el suministro de citostáticos y otras sustancias a un tumor, suprimiendo el crecimiento de células cancerosas (Deutsch H.F., 1994, J. Tumor Marker Oncol. 9: 11-14; Tsukada Y. et al., 1994, J. Tumor Marker Oncol. 9: 99-103) .
La AFP tiene una serie de propiedades funcionales que se están estudiando intensamente en la actualidad. El concepto clásico de AFP como análogo de seroalbúmina embrionaria está actualmente complementado con datos 55 referentes a la capacidad de la AFP de llevar a cabo la regulación del crecimiento, desarrollo y muerte programada de células (Mizejewsky G.J., 2002, Expert Rev. Anticancer. Ther. 2: 89-115) . En particular, se ha mostrado que la AFP recombinante, de forma similar al análogo sérico y cultivado, es capaz de suprimir el crecimiento de tejidos tumorales y normales dependientes de estrógeno (Bennett J.A. et al., 1997, Breast Cancer Res. Treat. 45, 169-179;
Bennet J.A. et al., 1998, Clinical Cancer Research, 4, 2877-2884) . Recientemente, se ha establecido que la actividad oncosupresora de la AFP se lleva a cabo de acuerdo con el mecanismo de desencadenamiento de la apoptosis, que se caracteriza por cambios morfológicos típicos, la detención del crecimiento, citotoxicidad y fragmentación de ADN (Semenkova L.N., 1997, Tumor Biol. 18, 261-274; Dudich E.I., et al., 1998, Tumor Biol. 19, 30-40; Dudich E.I., et al., 1999, Eur. J. Biochem. 266: 1-13; Semenkova L., et al., 2003, Eur. J. Biochem. 70: 4388-4399) .
Estudios anteriores han mostrado la capacidad de la AFP de regular la diferenciación y activación de células inmunitarias. En particular, la AFP es capaz de suprimir células inmunitarias activadas con aloantígenos o autoantígenos e inhibir la expresión de diversos genes de citocinas (Yamashita K., et al., 1993, Cancer Res. 53, 2970-2975; patente de EE.UU. nº 5.965.528) . Por otro lado, la AFP induce una notable estimulación del crecimiento de células de médula ósea inmaduras, citoblastos y células embrionarias (Dudich E.I., et al., 1998, Tumor Biol. 19, 30-40; patente de EE.UU. nº 6.627.440) .
Estas propiedades de la AFP, y también la selectividad aumentada de la absorción de AFP por células cancerosas in vivo (Uriel J., et al., 1989, en Mizejewsky G.I., Jakobson H.I., eds: “Biological Properties of Alpha-Fetoprotein”. Boca Ratón, CRC Press. vol, 2: 103-117) , han revelado la base para su uso en medicina como preparación terapéutica en el tratamiento de enfermedades autoinmunitarias (patente de EE.UU. nº 5.965.528) y oncológicas (patente de EE.UU. nº 6.416.734; Mizejewsky G.J., 2002, Expert Rev. Anticancer. Ther. 2: 89-115) . Además, la AFP se usa tradicionalmente como marcador oncoembrionario para el diagnóstico temprano de enfermedades oncológicas y patologías del desarrollo embrionario (Deutsch H.F., 1991, Adv. Canc. Res. 56, 253-312) . Sin embargo, el uso de AFP natural como fármaco es tecnológicamente imposible debido a la deficiencia de material bruto.
Tradicionalmente, es una fuente para la obtención de AFP el suero sanguíneo de mujeres embarazadas, el suero embrionario de cordón umbilical o el fluido ascítico de pacientes de cáncer. Obviamente, ninguna de estas fuentes es aceptable para la producción de una sustancia proteica con fines médicos debido, en primer lugar, a que está extremadamente limitado el acceso a la fuente de material bruto y a que el contenido de AFP en el mismo es bajo, y en segundo lugar, existe el riesgo creciente de infección con virus o priones.
Se han publicado datos anteriormente respecto a la expresión y purificación de... [Seguir leyendo]
Reivindicaciones:
1. Un plásmido pKX recombinante que comprende: un módulo de expresión de SEQ ID NO:1 que codifica una alfa-fetoproteína humana madura (SEQ ID NO: 2) , un fragmento del plásmido bacteriano pUC18, una región de inicio de la replicación de un plásmido de levadura de 2 μm, un gen KAR2 que proporciona el correcto ensamblado de la proteína y la secreción del producto deseado a un medio de cultivo, un gen PDI1 que proporciona la correcta formación de enlaces disulfuro, un marcador de levadura URA3 selectivo y PGK1 selectivo.
2. Una célula productora eucarótica que tiene la capacidad de secretar alfa-fetoproteína recombinante humana transformándola con el plásmido pKX según la reivindicación 1.
3. Un procedimiento para la preparación de una alfa-fetoproteína recombinante (SEQ ID NO: 2) que
comprende: cultivar una célula eucariótica según la reivindicación 2, teniendo la célula la capacidad de secretar una alfa-fetoproteína recombinante al medio de cultivo, y la etapa de aislar la alfa-fetoproteína recombinante a partir del medio de cultivo.
4. El procedimiento según la reivindicación 3, caracterizado porque la célula eucariótica es una célula de levadura.
5. El procedimiento según la reivindicación 4, caracterizado porque el cultivo se lleva a cabo a una temperatura d.
2. 33ºC en un medio que comprende: glucosa - 2%, glicerina – 1, 5%, extracto de levadura - 1%, peptona - 2%, agua destilada, con el mantenimiento del pH del medio a 4, 5-7, 0 mediante tamponación adicional y añadiendo oxígeno soluble hasta pO > 20%.
Patentes similares o relacionadas:
Sistema de expresión génica inducible por D-aminoácido para Rhodosporidium y Rhodotorula, del 6 de Mayo de 2020, de TEMASEK LIFE SCIENCES LABORATORY LIMITED: Un sistema de expresión génica inducible por D-aminoácido operable en una célula fúngica transgénica que comprende una construcción de ácido nucleico que comprende un […]
Secuencias de expresión, del 12 de Febrero de 2020, de LONZA LTD.: Un ácido nucleico aislado que codifica un líder unido de forma operable a una secuencia de ácidos nucleicos que codifica una proteína de interés (PDI), en donde el ácido nucleico […]
Cartucho de expresión para la trasformación de una célula eucariótica, método para transformar una célula eucariótica, organismo genéticamente modificado, y procedimiento para la producción de biocombustibles y/o compuestos bioquímicos y biocombustibles producidos de ese modo, del 13 de Noviembre de 2019, de Biocelere Agroindustrial Ltda: Un casete de expresión para transformar una célula eucariótica caracterizado porque comprende una combinación de los siguientes casetes de expresión: […]
Promotor regulable, del 8 de Noviembre de 2019, de LONZA LTD.: Un método para producir una proteína de interés (PDI) mediante el cultivo de una línea de células eucariotas recombinantes que comprenden una construcción […]
Métodos y composiciones para producir escualeno empleando levaduras, del 2 de Octubre de 2019, de Cibus Europe B.V: Una composición que comprende una levadura transformada genéticamente, en donde dicha levadura transformada genéticamente expresa una o más enzimas modificadas […]
Célula de levadura que consume acetato, del 25 de Septiembre de 2019, de DSM IP ASSETS B.V.: Una célula de levadura que está modificada genéticamente, que comprende: a) una alteración de una o más aldehído deshidrogenadas (E.C:1.2.1.4) nativas de la […]
Transformante y procedimiento para la producción del mismo, y procedimiento para la producción de ácido láctico, del 28 de Agosto de 2019, de JMTC Enzyme Corporation: Transformante de Schizosaccharomyces pombe que comprende 3 copias de un gen de lactato deshidrogenasa humano, en el que las 3 copias del gen de lactato deshidrogenasa humano […]
Anticuerpo de PD-1, fragmento de unión a antígeno del mismo y aplicación médica del mismo, del 21 de Agosto de 2019, de Shanghai Hengrui Pharmaceutical Co. Ltd: Un anticuerpo de PD-1, o un fragmento de unión a antígeno del mismo, que comprende: una región variable de cadena ligera que comprende […]