PROCEDIMIENTO PARA DIAGNOSTICAR ENFERMEDADES BASADO EN NIVELES DE ANTICUERPOS ANTI-GLICANOS.
Un procedimiento útil en el diagnóstico de la enfermedad de Crohn en un sujeto,
comprendiendo el procedimiento identificar en una muestra para análisis de un sujeto con síntomas de la enfermedad de Crohn un anticuerpo dirigido contra glicanos específico, en el que dicho anticuerpo dirigido contra glicanos específico es un anticuerpo anti-GlcNAc(&946;,1-4)GlcNAc(&946;) o un anticuerpo antiGlc(&946;,1-3)Glc(&946;), en el que la identificación de niveles elevados de dicho anticuerpo en dicha muestra para análisis respecto a una muestra de control indica que es probable que el sujeto padezca la enfermedad de Crohn
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2004/004389.
Solicitante: GLYCOMINDS LTD.
Nacionalidad solicitante: Israel.
Dirección: 1 YODFAT STREET, ALON BUILDING, GLOBAL PARK LOD 71291 ISRAEL.
Inventor/es: DUKLER,AVINOAM, DOTAN,NIR.
Fecha de Publicación: .
Fecha Solicitud PCT: 3 de Diciembre de 2004.
Fecha Concesión Europea: 2 de Junio de 2010.
Clasificación Internacional de Patentes:
- G01N33/543 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
- G01N33/68B
- G01N33/68V
Clasificación PCT:
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Clasificación antigua:
- G01N33/68 G01N 33/00 […] › en los que intervienen proteínas, péptidos o aminoácidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania.
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La invención se refiere en general a un procedimiento para diagnosticar enfermedades mediante la detección de anticuerpos de glicanos en un sujeto. Más concretamente, la invención se refiere a procedimientos útiles para diagnosticar enfermedades digestivas tales como la enfermedad de Crohn (EC).
ANTECEDENTES DE LA INVENCIÓN
La enfermedad inflamatoria intestinal (EII), que se produce en todo el mundo y afecta a millones de personas, es el término colectivo usado para describir dos trastornos gastrointestinales de etiología desconocida: la enfermedad de Crohn (EC) y la colitis ulcerosa (CU). La EII y el síndrome del intestino irritable (SII) afectarán a la mitad de los estadounidenses durante su vida, con un coste de varios miles de millones de dólares. El factor determinante principal de estos elevados costes médicos es la dificultad de diagnóstico de las enfermedades digestivas. El coste asociado con EII y al SII se ve aumentado debido a la pérdida en la productividad, puesto que las personas que padecen estos trastornos faltan a su trabajo una media de al menos ocho días más al año que las personas que no padecen estos trastornos.
El resto de síntomas asociados a la EC incluyen, por ejemplo, dolor abdominal, diarrea crónica, sangrado rectal, pérdida de peso y retortijones. Estos síntomas también se producen en el síndrome del intestino irritable y otras enfermedades inflamatorias intestinales. Esto hace que el diagnóstico definitivo de la EC sea extremadamente difícil. De hecho, sólo se ha diagnosticado la enfermedad a aproximadamente una décima parte de los varios millones de personas que posiblemente padezcan la EC. La dificultad en el diagnóstico diferencial de la EC respecto a otras enfermedades digestivas como la CU y el SII obstaculiza el tratamiento temprano y eficaz de estas enfermedades.
La EC (ileítis regional o ileítis terminal) puede afectar a cualquier parte del intestino, siendo el íleon y el colon los lugares más habitualmente afectados. En la EC, la inflamación es asimétrica y segmentaria, con áreas de tejido tanto sano como enfermo. En contraposición, la CU (proctocolitis idiopática hemorrágica) está caracterizada por una inflamación simétrica -restringida a la mucosa y la submucosa -que asciende de forma ininterrumpida desde el recto hasta el colon.
La EC generalmente se diagnostica usando endoscopia GI superior o inferior y/o mediante examen con rayos X del intestino delgado, incluyendo el íleon. En la EC no se observa ninguna imagen endoscópica típica, mientras que en la CU el patrón típico detectado es una mucosa roja inflamada con sangrado. Las muestras de biopsias con EC revelan además inflamación transmural con linfocitos, macrófagos y células plasmáticas, mientras que es típica de la CU una inflamación de la mucosa/submucosa con granulocitos, eosinófilos y células plasmáticas. Cuando la inflamación se limita al colon, puede ser muy difícil diferenciar entre CU y CU restringida al colon (también conocida como colitis por EC).
El síndrome antifosfolipídico (SAP) está caracterizado por trombosis venosa o arterial, abortos recurrentes y trombocitopenia, que es un bajo número de plaquetas en sangre, lo que puede producir sangrado, que se observa como hematomas y pequeños puntos rojos sobre la piel. Los pacientes con SAP también pueden experimentar síntomas de derrame cerebral tales como ataques isquémicos transitorios (AIT).
El síndrome antifosfolipídico generalmente se diagnostica en base a estas manifestaciones clínicas y a los resultados de análisis clínicos. Se analiza una muestra de sangre en busca de la presencia de anticuerpos que reaccionan con las proteínas presentes de forma natural complejadas con fosfolípidos. Éstos se denominan anticuerpos antifosfolípidos o anticuerpos anticardiolipina (cardiolipina es un tipo de fosfolípido usado en análisis clínicos). A veces, estos anticuerpos se denominan anticoagulantes lúpicos cuando se usan ensayos de coagulación para su detección.
RESUMEN DE LA INVENCIÓN
La invención se basa, en parte, en el descubrimiento de que los pacientes con la enfermedad de Crohn (EC) o el síndrome antifosfolipídico (SAP) tienen elevados niveles en suero de determinados anticuerpos isotipos IgG, IgA e IgM específicos para determinadas estructuras de glicanos, en comparación con tales niveles en individuos sanos o en individuos con otros tipos de enfermedades gastrointestinales.
En concreto, la presente invención proporciona un procedimiento útil para diagnosticar la enfermedad de Crohn en un sujeto, comprendiendo el procedimiento
identificar, en una muestra para análisis de un sujeto con síntomas de la enfermedad de Crohn, un anticuerpo dirigido contra glicanos específico, en el que dicho anticuerpo dirigido contra glicanos específico es un anticuerpo anti-GlcNAc(β,1-4)GlcNAc(β) o un anticuerpo anti-Glc(β,1-3)Glc(β),
en el que la identificación de niveles elevados de dicho anticuerpo en dicha muestra para análisis respecto a una muestra de control indica que es probable que el sujeto padezca la enfermedad de Crohn.
Entre las ventajas de la revelación se encuentra un procedimiento de análisis serológico de elevada sensibilidad para distinguir sin duda la EC de otras enfermedades digestiva, incluso cuando la inflamación se limita al colon. Los ensayos de detección primaria de elevada sensibilidad de la descripción proporcionan a los médicos una forma barata de diferenciar rápidamente individuos con la EC de individuos no enfermos o individuos con CU o con el SII. Esto facilita una intervención terapéutica más temprana y adecuada y minimiza la incertidumbre de los pacientes y sus familias. Según un aspecto, la descripción proporciona un procedimiento de diagnóstico de la EC en un sujeto proporcionando una muestra para análisis del sujeto y detectando en la muestra para análisis al menos uno de los siguientes anticuerpos anti-glicanos: un anticuerpo anti-Glc(β), un anticuerpo anti-Glc(β,1-4)Glc(β), un anticuerpo anti-Glc(β,1-3)Glc(β), un anticuerpo anti-GlcNAc(β) 6-sulfato, un anticuerpo antidextrano, un anticuerpo anti-xilano, un anticuerpo anti-GlcNAc(β,1-4)GlcNAc(β), un anticuerpo anti-Gal 3-sulfato (β), un anticuerpo anti-GlcNAc(β,1-3)GalNAc(β), un anticuerpo anti-GlcNAc(β,13)Gal(β,1-4)Glc(β), un anticuerpo anti-Gal(α), un anticuerpo anti-Gal(β), un anticuerpo anti-GalNAc(α), un anticuerpo anti-Glc(α), un anticuerpo anti-Gal(β,1-6)Gal(β), o un anticuerpo anti-GlcNAc(β,16)GalNAc(α). La presencia de uno o más de los anticuerpos en la muestra para análisis identifica el sujeto como que padece la EC.
En algunas realizaciones, los niveles del anticuerpo o anticuerpos anti-glicanos en la muestra para análisis se comparan con los niveles de anticuerpos anti-glicanos en una muestra de control. La muestra de control se elige de un grupo que incluye uno o más individuos de los que se tiene conocimiento de que padecen o no un trastorno gastrointestinal, o de que padecen o no un trastorno gastrointestinal diferente a la EC. Cuando la muestra de control es de un individuo o individuos que no padecen la EC, o que padecen una enfermedad gastrointestinal diferente a la EC, los elevados niveles en la muestra para análisis respecto a la muestra de control identifican al sujeto como que padece la EC.
En algunas realizaciones, la muestra de control es de uno o más individuos con un trastorno gastrointestinal que es el síndrome del intestino irritable, colitis ulcerosa u otras enfermedades digestivas. En algunas realizaciones, la muestra de control es de uno o más individuos que no padecen un trastorno gastrointestinal.
En diversas realizaciones, se detectan al menos 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 o la totalidad de estos anticuerpos.
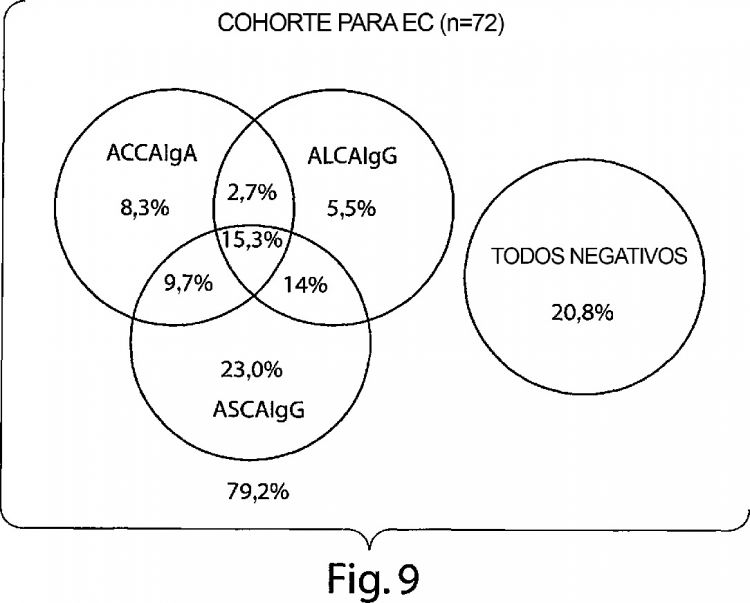
En algunas realizaciones, el procedimiento incluye además la determinación de si la muestra para análisis tiene un anticuerpo anti-manano, que también se conoce como un anticuerpo anti-Saccharomyces cerevisiae (ASCA). La presencia del anticuerpo anti-manano en la muestra identifica el sujeto como que padece la EC.
En algunas realizaciones, el procedimiento incluye además la determinación de si la muestra para análisis tiene anticuerpos anticitoplasmáticos de neutrófilos (ANCA). La presencia de ANCA indica que el sujeto no padece la EC, pero puede padecer colitis ulcerosa.
La muestra para...
Reivindicaciones:
1. Un procedimiento útil en el diagnóstico de la enfermedad de Crohn en un sujeto, comprendiendo el procedimiento identificar en una muestra para análisis de un sujeto con síntomas de la enfermedad de Crohn un anticuerpo dirigido contra glicanos específico, en el que dicho anticuerpo dirigido contra glicanos específico es un anticuerpo anti-GlcNAc(β,1-4)GlcNAc(β) o un anticuerpo antiGlc(β,1-3)Glc(β),
en el que la identificación de niveles elevados de dicho anticuerpo en dicha muestra para análisis respecto a una muestra de control indica que es probable que el sujeto padezca la enfermedad de Crohn.
2. El procedimiento de la reivindicación 1, en el que dicho procedimiento comprende además comparar los niveles de dicho anticuerpo dirigido contra glicanos específico en dicha muestra para análisis con los niveles de dicho anticuerpo dirigido contra glicanos específico en una muestra de control, en el que la muestra de control se selecciona del grupo constituido por uno o más individuos de los que se sabe que padecen o no padecen un trastorno gastrointestinal diferente a la enfermedad de Crohn.
3. El procedimiento de la reivindicación 2, en el que dicha muestra de control es de uno o más individuos con un trastorno gastrointestinal que es el síndrome del intestino irritable o colitis ulcerosa.
4. El procedimiento de la reivindicación 2, en el que dicha muestra de control es de uno o más individuos que no padecen un trastorno gastrointestinal.
5. El procedimiento de la reivindicación 1, que comprende además la determinación de si dicha muestra para análisis tiene un anticuerpo anti-manano (ASCA), en el que la evaluación del sujeto es que padece la enfermedad de Crohn si dicho anticuerpo anti-ASCA está presente en dicha muestra.
6. El procedimiento de la reivindicación 1, que comprende además la determinación de si dicha muestra para análisis tiene anticuerpos anticitoplasmáticos de neutrófilos (ANCA), en el que la evaluación del sujeto es que no padece la enfermedad de Crohn si dichos anticuerpos anticitoplasmáticos de neutrófilos (ANCA) están presentes en dicha muestra.
7. El procedimiento de la reivindicación 5, que comprende además la determinación de si dicha muestra para análisis tiene anticuerpos anticitoplasmáticos de neutrófilos (ANCA), en el que la evaluación del sujeto es que no padece la enfermedad de Crohn si dichos anticuerpos anticitoplasmáticos de neutrófilos (ANCA) están presentes en dicha muestra.
8. El procedimiento de la reivindicación 1, en el que dicho procedimiento comprende además identificar uno, dos o tres de un anticuerpo anti-Man(α,1-3) Man(α), un anticuerpo antiMan(α,1-3)[Man(α,1-6)]Man(α), un anti-Man(α,1-2)Man(α), un anti-Man(α,1-6)Man(α) o un anticuerpo anti-manano (ASCA) en dicha muestra.
9. El procedimiento de la reivindicación 1, en el que la muestra para análisis es un fluido biológico.
10. El procedimiento de la reivindicación 9, en el que dicho fluido biológico es sangre completa, suero, plasma, orina o saliva.
11. El procedimiento de la reivindicación 9, en el que dicho fluido biológico es suero.
12. El procedimiento de la reivindicación 1, que comprende además determinar el isotipo de dicho anticuerpo.
13. El procedimiento de la reivindicación 12, en el que dicho anticuerpo es un anticuerpo isotipo IgM.
14. El procedimiento de la reivindicación 12, en el que dicho anticuerpo es un anticuerpo isotipo IgA.
15. Los procedimientos de la reivindicación 12, en el que dicho anticuerpo es un anticuerpo isotipo IgG.
16. El procedimiento de la reivindicación 15, en el que dicho anticuerpo IgG es un anticuerpo antiGlc(β), un anticuerpo anti-Glc(β,1-3)Glc(β), un anticuerpo anti-Glc(β,1-4)Glc(β), un anticuerpo anti-GlcNAc(β) 6-sulfato o un anticuerpo anti-xilano.
17. El procedimiento de la reivindicación 1, en el que dicho anticuerpo dirigido contra glicanos se identifica con un anticuerpo fluorescente.
18. El procedimiento de la reivindicación 1, en el que dicho anticuerpo dirigido contra glicanos se identifica con un ensayo de inmunoabsorción ligado a enzimas (ELISA).
19. El procedimiento de la reivindicación 1, en el que dicho anticuerpo es un anticuerpo antiGlc(β,1-3)Glc(β).
20. El procedimiento de la reivindicación 19, en el que dicho procedimiento comprende la detección de un anticuerpo IgG anti-Glc(β,1-3)Glc(β) en dicha muestra.
21. El procedimiento de la reivindicación 20, en el que dicho procedimiento comprende además la identificación de un anticuerpo IgG anti-Man(α,1-3)Man(α) en dicha muestra.
22. El procedimiento de la reivindicación 19, en el que dicho procedimiento comprende además la 5 identificación de un anticuerpo IgG anti-Man(α,1-3)Man(α) en dicha muestra.
23. El procedimiento de la reivindicación 19, en el que dicho procedimiento comprende además la determinación de si dicha muestra tiene un anticuerpo IgG anti-manano o IgA anti-manano, en el que la evaluación de dicho sujeto es que padece la enfermedad de Crohn si dicho anticuerpo IgG anti-manano o IgA anti-manano está presente en dicha muestra.
24. El procedimiento de la reivindicación 23, en el que dicho procedimiento comprende la determinación de si dicha muestra tiene un anticuerpo IgG anti-manano.
15 25. El procedimiento de la reivindicación 23, en el que dicho procedimiento comprende la determinación de si dicha muestra tiene un anticuerpo IgA anti-manano.
26. El procedimiento de la reivindicación 23, en el que dicho procedimiento comprende además determinar si dicha muestra tiene anticuerpos anticitoplasmáticos de neutrófilos (ANCA), en el que la evaluación del sujeto es que padece la enfermedad de Crohn si dichos ANCA están ausentes en dicha muestra.
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Un sustrato para inmovilizar sustancias funcionales y un método para preparar las mismas, del 15 de Julio de 2020, de Temasek Polytechnic: Un sustrato sólido que tiene compuestos dispuestos sobre el mismo, en donde se inmoviliza una molécula funcional sobre los compuestos, teniendo cada compuesto una cadena que […]
Análisis biológico autónomo de alta densidad, del 1 de Julio de 2020, de BioFire Diagnostics, LLC: Recipiente para realizar reacciones de amplificación en un sistema cerrado que comprende una porción flexible que tiene una serie de blísteres […]
Chip de análisis y aparato de análisis de muestras, del 1 de Julio de 2020, de Takano Co., Ltd: Un chip de análisis que comprende: un sustrato conformado sustancialmente en forma de disco; un puerto de inyección formado […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Estructuras para controlar la interacción de luz con dispositivos microfluídicos, del 3 de Junio de 2020, de Opko Diagnostics, LLC: Un sistema de ensayo múltiplex que comprende: un artículo que soporta ensayos en fase sólida, comprendiendo dicho artículo un sustrato plano rígido y comprendiendo […]
Uso de un estándar para la detección de agregados de proteínas de una enfermedad por plegamiento incorrecto de proteínas, del 27 de Mayo de 2020, de FORSCHUNGSZENTRUM JULICH GMBH: Uso de un estándar, que comprende una nanopartícula inorgánica con un tamaño de 2 a 200 nm, en cuya superficie ya sea mediante i) ácido carboxílico-espaciador-maleimida […]