Procedimiento de tratamiento de trastornos hemorrágicos utilizando polisacáridos sufatados.
Uso de un polisacárido sulfatado no anticoagulante (PSNA) en la fabricación de una composición para tratar a unsujeto en necesidad de mejora en la coagulación sanguínea,
en el que dicho PSNA muestra una actividadanticoagulante en un ensayo de coagulación de tiempo de protrombina diluida (dPT) o tiempo de tromboplastinaparcial activada (aPTT) que no es más de un tercio de la actividad anticoagulante molar de la heparina nofraccionada, y además en el que el PSNA está seleccionado de fucoidán o un fragmento del mismo, N-acetilheparina(NAH), heparina N-acetil-des-O-sulfatada (NA-de-os-SH), heparina des-N-sulfatada (De-NSH), heparinades-N-sulfatada acetilada (De-NSAH), pentosano polisulfato (PPS), condroitín sulfato o dermatán sulfato.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/018669.
Solicitante: BAXTER INTERNATIONAL INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE BAXTER PARKWAY DEERFIELD, IL 60015 ESTADOS UNIDOS DE AMERICA.
Inventor/es: JOHNSON,KIRK W.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/727 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Heparina; Heparano.
- A61K31/737 A61K 31/00 […] › Polisacáridos sulfatados, p. ej. sulfato de condroitina, sulfato de dermatano (A61K 31/727 tiene prioridad).
- A61K38/48 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que actúan sobre enlaces peptídicos (3.4).
- A61K45/06 A61K […] › A61K 45/00 Preparaciones medicinales que contienen ingredientes activos no previstos en los grupos A61K 31/00 - A61K 41/00. › Mezclas de ingredientes activos sin caracterización química, p. ej. compuestos antiflojísticos y para el corazón.
PDF original: ES-2399277_T3.pdf
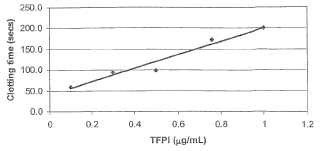
Fragmento de la descripción:
Procedimientos de tratamiento de trastornos hemorrágicos utilizando polisacáridos sulfatados
Campo técnico
La presente invención se refiere al tratamiento de trastornos hemorrágicos, incluyendo los trastornos de coagulación congénitos, los trastornos de coagulación adquiridos y los procesos hemorrágicos inducidos por traumatismos. En particular, la presente invención se refiere al uso de polisacáridos sulfatados no anticoagulantes (PSNA) para mejorar la coagulación y la hemostasia en procesos hemofílicos.
Antecedentes La coagulación normal de la sangre es un proceso fisiológico y bioquímico complejo que implica la activación de una cascada de factores de coagulación que conduce a la formación de fibrina y a la agregación plaquetaria a la vez que se produce vasoconstricción local (revisado por Davie y col., Biochemistr y 30: 10363, 1991) . La cascada de coagulación está compuesta por una ruta “extrínseca” que se piensa que es el medio principal por el que se inicia la coagulación normal y una ruta “intrínseca” que contribuye a la respuesta de coagulación expandida. La respuesta normal a una lesión sangrante implica la activación de la ruta extrínseca. La activación de la ruta extrínseca se inicia cuando la sangre entra en contacto con el factor tisular (TF) , un cofactor para el factor VII que se expone o expresa en los tejidos a continuación de la lesión. El TF forma un complejo con el FVII que facilita la producción de FVIIa. El FVIIa entonces se asocia con el TF para convertir el FX en la serín proteasa FXa, que es un componente crítico del complejo protrombinasa. La conversión de protrombina en trombina por el complejo FXa/FVa/calcio/fosfolípidos estimula la formación de fibrina y la activación de las plaquetas, todo lo cual es esencial para la coagulación normal de la sangre. La hemostasia normal se mejora además por los factores de la ruta intrínseca IXa y VIIIa, que también convierten el FX en FXa.
En los trastornos hemorrágicos la coagulación de la sangre es inadecuada, lo que puede estar causado por trastornos congénitos de la coagulación, trastornos adquiridos de la coagulación, o procesos hemorrágicos inducidos por un traumatismo. El sangrado es una de las manifestaciones más serias y significativas de enfermedad, y puede ocurrir en un sitio local o ser generalizado. El sangrado localizado puede asociarse con lesiones y puede complicarse adicionalmente por un defecto del mecanismo hemostático. Las deficiencias congénitas o adquiridas de cualquiera de los factores de coagulación se pueden asociar con una tendencia a la hemorragia. Los trastornos congénitos de la coagulación incluyen la hemofilia, un trastorno ligado al cromosoma X recesivo que implica una deficiencia del factor VIII de la coagulación (hemofilia A) o del factor IX (hemofilia B) y la enfermedad de von Willebrand, un trastorno hemorrágico raro que implica una severa deficiencia del factor de von Willebrand. Los trastornos de la coagulación adquiridos pueden aparecer en individuos sin una historia previa de sangrado como resultado del proceso de una enfermedad. Por ejemplo, los trastornos adquiridos de la coagulación pueden estar causados por inhibidores o autoinmunidad contra factores de coagulación de la sangre tales como el factor VIII, el factor de von Willebrand, los factores IX, V, XI, XII, y XIII; o por trastornos hemostáticos tales como los causados por enfermedades hepáticas, que pueden estar asociadas con el descenso de la síntesis de factores de coagulación. Las deficiencias de factores de coagulación se tratan típicamente por reemplazo de factores, lo que es caro, inconveniente (intravenoso) y no siempre eficaz. Hasta el 20% de los pacientes que reciben terapia crónica de reemplazo de factores puede generar anticuerpos que neutralizan los factores de reemplazo.
Por tanto, existe la necesidad de nuevas aproximaciones terapéuticas para tratar los trastornos hemorrágicos. Un único agente farmacéutico que sea seguro, conveniente y eficaz en un amplio número de trastornos de sangrado impactaría favorablemente en la práctica clínica.
Sumario de la invención La presente invención proporciona procedimientos y composiciones para mejorar la coagulación de la sangre y la inhibición de la actividad del TFPI con el uso de polisacáridos sulfatados no anticoagulantes (PSNA) como procoagulantes. Los PSNA pueden administrarse como agentes únicos, o en combinación con otro o con otros agentes hemostáticos. En particular, se describe el uso de PSNA en el tratamiento de trastornos hemorrágicos, incluyendo trastornos congénitos de la coagulación, trastornos adquiridos de la coagulación, y procesos hemorrágicos inducidos por traumatismos. En un aspecto, la invención proporciona un uso de un polisacárido sulfatado no anticoagulante (PSNA) en la fabricación de una composición para tratar a un sujeto que necesite una mejora de la coagulación sanguínea, en el que dicho PSNA presenta una actividad anticoagulante en un ensayo de coagulación de tiempo de protrombina diluida (dPT) o tiempo de tromboplastina parcial activada (aPTT) que no es más de un tercio de la actividad anticoagulante molar de heparina no fraccionada, y además en el que el PSNA se selecciona del fucoidán o un fragmento del mismo, la N-acetil-heparina (NAH) , heparina N-acetil-des-O-sulfatada (NA-de-os-SH) , heparina des-N-sulfatada (De-NSH) , heparina des-N-sulfatada-acetilada (De-NSAH) , pentosano polisulfato (PPS) , condroitín sulfato o dermatán sulfato.
En otras realizaciones, el PSNA puede estar coadministrado con uno o más PSNA diferentes y/o en combinación con uno o más de otros agentes terapéuticos.
En ciertas realizaciones, un PSNA se administra a un sujeto para tratar un trastorno hemorrágico seleccionado del grupo que consiste en hemofilia A, hemofilia B, enfermedad de von Willebrand, trombocitopenia idiopática, una deficiencia de uno o más factores de contacto, tales como el Factor XI, el Factor XII, precalicreína, y quininógeno de alto peso molecular (QAPM) , una deficiencia de uno o más factores asociados con sangrado clínicamente significativo, tales como el Factor V, Factor VII, Factor VIII, Factor IX, Factor X, Factor XIII, Factor II (hipoprotrombinemia) , y factor de von Willebrand, una deficiencia de vitamina K, un trastorno de fibrinógeno, incluyendo la afibrinogenemia, hipofibrinogenemia, y disfibrinogenemia, una deficiencia de alpha2-antiplasmina, un excesivo sangrado tal como el causado por enfermedad hepática, enfermedad renal, trombocitopenia, disfunción plaquetaria, hematomas, hemorragia interna, hemartrosis, cirugía, traumatismos, hipotermia, menstruación, y gestación.
En ciertas realizaciones, un PSNA se administra a un sujeto para tratar un trastorno congénito de la coagulación o un trastorno adquirido de la coagulación causados por una deficiencia de un factor sanguíneo. La deficiencia del factor sanguíneo puede estar causada por la deficiencia de uno o más factores, incluyendo, pero sin limitarse a estos, el factor V, el factor VII, el factor VIII, el factor IX, el factor XI, el factor XII, el factor XIII, y el factor de von Willebrand.
En ciertas realizaciones, al sujeto que tiene un trastorno hemorrágico se le administra una cantidad terapéuticamente eficaz de una composición que comprende un PSNA en combinación con otro agente terapéutico. Por ejemplo, al sujeto se le puede administrar una cantidad terapéuticamente eficaz de una composición que comprende un PSNA y uno o más de los factores seleccionados del grupo que consiste en el factor XI, factor XII, precalicreína, quininógeno de alto peso molecular (QAPM) , factor V, factor VII, factor VIII, factor IX, factor X, factor XIII, factor II, factor VIIa, y factor de von Willebrand. El tratamiento puede además comprender la administración de un procoagulante tal como la trombina; un activador de la ruta intrínseca de la coagulación, incluyendo el factor Xa, el factor IXa, el factor XIa, el factor XIIa, y VIIIa, la precalicreína, y el quininógeno de alto peso molecular; o un activador de la ruta extrínseca de la coagulación, incluyendo el factor tisular, el factor VIIa, el factor Va, y el factor Xa. Los agentes terapéuticos que se usan para tratar a un sujeto que tiene un trastorno hemorrágico pueden administrarse en la misma o en diferentes composiciones y a la vez, antes o después de la administración de un PSNA.
En otro aspecto, la invención proporciona el uso anterior para revertir los efectos de un anticoagulante en un sujeto, comprendiendo el procedimiento la administración al sujeto de una cantidad terapéuticamente eficaz de una composición que comprende un polisacárido sulfatado no anticoagulante (PSNA) . En ciertas realizaciones, el sujeto puede haber... [Seguir leyendo]
Reivindicaciones:
1. Uso de un polisacárido sulfatado no anticoagulante (PSNA) en la fabricación de una composición para tratar a un sujeto en necesidad de mejora en la coagulación sanguínea, en el que dicho PSNA muestra una actividad anticoagulante en un ensayo de coagulación de tiempo de protrombina diluida (dPT) o tiempo de tromboplastina parcial activada (aPTT) que no es más de un tercio de la actividad anticoagulante molar de la heparina no fraccionada, y además en el que el PSNA está seleccionado de fucoidán o un fragmento del mismo, N-acetilheparina (NAH) , heparina N-acetil-des-O-sulfatada (NA-de-os-SH) , heparina des-N-sulfatada (De-NSH) , heparina des-N-sulfatada acetilada (De-NSAH) , pentosano polisulfato (PPS) , condroitín sulfato o dermatán sulfato.
2. El uso de la reivindicación 1, en el que dicho PSNA es NAH.
3. El uso de la reivindicación 1, en el que dicho PSNA es PPS.
4. El uso de la reivindicación 1, en el que dicho PSNA es fucoidán.
5. El uso de una cualquiera de las reivindicaciones 1-4, en el que el PSNA se administra a una dosificación de aproximadamente 0, 01 mg/kg a aproximadamente 100 mg/kg.
6. El uso de las reivindicaciones precedentes, en el que el sujeto tiene un trastorno hemorrágico seleccionado del grupo que consiste en un trastorno hemorrágico agudo o crónico, un trastorno de la coagulación congénito causado por una deficiencia de factores sanguíneos, y un trastorno de la coagulación adquirido.
7. El uso de la reivindicación 6, en el que la deficiencia de factores sanguíneos es de uno o más factores seleccionados del grupo que consiste en factor V, factor VII, factor VIII, factor IX, factor XI, factor XII, factor XIII, y factor de von Willebrand.
8. El uso de la reivindicación 1, en el que la causa de la necesidad para mejorar la coagulación de la sangre es la administración previa de un anticoagulante o cirugía u otro procedimiento invasivo.
9. El uso de cualquiera de las reivindicaciones precedentes, en el que el sujeto se trata además mediante la administración de un agente seleccionado del grupo que consiste en un procoagulante, un activador de la ruta intrínseca de la coagulación, un activador de la ruta extrínseca de la coagulación, y un segundo PSNA.
10. El uso de la reivindicación 9, en el que el activador de la ruta intrínseca de la coagulación está seleccionado del grupo que consiste en factor Xa, factor IXa, factor XIa, factor XIIa, y VIIIa, precalicreína, y quininógeno de alto peso molecular.
11. El uso de la reivindicación 9, en el que el activador de la ruta extrínseca de la coagulación está seleccionado del grupo que consiste en factor tisular, factor VIIa, factor Va, y factor Xa.
12. El uso de una cualquiera de las reivindicaciones precedentes, en el que el sujeto además se trata por la administración de uno o más factores seleccionados del grupo que consiste en factor XI, factor XII, precalicreína, quininógeno de alto peso molecular (QAPM) , factor V, factor VII, factor VIII, factor IX, factor X, factor XIII, factor II, factor VIIa, y factor de von Willebrand.
13. El uso de la reivindicación 8, en el que el anticoagulante está seleccionado del grupo que consiste en la heparina, un derivado de la cumarina, tal como warfarina o dicumarol, inhibidor de la ruta del factor tisular (TFPI) , antitrombina III, anticoagulante lúpico, péptido anticoagulante de nematodo (NAPc2) , el factor VIIa bloqueado en el sitio activo (VIIai) , inhibidores del factor IXa, inhibidores del factor Xa, incluyendo el fondaparinux, idraparinux, DX9065a, y razaxabán (DPC906) , inhibidores de los factores Va y VIIIa, incluyendo la proteína C activada (APC) y trombomodulina soluble, inhibidores de la trombina, incluyendo la hirudina, bivalirudina, argatrobán, y ximelagatrán, y un anticuerpo que se une a un factor de coagulación.
14. El uso de la reivindicación 13, en el que el anticoagulante es un anticuerpo que se une a un factor de coagulación seleccionado del grupo que consiste en Factor V, Factor VII, Factor VIII, Factor IX, Factor X, Factor XIII, Factor II, Factor XI, Factor XII, factor de von Willebrand, precalicreína, y quininógeno de alto peso molecular (QAPM) .
15. Uso de un polisacárido sulfatado no anticoagulante (PSNA) para inhibir la actividad del TFPI en una muestra biológica, en el que dicho PSNA muestra actividad anticoagulante en el ensayo de coagulación de tiempo de protrombina diluida (dPT) o tiempo de tromboplastina parcial activada (aPTT) que no es más de un tercio de la actividad anticoagulante molar de la heparina no fraccionada, y además en el que el PSNA está seleccionado del fucoidán o un fragmento del mismo, N-acetil-heparina (NAH) , heparina N-acetil-des-O-sulfatada (NA-de-os-SH) , heparina des-N-sulfatada (De-NSH) , heparina des-N-sulfatada acetilada (De-NSAH) , pentosano polisulfato (PPS) , condroitín sulfato o dermatán sulfato.
16. Una composición inyectable para mejorar la coagulación de la sangre que comprende:
un polisacárido sulfatado no anticoagulante (PSNA) ; en el que dicho PSNA muestra actividad anticoagulante en un ensayo de coagulación de tiempo de protrombina diluida (dPT) o tiempo de tromboplastina parcial activada (aPTT) que no es más de un tercio de la actividad anticoagulante molar de la heparina no fraccionada, y además en el que el PSNA está seleccionado de fucoidán o un fragmento del mismo, N-acetil-heparina (NAH) , heparina N-acetil-des-O-sulfatada (NA-de-os-SH) , heparina des-N-sulfatada (De-NSH) , heparina des-N-sulfatada acetilada (De-NSAH) , pentosano polisulfato (PPS) , condroitín sulfato o dermatán sulfato; un excipiente farmacéuticamente aceptable; y uno o más factores seleccionados del grupo que consiste en factor XI, factor XII, precalicreína, quininógeno de alto peso molecular (QAPM) , factor V, factor VII, factor VIII, factor IX, factor X, factor XIII, factor II, y factor de von Willebrand, factor tisular, factor VIIa, factor Va, y factor Xa, factor IXa, factor XIa, factor XIIa, y VIIIa.
17. La composición inyectable de la reivindicación 16, que está seleccionada del grupo
- polvos o liofilizados que pueden reconstituirse con un disolvente antes de su uso, -soluciones o suspensiones listas para inyección, -composiciones secas insolubles para su combinación con un vehículo antes de su uso, -y emulsiones y concentrados líquidos para su dilución antes de la administración.
18. El uso de la reivindicación 1, en el que se administra una cantidad terapéuticamente eficaz de dicha composición.
19. Un procedimiento in vitro de inhibición de la actividad del TFPI en una muestra biológica, comprendiendo el procedimiento la combinación de la muestra biológica con una cantidad suficiente de un polisacárido sulfatado no anticoagulante (PSNA) para inhibir dicha actividad de TFPI, en el que dicho PSNA muestra una actividad anticoagulante en un ensayo de coagulación de tiempo de protrombina diluida (dPT) o tiempo de tromboplastina parcial activada (aPTT) que no es más de un tercio de la actividad anticoagulante molar de la heparina no fraccionada, y además en el que el PSNA está seleccionado de fucoidán o un fragmento del mismo, N-acetilheparina (NAH) , heparina N-acetil-des-O-sulfatada (NA-de-os-SH) , heparina des-N-sulfatada (De-NSH) , heparina des-N-sulfatada acetilada (De-NSAH) , pentosano polisulfato (PPS) , condroitín sulfato o dermatán sulfato.
20. Un procedimiento in vitro de medición de la aceleración de la coagulación sanguínea por un polisacárido sulfatado no anticoagulante (PSNA) en una muestra biológica, comprendiendo el procedimiento:
a) combinar la muestra biológica con una composición que comprende dicho PSNA, en el que dicho PSNA muestra una actividad anticoagulante en un ensayo de coagulación de tiempo de protrombina diluida (dPT) o tiempo de tromboplastina parcial activada (aPTT) que no es más de un tercio de la actividad anticoagulante molar de la heparina no fraccionada, y además en el que el PSNA está seleccionado de fucoidán o un fragmento del mismo, N-acetil-heparina (NAH) , heparina N-acetil-des-O-sulfatada (NA-de-os-SH) , heparina des-N-sulfatada (De-NSH) , heparina des-N-sulfatada acetilada (De-NSAH) , pentosano polisulfato (PPS) , condroitín sulfato o dermatán sulfato. b) medir el tiempo de coagulación de dicha muestra biológica, c) comparar el tiempo de coagulación de dicha muestra biológica con el tiempo de coagulación de una muestra biológica correspondiente no expuesta al PSNA, en el que el descenso en el tiempo de coagulación de la muestra biológica expuesta al PSNA es indicativo de un PSNA que acelera el tiempo de coagulación.
21. Una composición inyectable de acuerdo con cualquiera de las reivindicaciones 16 o 17, en la que la composición está formulada para inyección intravenosa.
22. Una composición para mejorar la coagulación de la sangre que comprende:
un polisacárido sulfatado no anticoagulante (PSNA) ; en el que dicho PSNA muestra una actividad anticoagulante en un ensayo de coagulación de tiempo de protrombina diluida (dPT) o tiempo de tromboplastina parcial activada (aPTT) que no es más de un tercio de la actividad anticoagulante molar de la heparina no fraccionada, y además en el que el PSNA está seleccionado de fucoidán o un fragmento del mismo, N-acetil-heparina (NAH) , heparina N-acetil-des-O-sulfatada (NA-de-os-SH) , heparina des-N-sulfatada (De-NSH) , heparina des-N-sulfatada acetilada (De-NSAH) , o pentosano polisulfato (PPS) , un excipiente farmacéuticamente aceptable; y uno o más factores seleccionados del grupo que consiste en factor XI, factor XII, precalicreína, quininógeno de alto peso molecular (QAPM) , factor V, factor VII, factor VIII, factor IX, factor X, factor XIII, factor II, y factor de von Willebrand, factor tisular, factor VIIa, factor Va, y factor Xa, factor IXa, factor XIa, factor XIIa, y VIIIa.
Patentes similares o relacionadas:
Preparaciones de hidrogel térmico reversible para su uso en el tratamiento de trastornos del urotelio, del 15 de Julio de 2020, de UroGen Pharma Ltd: Una composición de hidrogel termorreversible mucoadhesiva biocompatible que incorpora toxina botulínica y que comprende al menos un agente de gelificación […]
Formulaciones de productos biológicos para instilación intravesical, del 1 de Julio de 2020, de ALLERGAN, INC.: Composición farmacéutica que comprende una cantidad terapéuticamente eficaz de un derivado de Clostridium y al menos un agente de permeabilización, en la que […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Antídotos para inhibidores del factor Xa y procedimientos de uso de los mismos, del 24 de Junio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una composición farmacéutica que comprende un transportador y un polipéptido para uso en terapia donde el polipéptido comprende una secuencia de aminoácidos que tiene […]
Compuestos para el tratamiento de Trastornos Neuropsiquiátricos, del 24 de Junio de 2020, de Curemark LLC: Una composición que comprende enzimas digestivas para uso en el tratamiento del Trastorno Esquizofreniforme, en donde las enzimas digestivas comprenden amilasa, lipasa […]
Proteínas prohemostáticas para el tratamiento del sangrado, del 3 de Junio de 2020, de ACADEMISCH ZIEKENHUIS LEIDEN: Una proteína recombinante que comprende un polipéptido del factor Xa de coagulación de mamífero, teniendo dicho polipéptido una alteración en la región de los […]
Preparación liofilizada de toxina botulínica, del 20 de Mayo de 2020, de Medy-Tox, INC. (100.0%): Preparación liofilizada farmacéutica que comprende: toxina botulínica, polisorbato y metionina; y uno o más componentes seleccionados del grupo que consiste en azúcar, […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]