VEHÍCULOS PARA LA ADMINISTRACIÓN DE FARMACOS BASADOS EN MATERIALES DE FASE LÍQUIDO-CRISTALINA INVERSA.
Partícula cargada de manera iónica, no recubierta estabilizada de un material de fase cúbica inversa o fase hexagonal inversa,
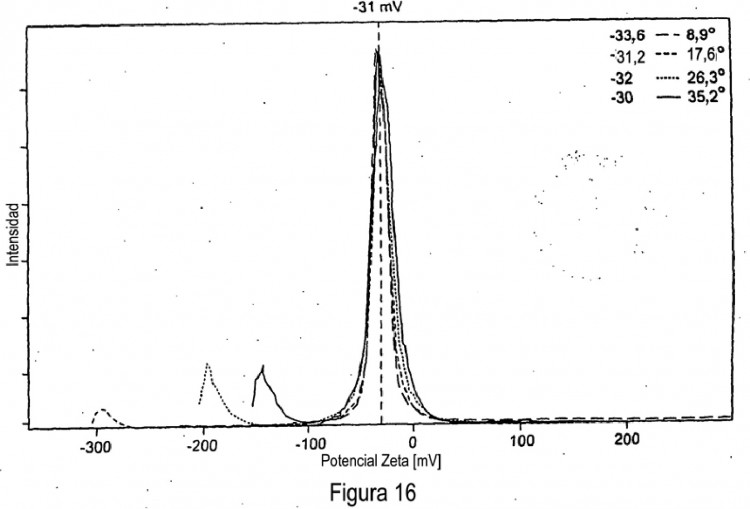
mediante lo cual dicha partícula tiene un potencial zeta de 25 mV o < - 25 mV
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/033193.
Solicitante: LYOTROPIC THERAPEUTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 10487 LAKERIDGE PARKWAY 400 ASHLAND, VA 23005 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ANDERSON, DAVID, M., CAMERANSI,Benjamin,G. Jr.
Fecha de Publicación: .
Fecha Solicitud PCT: 8 de Octubre de 2004.
Clasificación PCT:
- A61K9/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › en estado especial, p. ej. polvos (microcápsulas A61K 9/50).
- C09K19/06 QUIMICA; METALURGIA. › C09 COLORANTES; PINTURAS; PULIMENTOS; RESINAS NATURALES; ADHESIVOS; COMPOSICIONES NO PREVISTAS EN OTRO LUGAR; APLICACIONES DE LOS MATERIALES NO PREVISTAS EN OTRO LUGAR. › C09K SUSTANCIAS PARA APLICACIONES NO PREVISTAS EN OTRO LUGAR; APLICACIONES DE SUSTANCIAS NO PREVISTAS EN OTRO LUGAR. › C09K 19/00 Sustancias que forman cristales líquidos. › Compuestos no esteroides que forman cristales líquidos.
Clasificación antigua:
- A61K6/00 A61K […] › Preparaciones para técnica dental.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357580_T3.pdf




Fragmento de la descripción:
ANTECEDENTES DE LA INVENCIÓN
Campo de la invención
La invención se refiere generalmente a partículas no recubiertas de material de fase cúbica inversa o fase 5 hexagonal inversa que contienen un agente activo. En particular, la invención proporciona partículas no recubiertas que tienen una carga iónica que es suficiente para estabilizar las partículas en dispersión en un líquido, por ejemplo un disolvente polar. La invención también contempla formulaciones de fármacos que contienen fases hexagonal inversa y cúbica inversa que pueden aplicarse para aumentar significativamente la duración de acción farmacológica y/o proporcionar la misma duración y eficacia a una dosis significativamente inferior. 10
Antecedentes de la invención
Muchos compuestos activos usados en usos farmacéuticos, nutricionales, nutricéuticos, medioambientales e industriales son o bien insolubles en agua, o bien responden mejor cuando se administran en alguna clase de matriz protectora, direccionable y/o de otro modo funcional. En el caso de los productos farmacéuticos, se reconoce generalmente que las micropartículas pueden proporcionar matrices robustas para fármacos mediante diversas vías de 15 administración, siempre que sean del tamaño apropiado, estables en dispersión y estén compuestas por excipientes que son aceptables para esa vía. Sin embargo, además de solubilizar y/o proteger el compuesto activo para su administración y/o en circulación, sería ventajoso que una micropartícula desempeñase un papel activo en la administración y la absorción del agente activo, un objetivo que ha sido un impedimento para varios vehículos particulados y basados en gotas potencialmente útiles. 20
Para el caso de los agentes activos farmacéuticos que son de baja solubilidad en agua, la solubilización de compuestos de fármacos de este tipo se convierte en un reto por la selección muy limitada de disolventes y líquidos estructurados que están aprobados por organismos reguladores para su uso a los niveles que se requerirían para solubilizar el fármaco. Además, los excipientes líquidos miscibles en agua, más particularmente etanol, son de valor limitado dado que, incluso cuando el fármaco es insoluble en etanol puro, por ejemplo, a menudo precipitará tras el 25 contacto con el agua, tal como con o bien agua para inyección como diluyente o bien en el medio acuoso de líquidos corporales, tales como la sangre.
Se han desarrollado fases líquido-cristalinas liotrópicas nanoestructuradas de las fases cúbica inversa y hexagonal inversa concretamente de tipo inverso, como matrices de solubilización excelentes tanto para compuestos escasamente solubles, como para compuestos delicados de este tipo tales como proteínas y otras biomacromoléculas. 30 El documento U.S. 6.482.517 (Anderson, 19 de noviembre de 2002) y el documento U.S. 6.638.621 (Anderson, 28 de octubre de 2003), cuyo contenido se incorpora en su totalidad como referencia, dan a conocer, entre otras cosas, composiciones y métodos eficaces para producir matrices líquido-cristalinas liotrópicas de este tipo. Estas partículas se recubren con materiales sólidos.
Un pionero en el comportamiento de fases de tensioactivos, P.A. Winsor, describió partículas de fase cúbica 35 recubiertas con una fase líquida nanoestructurada, que según el conocimiento actual era probablemente una fase L3. Véase Liquid Crystals & Plastic Crystals, Vol. 1, ediciones G.W. Gray y P.A. Winsor (1974), Ellis Horwood Ltd., página 224, así como Balinov, Olsson y Soderman (1991) J. Phys. Chem. 95:5931. Larsson, en 1989, describió partículas de fase cúbica inversas con recubrimientos de fase líquido-cristalina laminar. Véase Larsson (1989) J. Phys. Chem. 93(21) 7304. 40
El documento U.S. 5.531.925 (Landh et al., 2 de julio de 1996) describe asimismo partículas de fase cúbica inversa o fase hexagonal inversa que requieren una fase superficial de o bien fase líquido-cristalina laminar, cristalina laminar, o bien L3, con el fin de dispersar las partículas. El recubrimiento se denomina en esta descripción “fase superficial”, o “fase dispersable”, enseñando de ese modo, en primer lugar, que es una fase separada, distinta del interior líquido-cristalino inverso, y en segundo lugar, que el propio interior de la fase líquido-cristalina inversa no es una 45 fase dispersable. La fase superficial L3 en esta descripción se describe como que se “anclaje a la bicapa o monocapa de la fase interior” (columna 7, líneas 59-60).
La patente estadounidense 6.071.524 describe composiciones en forma de dispersiones que contienen: (a) del 60 al 98% en peso de una fase acuosa y (b) del 2 al 40% en peso de una fase oleosa dispersa en la fase acuosa, dispersándose y estabilizándose la fase oleosa usando partículas de gel cúbicas. Las partículas están formadas 50 esencialmente por del 0,1 al 15% en peso (en relación con el peso total de la composición) de al menos un monoglicérido de ácido graso insaturado que tiene una cadena grasa insaturada C16-C22 en mezcla con fitanetriol, y del 0,05 al 3% en peso en relación con el peso total de la composición de un agente dispersante y estabilizante. El agente es una sustancia activa en superficie, soluble en agua a temperatura ambiente, que contiene una cadena grasa, saturada o insaturada, lineal o ramificada que tiene de 8 a 22 átomos de carbono. La patente también describe métodos 55 de preparación de composiciones de este tipo. Un mínimo de tres fases termodinámicamente distintas están presentes en una mezcla de este tipo, concretamente la fase exterior acuosa, las partículas de gel cúbicas y la fase oleosa que
contiene el agente activo. El principio activo (fármaco, compuesto cosmecéutico, etc.) está presente en la fase oleosa dispersa, y de hecho ubicado sustancialmente en la fase oleosa. Sistemas de este tipo, emulsiones en las que monocapas de lípido o tensioactivo, múltiples capas, dominios cristalinos líquido laminares o no laminares o dominios cristalinos laminares estabilizan las gotas de un fluido en otro, presentan escasa idoneidad para el direccionamiento, limitaciones del término de caducidad (flotación, ruptura de las emulsiones, etc.), y otros problemas bien conocidos en la 5 técnica de emulsiones. Y sistemas de emulsiones o gotas en los que cada gota está rodeada por una pluralidad de partículas de otro material o fase, que experimentan todas difusión independiente alrededor de la gota (y, por definición, están separadas unas de otras por capas de fluido intermedias), presentan espacios entre las partículas que comprometen la capacidad del material para controlar la salida del agente activo hacia fuera, o la entrada de factores de confusión al interior de la gota. Además, con un sistema de este tipo en el que la pluralidad de partículas que rodean la 10 gota se deriva de cristales líquidos liotrópicos, tal como en el documento U.S. 6.071.524, en el organismo de un animal estas partículas pueden volverse fácilmente independientes de las gotas, de manera que las gotas, que contienen la amplia mayoría del agente activo, no obtengan los beneficios potenciales (tal como se tratan en el presente documento) de las partículas líquido-cristalinas. Aunque las “partículas de gel cúbicas” del documento 6.071.524 se diseñan para agregarse en la superficie de las gotas de aceite, en una aplicación farmacéutica, los factores de dilución y las fuerzas 15 de cizallamiento, junto con la pluralidad de condiciones y procesos bioquímicos con que se encuentra una gota, podrían separar fácilmente las gotas de su recubrimiento destinado. Otra limitación de la invención descrita en el documento 6.071.524 es que ni los monoglicéridos ni el fitanetriol (ni muchos de los otros tensioactivos usados en las realizaciones notificadas) están aprobados para su uso en productos farmacéuticos inyectables, y en efecto se sabe que los monoglicéridos son extremadamente tóxicos tras su inyección. 20
La solicitud estadounidense 2002/0153509 (Lynch et al., publicada el 24 de octubre de 2002) describe composiciones en las que se usan compuestos cargados como “anclajes” (“enlaces”), que sirven para anclar los compuestos activos o compuestos de direccionamiento a fases cúbicas, algunas veces en material particulado para. Por ejemplo, se afirma en la descripción del documento 2002/0153509 que la inclusión de un anclaje tal como un tensioactivo catiónico podría aumentar la cantidad del fármaco activo en la fase cúbica en proporción a la cantidad de 25 tensioactivo (por ejemplo, párrafo 0099), según la... [Seguir leyendo]
Reivindicaciones:
1. Partícula cargada de manera iónica, no recubierta estabilizada de un material de fase cúbica inversa o fase hexagonal inversa, mediante lo cual dicha partícula tiene un potencial zeta de 25 mV o < - 25 mV.
2. Partícula cargada de manera iónica, no recubierta de un material de fase cúbica inversa o fase hexagonal inversa según la reivindicación 1, en la que dicho material de fase cúbica inversa o fase hexagonal inversa está 5 formado por al menos un componente activo y al menos un segundo componente, en la que al menos uno del grupo que consiste en
(i) dicho al menos un componente activo, y
(ii) dicho al menos un segundo componente
tiene una carga catiónica o aniónica. 10
3. Composición que comprende una partícula cargada de manera iónica, no recubierta de un material de fase cúbica inversa o fase hexagonal inversa y un líquido que comprende un disolvente polar, estabilizándose dicha partícula cargada de manera iónica, no recubierta en dispersión en dicho líquido mediante lo cual dicha partícula tiene un potencial zeta de 25 mV o < - 25 mV.
4. Composición según la reivindicación 3, que comprende: 15
una partícula cargada de manera iónica, no recubierta de un material de fase cúbica inversa o fase hexagonal inversa en la que dicho material de fase cúbica inversa o fase hexagonal inversa está formado por al menos un componente activo y al menos un segundo componente, en la que al menos uno del grupo que consiste en
(i) dicho al menos un componente activo, y
(ii) dicho al menos un segundo componente 20
tiene una carga catiónica o aniónica; y
un líquido que comprende un disolvente polar, estabilizándose dicha partícula cargada de manera iónica, no recubierta en dispersión en dicho líquido.
5. Partícula o composición según una cualquiera de las reivindicaciones anteriores, mediante lo cual dicha partícula tiene un potencial zeta de > 30 mV o < - 30 mV. 25
6. Partícula o composición según las reivindicaciones 1–5, en la que la carga iónica de dicha partícula se debe a la presencia de al menos un compuesto asociado a bicapa, cargado.
7. Partícula o composición según la reivindicación 6, en la que el compuesto asociado a bicapa, cargado se selecciona del grupo que consiste en albúmina, caseína, estearilamina, succinato de tocoferol, azul de metileno, monoesterato de aluminio, sal de ácido glicocólico, sal de ácido desoxicólico, sal de ácido 2-30 etilhexanoico, sal de riboflavina, sal de fosfato de riboflavina, dodecilsulfato de sodio, cloruro de benzalconio, cloruro de bencetonio, sal de N-acetiltriptófano, sal de triptófano, sal de tirosina, sal de fenilalanina, sal de oxiquinolina y sal de docusato.
8. Partícula o composición según la reivindicación 6, en la que la razón en peso del compuesto asociado a bicapa, cargado con respecto al material de fase cúbica inversa o fase hexagonal inversa es de entre 0,01:1 y 35 0,15:1.
9. Partícula o composición según una cualquiera de las reivindicaciones anteriores, en la que la razón en peso del compuesto asociado a bicapa cargado con respecto al material de fase cúbica inversa o hexagonal inversa es de entre 0,02:1 y 0,08:1.
10. Partícula o composición según las reivindicaciones 1 a 5, en la que el agente activo es un compuesto 40 farmacéutico o nutricéutico.
11. Partícula o composición según la reivindicación 10, en la que el compuesto farmacéutico se elige del grupo que consiste en anestésicos generales, anestésicos locales, compuestos anticancerígenos, relajantes musculares, hipnóticos, sedantes, analgésicos, antipiréticos, antiinflamatorios no esteroideos, esteroides, antiinflamatorios esteroideos, opiáceos, cannabinoides, antibióticos y proteínas. 45
12. Partícula o composición según la reivindicación 11, en la que el anestésico general se selecciona del grupo que consiste en propofol, eugenol, alfaxalona, alfadolona, eltanolona, propanidid, ketamina, etomidato y pregnanolona.
13. Partícula o composición según la reivindicación 12, en la que dicho agente activo es propofol.
14. Partícula o composición según la reivindicación 12, en la que dicho agente activo es etomidato.
15. Partícula o composición según la reivindicación 11, en la que dicho anestésico local se selecciona del grupo que consiste en bupivacaína, lidocaína, procaína, tetracaína, mepivacaína, etidocaína, ropivacaína, cloroprocaína, cocaína, benzocaína, pramoxina, prilocaína, proparacaína, dibucaína y oxibuprocaína. 5
16. Partícula o composición según la reivindicación 15, en la que dicho anestésico local es bupivacaína.
17. Partícula o composición según las reivindicaciones 1 a 4, en la que la carga iónica de dicha partícula es catiónica y el potencial zeta de dicha partícula no recubierta es más positivo que +25 milivoltios.
18. Partícula o composición según las reivindicaciones 1 a 4, en la que la carga iónica de dicha partícula es aniónica y dicho potencial zeta es más negativo que -25 milivoltios. 10
19. Partícula o composición según las reivindicaciones 1 a 5, en la que el agente activo es un compuesto nutricéutico.
20. Partícula o composición según las reivindicaciones 1 a 5, que comprende además un diluyente de alto coeficiente de reparto en dichas partículas no recubiertas.
21. Partícula o composición según la reivindicación 20, en la que dicho diluyente de alto coeficiente de reparto es 15 la vitamina E.
22. Partícula o composición según las reivindicaciones 1 a 5, en la que dicho material de fase cúbica inversa o fase hexagonal inversa comprende un tensioactivo o lípido.
23. Partícula o composición según la reivindicación 22, en la que dicho tensioactivo se selecciona del grupo que consiste en fosfatidilcolina, fosfatidiletanolamina, Arlatone G, Tween 85, monooleato de glicerol, monoglicéridos 20 insaturados de cadena larga, monooleato de sorbitano, docusato de calcio, Pluronics con menos de aproximadamente el 30% de grupos PEO en peso, Pluronic L122, Pluronic 123 y Pluronic L101.
24. Partícula o composición según las reivindicaciones 1 a 5, en la que dicho material de fase cúbica inversa o fase hexagonal inversa comprende fosfatidilcolina y uno o más de fosfatidilglicerol, fosfatidilinositol, ácido fosfatídico y fosfatidilserina. 25
25. Partícula o composición según las reivindicaciones 1 a 5, en la que dicha partícula, composición o material es farmacéuticamente aceptable para inyección.
26. Partícula o composición según las reivindicaciones 1 a 5, en la que dicha partícula, composición o material es farmacéuticamente aceptable para su aplicación tópica o intraocular.
27. Partícula o composición según la reivindicación 6, mediante lo cual el compuesto asociado a bicapa, cargado 30 se selecciona de ácido desoxicólico y colatos relacionados, y ácido glicocólico y colatos relacionados.
28. Partícula o composición según una cualquiera de las reivindicaciones anteriores, que comprende además un aminoácido soluble zwitteriónico en una cantidad suficiente para ajustar la tonicidad, preferiblemente glicina, valina o prolina.
29. Uso de una partícula, composición o material según una cualquiera de las reivindicaciones 1 a 5, para la 35 preparación de un producto farmacéutico.
30. Formulación farmacéuticamente aceptable que comprende una composición o partícula de fase líquido-cristalina liotrópica cúbica inversa o hexagonal inversa según una cualquiera de las reivindicaciones 1 a 5, o una combinación de las mismas, y uno o más agentes farmacológicos en asociación con dicho material de fase líquido-cristalina liotrópica cúbica inversa o hexagonal inversa o combinación del mismo, que tiene una 40 duración de acción aumentada de una dosis dada de dicho uno o más agentes farmacológicos en relación con la duración de acción de dicha dosis dada de dicho uno o más agentes farmacológicos en ausencia de dicha formulación farmacéuticamente aceptable, en un factor de amplificación, calculado como una duración relativa dividida entre una dosis relativa del 100%, igual o superior a 2.
31. Formulación farmacéuticamente aceptable que comprende la composición o partícula de fase líquido-cristalina 45 liotrópica cúbica inversa o hexagonal inversa según una cualquiera de las reivindicaciones 1 a 5, o una combinación de las mismas, y uno o más agentes farmacológicos en asociación con dicho material de fase líquido-cristalina liotrópica cúbica inversa o hexagonal inversa o combinación del mismo, que tiene una dosis disminuida de dicho uno o más agentes farmacológicos que provocan una determinada duración de acción en relación con una dosis de dicho uno o más agentes farmacológicos que provocan dicha determinada duración 50
de acción en ausencia de dicha formulación farmacéuticamente aceptable, en un factor de amplificación, calculada como una duración relativa dividida entre una dosis relativa, igual o superior a 2.
32. Formulación farmacéuticamente aceptable según las reivindicaciones 30 ó 31, en la que el factor de amplificación es igual o superior a 4.
33. Formulación farmacéuticamente aceptable según las reivindicaciones 30 a 31, en la que la formulación está en 5 forma de una suspensión de partículas compuestas por material líquido-cristalino liotrópico cúbico inverso o hexagonal inverso o una combinación del mismo.
34. Formulación farmacéuticamente aceptable según las reivindicaciones 30 a 33, en la que uno de dicho uno o más agentes farmacológicos es un anestésico local.
35. Formulación farmacéuticamente aceptable según la reivindicación 34, en la que el anestésico local es 10 bupivacaína.
Patentes similares o relacionadas:
Métodos y composiciones para la administración oral de proteínas, del 22 de Julio de 2020, de Entera Bio Ltd: Una única composición farmacéutica oral que comprende una proteína que tiene un peso molecular de hasta 100.000 Daltons, siendo dicha proteína PTH; […]
Composiciones bucales antimicrobianas basadas en sílice, del 1 de Julio de 2020, de Evonik Operations GmbH: Una composición bucal que comprende: (i) un vehículo; (ii) de 0,02 a 2 % p. de un compuesto antimicrobiano catiónico; y (iii) de 0,1 a 4,5 % p. de […]
Granulados secos de polvos de sílice mesoporosa, del 1 de Julio de 2020, de FORMAC PHARMACEUTICALS N.V: Un granulado seco que comprende desde el 50% al 100% p/p de sílice mesoporosa ordenada que tiene una organización bidimensional hexagonalmente […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Composición farmacéutica que comprende partículas de quelante de fosfato, del 3 de Junio de 2020, de Vifor Fresenius Medical Care Renal Pharma, Ltd: Una composición farmacéutica para administración oral, que comprende un quelante de fosfato, donde dicho quelante de fosfato comprende partículas que tienen una distribución […]
Formulaciones de ganaxolona y procedimientos para la preparación y uso de las mismas, del 3 de Junio de 2020, de Marinus Pharmaceuticals, Inc: Una composición que comprende partículas que comprenden ganaxolona; un polímero hidrófilo; un agente humectante; y un agente complejante, en la que el diámetro medio ponderado […]
Procedimiento de estabilización de tamaño de partícula, del 27 de Mayo de 2020, de INKE, S.A.: Un procedimiento para obtener una sal de glicopirronio estable que comprende las siguientes etapas: a) micronizar la sal de bromuro de glicopirronio, opcionalmente […]
Formulaciones de {2-[(1S)-1-(3-etoxi-4-metoxi-fenil)-2-metanosulfonil-etil]-3-oxo-2,3-dihidro-1H-isoindol-4-il}-amida del ácido ciclopropanocarboxílico, del 20 de Mayo de 2020, de Amgen (Europe) GmbH: Una forma de dosificación oral que comprende: 1) una dispersión sólida amorfa de un compuesto de fórmula (I): **(Ver fórmula)** o una sal farmacéuticamente […]