UN VECTOR HÍBRIDO ADENOVIRUS-ALFAVIRUS PARA LA ADMINISTRACIÓN EFICAZ Y EXPRESIÓN DE GENES TERAPÉUTICOS EN CÉLULAS TUMORALES.
La presente invención se refiere a un vector híbrido adenoviral de expresión génica caracterizado porque comprende,
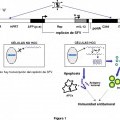
orientados en dirección 5'' a 3'', al menos los siguientes elementos: i. una primera cadena de origen adenoviral que comprende una primera secuencia terminal invertida repetida (ITR) y una secuencia señal para el empaquetamiento del adenovirus; ii. una primera secuencia no codificante de relleno; iii. una secuencia correspondiente a un promotor específico de tejido; iv. una cadena de ADNc derivada de un alfavirus, cuya secuencia es en parte complementaria de un ARN alfaviral, que comprende al menos una secuencia codificante de al menos un gen exógeno de interés, v. una secuencia de poliadenilación, y vi. una segunda secuencia terminal invertida repetida (ITR) adenoviral; preferentemente se refiere a un vector híbrido adenoviral que comprende como gen exógeno de interés el gen terapéutico interleucina de mamífero IL-12, y más preferentemente aún, interleucina humana hIL-12; así como al uso del vector híbrido en un procedimiento para transferir material genético a una célula, especialmente una célula tumoral y preferentemente que expresa AFP, y a su uso para inducir una respuesta inmune contra antígenos extraños
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/ES2005/000277.
Solicitante: PROYECTO DE BIOMEDICINA CIMA, S.L..
Nacionalidad solicitante: España.
Provincia: NAVARRA.
Inventor/es: QIAN,CHENG, PRIETO VALTUEÑA, JESUS, SMERDOU PICAZO, CRISTIAN, GUAN,MIN.
Fecha de Publicación: .
Fecha Solicitud PCT: 18 de Mayo de 2005.
Clasificación Internacional de Patentes:
- A61K38/20M
- A61K48/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/86 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Vectores virales.
- C12N15/861 C12N 15/00 […] › Vectores adenovirales.
Clasificación PCT:
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/86 C12N 15/00 […] › Vectores virales.
- C12N15/861 C12N 15/00 […] › Vectores adenovirales.
Clasificación antigua:
- A61K48/00 A61K […] › Preparaciones medicinales que contienen material genético que se introduce en las células del cuerpo vivo para tratar enfermedades genéticas; Terapia génica.
- C12N15/86 C12N 15/00 […] › Vectores virales.
- C12N15/861 C12N 15/00 […] › Vectores adenovirales.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2356322_T3.pdf

Fragmento de la descripción:
CAMPO TÉCNICO DE LA INVENCIÓN
La presente invención se refiere a vectores de expresión génica derivados de adenovirus, para la obtención de 5 productos terapéuticos.
ESTADO DE LA TÉCNICA ANTERIOR A LA INVENCIÓN
Uno de los principales problemas de la terapia convencional del cáncer es la falta de especificidad tumoral, lo que causa con frecuencia serios efectos secundarios y limita la dosis terapéutica. Aunque la terapia génica se mantiene como una promesa de gran potencial para la terapia del cáncer, también se enfrenta a un problema específico: dirigir la 10 expresión transgénica al sitio del tumor. Varios estudios sugieren que cuando los vectores virales se administran de manera intralesional, aunque la expresión transgénica está esencialmente confinada a un área adyacente al tracto de la aguja, también puede ocurrir en otros tejidos. Por lo tanto un objetivo importante en la terapia génica del cáncer es dirigir la expresión de los genes terapéuticos a los tumores a través de la administración específica al tejido neoplásico ("objetivo tejido") y/o activación específica ("objetivo transcripcional") en el tejido neoplásico, sin afectar a las células 15 sanas. El "objetivo tejido" se puede conseguir creando un vector dirigido mediante modificaciones de las interacciones receptor-ligando, permitiendo la infección de las células que expresan un receptor específico. El objetivo transcripcional se puede conseguir usando un promotor específico de tumor para controlar la expresión transgénica. Se han usado en estudios previos, distintos promotores específicos de tumores. Sin embargo tienen una limitación esencial, qué es que no conducen a un nivel elevado de expresión génica, y por tanto limitan la actividad antitumoral. 20
Una revisión de los últimos avances en el desarrollo de vectores virales para terapia génica se puede encontrar en Lundstrom K. "Latest development in viral vectors for gene therapy"; Trends in Biotechnology, 2003, 21:118-122.
Entre los vectores virales usados en la actualidad se encuentran los alfavirus. Los alfavirus son virus envueltos que contienen una molécula de una hebra simple de ARN positiva, como genoma. Se han diseñado y construido vectores de expresión derivados de los alfavirus Sindbis Virus (SIN), Semliki Forest Virus (SFV), y virus de encefalitis 25 equina de Venezuela (VEE). Los vectores de alfavirus están basados en el uso de moléculas de ARN autoreplicativas derivadas de genomas de alfavirus, en las que las secuencias 5' y 3' necesarias para la replicación y el gen de la replicasa (Rep) se han mantenido, mientras que se han suprimido los genes que codifican para las proteínas virales estructurales y se han sustituido por un transgen. Después de la transfección de estos vectores en una célula, Rep será traducida y copiará el vector ARN en una hebra de ARN negativo, que será usada como molde para la amplificación del 30 vector de ARN. Rep también puede reconocer un promotor subgenómico en la hebra de ARN negativo, de la cual hará un ARN subgenómico más pequeño, que puede ser traducido para producir proteínas heterólogas a niveles elevados. Los vectores de alfavirus se pueden usar directamente como ARN cuando son transcritos in vitro a partir de un promotor procariótico, tal como SP6 o T7, o bien como ADN cuando la secuencia del replicón se coloca bajo un promotor eucariótico tal como CMV. El vector de ARN puede ser empaquetado en partículas virales por cotransfección del mismo 35 en células, junto con uno o más ARNs "ayudantes" que codifican para las proteínas estructurales virales. Los vectores de alfavirus tienen varias propiedades que los hacen atractivos para la terapia génica: un tropismo muy amplio, baja inmunogenicidad y un alto nivel de expresión de proteínas heterólogas. Esta expresión es, sin embargo, transitoria debido a la inducción de apoptosis en las células cuando tiene lugar la replicación. En el documento: Rayner J.O., Dryga S.A., Kamrud K.I. "Alphavirus vectors and vaccination"; Rev. Med. Virol. 2002;12 279-296, se describe el desarrollo de 40 vectores de expresión basados en alfavirus para su uso en el campo de las vacunas.
Otro tipo de vectores virales son los basados en adenovirus. Existe amplia bibliografía sobre el uso de adenovirus, que se han desarrollado para superar algunos de los inconvenientes de la terapia génica y como fuente para crear vectores de expresión. Un documento que recoge los últimos avances en vectores adenovirales es: Volpers C, Kochanek S. "Adenoviral vectors for gene transfer and therapy"; J Gene. Med. 2004; 6: S164-S171. Los adenovirus 45 tienen la ventaja de poseer una alta eficacia de transducción y capacidad de persistir en forma episomal. Sin embargo, la expresión de proteínas adenovirales induce fuertes respuestas inmunes, que limitan la duración de la expresión del transgén y causan toxicidad a las células infectadas por el vector. Se han desarrollado adenovirus vacíos para superar estos problemas. Dichos adenovirus vacíos están desprovistos de todos los genes adenovirales (las únicas secuencias conservadas son las dos secuencias terminales repetidas invertidas y las señales de empaquetamiento), y por lo tanto, 50 las células transducidas no expresan ningún producto adenoviral y no provocan una respuesta inmune contra el vector. En suma, la eliminación de todos los genes adenovirales deja suficiente sitio para alojar grandes casetes de expresión y es por ello, por lo que a los adenovirus vacíos se les llama también vectores adenovirales de alta capacidad. Un documento que describe aspectos concretos de los vectores adenovirales, relacionados con la supresión de todas las secuencias codificantes de proteínas virales es el trabajo de Morsy MA et al. "An adenoviral vector deleted for all viral 55 coding sequences results in enhanced safety and extended expression of a leptin transgene"; Proc. Natl. Acad. Sci. USA 1998, 95:7866–7871. El documento Schiedner G et al. "Variables Affecting In Vivo Performance of High-Capacity Adenovirus Vectors"; J. Virol. 2002, 76:1600–1609 describe el uso de ADN de relleno en los vectores de expresión basados en adenovirus vacíos, mostrando que la presencia de dicho ADN de relleno es esencial para conseguir un
incremento considerable de la expresión génica; y en general, que el diseño de vectores basados en adenovirus de alta capacidad (vacíos) puede variar sustancialmente el grado de expresión y la duración de la expresión de un gen.
Por otra parte el documento US-5.981.225 describe un vector para transferencia de genes basado en adenovirus, que comprende secuencias terminales invertidas repetidas (ITR), al menos una secuencia de señal de empaquetamiento y un gen adenoviral VAII y/o un gen adenoviral VAII; y comprende un gen extraño al adenovirus 5 operativamente unido a un promotor funcional en células diana para adenovirus.
El documento US-5.985.846 describe un vector de transferencia génica que comprende secuencias terminales invertidas repetidas (ITR) de adenovirus y partículas recombinantes de adenovirus que contienen dichas secuencias.
El documento US-6.566.093 describe vectores de ADNc derivado de alfavirus que consisten en ADN complementario de al menos parte del ARN de un alfavirus, esencial para la replicación del alfavirus, y ADNc heterólogo, 10 por ejemplo, ADNc que codifica una sustancia deseada. Dicha sustancia deseada puede ser una proteína o polipéptido biológicamente activo, así como una proteína o polipéptido inmunogénico o antigénico, o una proteína o polipéptido terapéuticamente activo, o un RNA terapéuticamente activo.
El objetivo de la presente invención es mejorar la expresión transgénica y la inducción de apoptosis en células tumorales mediada por vectores híbridos in vitro e in vivo. Un objetivo adicional es mejorar la eficacia de la terapia de 15 tumores en modelos animales mediante vectores híbridos.
Un objetivo adicional es además conseguir un método de terapia génica, en particular para el tratamiento del cáncer, mediante el uso de vectores híbridos.
Los objetivos de la presente invención se consiguen combinando en un único vector:
- una elevada capacidad de infección, por medio del uso de un sistema de liberación de adenovirus, 20
- un nivel elevado de expresión transgénica y la inducción de apoptosis, mediante el uso de un vector derivado de un alfavirus, tal como el SFV, y
- una especificidad... [Seguir leyendo]
Reivindicaciones:
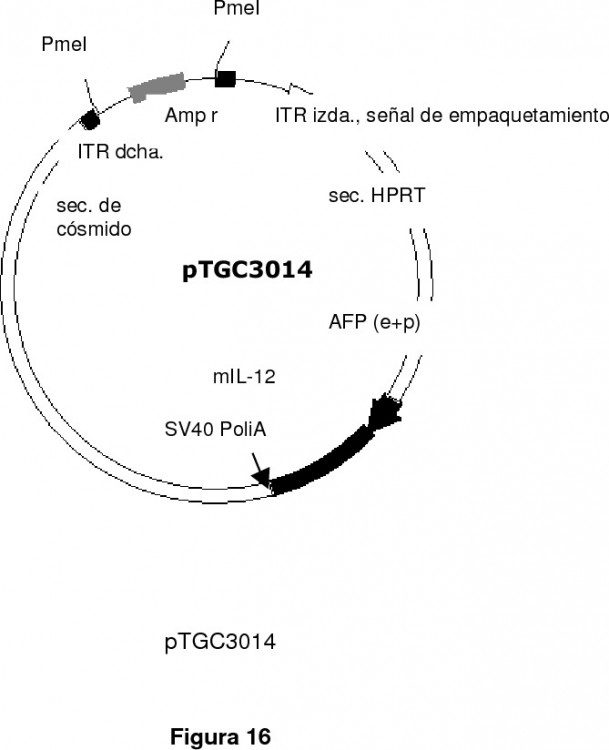
1. Un vector híbrido adenoviral de expresión génica que comprende al menos los siguientes elementos, orientados en dirección 5' a 3':
i. una primera cadena de origen adenoviral que comprende una primera secuencia terminal invertida repetida (ITR) y una secuencia señal para el empaquetamiento del adenovirus; 5
ii. una primera secuencia no codificante de relleno;
iii. una secuencia correspondiente a un promotor específico de tejido;
iv. una cadena de ADNc derivada de un alfavirus, cuya secuencia es parcialmente complementaria de un ARN alfaviral, que comprende al menos una secuencia codificante de al menos un gen exógeno de interés, en donde dicha cadena de ADNc comprende: 10
a) una secuencia 5' necesaria para la replicación del alfavirus,
b) una secuencia que codifica las proteínas no estructurales requeridas para la replicación del ARN alfaviral,
c) al menos un promotor subgenómico del alfavirus, y
d) una secuencia 3' necesaria para la replicación del alfavirus;
v. una secuencia de poliadenilación; y 15
vi. una segunda secuencia terminal invertida repetida (ITR) adenoviral.
2. Un vector híbrido adenoviral de expresión génica según la reivindicación 1, que comprende además un elemento vii que es una segunda secuencia no codificante de relleno, entre el elemento v y el elemento vi.
3. Un vector híbrido adenoviral de expresión génica según la reivindicación 1, en donde el elemento ii es una secuencia no codificante de relleno humana. 20
4. Un vector híbrido adenoviral de expresión génica según la reivindicación 1 ó 3, en donde el elemento ii es la región intrón de la fosforribosiltransferasa de hipoxantina genómica humana (HPRT).
5. Un vector híbrido adenoviral de expresión génica según cualquiera de las reivindicaciones 1 a 4, en donde el elemento i tiene la SEQ ID NO: 1.
6. Un vector híbrido adenoviral de expresión génica según la reivindicación 1, en donde el elemento iii es un 25 promotor específico de tumores.
7. Un vector híbrido adenoviral de expresión génica según la reivindicación 6, en donde el elemento iii es un promotor específico de tumores seleccionado entre AFP, telomerasa TERT, PAP, E2F y HIF.
8. Un vector híbrido adenoviral de expresión génica según la reivindicación 1, en donde el elemento iii es un promotor específico de tumores que tiene una secuencia seleccionada entre SEQ ID NO: 7, correspondiente a AFP p+e, 30 y SEQ ID NO: 15, correspondiente a telomerasa TERT.
9. Un vector híbrido adenoviral de expresión génica según cualquiera de las reivindicaciones 1 a 8, en donde el elemento iv comprende una secuencia derivada del virus Semliki Forest (SFV).
10. Un vector híbrido adenoviral de expresión génica según la reivindicación 1, en donde las secuencias a) a c) del elemento iv en su conjunto tienen una secuencia seleccionada entre SEQ ID NO: 3 y SEQ ID NO: 4. 35
11. Un vector híbrido adenoviral de expresión génica según la reivindicación 1 ó 10, caracterizado porque el elemento iv d) tiene la secuencia SEQ ID NO: 5..
12..Un vector híbrido adenoviral de expresión génica según cualquiera de las reivindicaciones anteriores, en donde el gen exógeno de interés está seleccionado entre uno o más genes terapéuticos, uno o más genes reporteros, o combinaciones de ellos. 40
13. Un vector híbrido adenoviral de expresión génica según la reivindicación 12, en donde el gen exógeno de interés es el gen terapéutico interleucina de mamífero IL-12.
14. Un vector híbrido adenoviral de expresión génica según la reivindicación 12, en donde el gen exógeno de interés es el gen terapéutico interleucina humana hIL-12.
15. Un vector híbrido adenoviral de expresión génica según la reivindicación 12, en donde el gen exógeno de 45
interés es un gen terapéutico seleccionado entre los genes factor estimulante de colonias (GMCSF), interferón-alfa y timidin-kinasa del virus de herpes simple (HSV-TK).
16. Un vector híbrido adenoviral de expresión génica según la reivindicación 10, en donde el elemento iv comprende en serie uno o varios subconjuntos de (promotor subgenómico + gen exógeno de interés).
17. Un vector híbrido adenoviral de expresión génica según la reivindicación 12, en donde el gen exógeno de 5 interés es un gen reportero seleccionado entre LacZ, Luciferasa, timidin kinasa del virus de herpes simple HSV-TK y GFP.
18. Un vector híbrido adenoviral de expresión génica según una cualquiera de las reivindicaciones 9 a 17, en donde el elemento iv forma un replicón funcionalmente controlado por el promotor iii, y en donde el promotor subgenómico alfaviral comprendido en iv.c) controla funcionalmente la expresión del gen exógeno de interés. 10
19. Un vector híbrido adenoviral de expresión génica según cualquiera de las reivindicaciones anteriores, en donde el elemento v es una secuencia de podiladenilación de SV40.
20. Un vector híbrido adenoviral de expresión génica según cualquiera de las reivindicaciones anteriores, en donde el elemento v tiene la secuencia SEQ ID NO: 6.
21. Un vector adenoviral de expresión génica según la reivindicación 2, en donde la segunda secuencia no 15 codificante de relleno es C346.
22. Un vector adenoviral de expresión génica según cualquiera de las reivindicaciones anteriores, en donde el elemento vi tiene la secuencia SEQ ID NO: 2.
23. Un vector híbrido adenoviral de expresión génica según cualquiera de las reivindicaciones anteriores, que comprende: 20
i. una primera cadena de origen adenoviral que comprende una primera secuencia terminal invertida repetida (ITR) y una secuencia señal para el empaquetamiento del adenovirus;
ii. una primera secuencia no codificante de relleno, que es la región intron de la fosforribosiltransferasa de hipoxantina genómica humana (HPRT);
iii. una secuencia correspondiente a un promotor específico de tejido, que es el promotor AFP, 25
iv. una cadena de ADNc derivada de un alfavirus, cuya secuencia es parcialmente complementaria a un ARN alfaviral derivado del virus SFV, que comprende una secuencia que codifica un gen exógeno de interés que es hIL-12 , en donde dicha cadena de ADNc comprende:
a) una secuencia 5' necesaria para la replicación del alfavirus,
b) una secuencia que codifica las proteínas no estructurales requeridas para la replicación del ARN alfaviral, 30
c) al menos un promotor subgenómico del alfavirus, y
d) una secuencia 3' necesaria para la replicación del alfavirus;
v. una secuencia de poliadenilación de SV40,
vi. una segunda secuencia terminal invertida repetida (ITR) adenoviral y
vii. una segunda secuencia no codificante de relleno, que es C346 genómico humano, colocada entre el elemento v 35 y el elemento vi.
24. Un vector híbrido adenoviral de expresión génica según cualquiera de las reivindicaciones anteriores, que comprende:
i. una primera cadena de origen adenoviral que comprende una primera secuencia terminal invertida repetida (ITR) y una secuencia señal para el empaquetamiento del adenovirus; 40
ii. una primera secuencia no codificante de relleno, que es la región intrón de la fosforribosiltransferasa de hipoxantina genómica humana (HPRT);
iii. una secuencia que corresponde a un promotor específico de tejido, que es el promotor AFP,
iv. una cadena de ADNc derivada de un alfavirus, cuya secuencia es parcialmente complementaria de un ARN alfaviral derivado del virus SFV, que comprende una secuencia que codifica un gen exógeno de interés, 45 seleccionado entre mIL-12 y LacZ, en donde dicha cadena de ADNc comprende:
a) una secuencia 5' necesaria para la replicación del alfavirus,
b) una secuencia que codifica las proteínas no estructurales requeridas para la replicación del ARN alfaviral,
c) al menos un promotor subgenómico del alfavirus, y
d) una secuencia 3' necesaria para la replicación del alfavirus;
v. una secuencia de poliadenilación de SV40, 5
vi. una segunda secuencia terminal invertida repetida (ITR) adenoviral, y
vii. una segunda secuencia no codificante de relleno, que es C346 genómico humano, colocada entre el elemento v y el elemento vi.
25. Un vector híbrido adenoviral de expresión génica según cualquiera de las reivindicaciones anteriores, en donde dicho vector tiene una longitud comprendida entre 27 y 38 kilobases. 10
26. Un vector híbrido adenoviral de expresión génica según cualquiera de las reivindicaciones anteriores, en donde dicho vector tiene la secuencia SEQ ID NO: 8.
27. Un vector híbrido adenoviral de expresión génica según cualquiera de las reivindicaciones 1 a 25, en donde dicho vector tiene la secuencia SEQ ID NO: 9.
28. Un vector híbrido adenoviral de expresión génica según cualquiera de las reivindicaciones 1 a 25, en donde 15 dicho vector tiene la secuencia SEQ ID NO: 10.
29. Uso de un vector híbrido adenoviral según una cualquiera de las reivindicaciones 1 a 28 anteriores en un procedimiento in vitro para transferir material genético a una célula, en donde dicha célula no es una célula de una línea germinal humana.
30. Uso según la reivindicación 29, en donde dicha célula es una célula tumoral. 20
31. Uso según la reivindicación 30, en donde dicha célula es una célula tumoral que expresa AFP.
32. Uso de un vector híbrido adenoviral definido según cualquiera de las reivindicaciones 1 a 28 para la preparación de un medicamento para el tratamiento de tumores .
33. Un vector híbrido adenoviral definido según cualquiera de las reivindicaciones 1 a 28 para su uso en el tratamiento de tumores. 25
34. Uso de un vector híbrido adenoviral definido según cualquiera de las reivindicaciones 1 a 28 para la preparación de un medicamento para inducir una respuesta inmune contra un antígeno extraño.
35. Un vector híbrido adenoviral definido según cualquiera de las reivindicaciones 1 a 28, para su uso en la inducción de una respuesta inmune frente a antígenos extraños.
36. Una composición farmacéutica, que comprende al menos un vector híbrido adenoviral definido según 30 cualquiera de las reivindicaciones 1 a 28.
37. Una composición farmacéutica, que comprende al menos un vector híbrido adenoviral definido según cualquiera de las reivindicaciones 1 a 28, en donde el gen exógeno de interés es hIL-12.
Patentes similares o relacionadas:
Terapia génica para la diabetes, del 8 de Julio de 2020, de UCL Business Ltd: Una molécula de ácido nucleico que comprende una secuencia de nucleótidos que codifica una proteína preproinsulina funcional en donde la secuencia de nucleótidos tiene al menos […]
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Vacuna de ADN que contiene un epítopo específico de VEGF y/o un epítopo específico de angiopoyetina-2, del 1 de Julio de 2020, de OSAKA UNIVERSITY: Un vector de expresión que codifica un polipéptido del antígeno del núcleo del virus de la hepatitis B quimérico con una inserción para uso en el tratamiento o la profilaxis […]
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Ácido nucleico antisentido, del 24 de Junio de 2020, de NIPPON SHINYAKU CO., LTD.: Un oligómero antisentido de 14 a 32 bases de longitud, que comprende dos unidades de oligómeros conectadas seleccionadas del grupo que consiste […]
Plekhg5 como diana farmacéutica para trastornos neurológicos, del 15 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Plekhg5 como diana farmacéutica para trastornos neurológicos. La invención hace referencia al uso del gen Plekhg5 como diana farmacológica para el cribado, […]
Ratón nuligénico para Pint que muestra un fenotipo asociado a envejecimiento prematuro, del 10 de Junio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un ratón cuyo genoma comprende una inactivación de un locus del ARN no codificante largo (ARNlnc) Pint endógeno, en donde la inactivación (i) da como resultado que el […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]