VARIANTES DE NEUBLASTINA.
Polipéptido que comprende una secuencia de aminoácidos que es al menos un 80% idéntica a los aminoácidos 15-113 de la SEC ID Nº 1,
en el que la secuencia de aminoácidos comprende un aminoácido diferente de arginina sustituido en las posiciones correspondientes a la posición 48 y la posición 49 de la SEC ID Nº 1, donde el polipéptido, cuando se dimeriza, se une a un complejo que contiene GFRalfa3 y RET, y donde el polipéptido muestra unión a heparina disminuida en comparación con la proteína neublastina de tipo salvaje de la SEC ID Nº 1
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/029637.
Solicitante: BIOGEN IDEC MA, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 14 CAMBRIDGE CENTER CAMBRIDGE, MASSACHUSETTS 02142 ESTADOS UNIDOS DE AMERICA.
Inventor/es: PEPINSKY, R., BLAKE, ROSSOMANDO,ANTHONY, SILVIAN,LAURA.
Fecha de Publicación: .
Fecha Solicitud PCT: 18 de Agosto de 2005.
Fecha Concesión Europea: 21 de Julio de 2010.
Clasificación Internacional de Patentes:
- C07K14/47 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de mamíferos.
Clasificación PCT:
- A61K38/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Referencia Cruzada a Solicitudes Relacionadas
Esta solicitud reivindica prioridad de la solicitud provisional número 60/602.825, presentada el 19 de agosto de 2004 y la solicitud provisional número 60/694.067, presentada el 24 de junio de 2005.
Campo Técnico
La invención se refiere a química proteica, biología molecular, y neurobiología.
Antecedentes
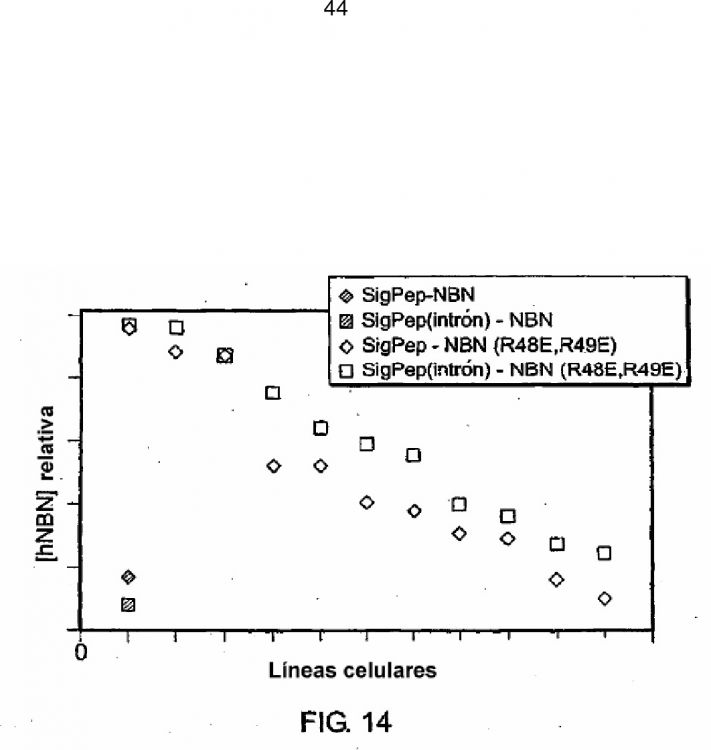
La neublastina, también conocida como artemina y enovina, es una proteína secretada homodimérica de 24 kDa que promueve la supervivencia de neuronas del sistema nervioso periférico y central tal como neuronas dopaminérgicas (Baudet et al., 2000, Development, 127:4335; Rosenblad et al., 2000, Mol. Cell Neurosci., 15(2):199; GenBank AF120274). El gen que codifica la neublastina se ha clonado y secuenciado (Roseblad et al., 2000, Mol. Cell Neurosci., 15(2): 199; Baloh et al., Neuron, 21:1291). [0004] La neublastina es un miembro de la familia de ligandos del factor neurotrópico derivado de la línea celular glial (GDNF). A nivel celular, los miembros de GDNF activan el receptor tirosina quinasa, RET. RET se asocia con un co-receptor, el receptor de la familia GDNF alfa (GFRalfa), una proteína de membrana unida a glucosilfosfatidil inositol (GPI) que proporciona especificada de ligando para RET. Se conocen cuatro GFRalfa (GFRalfa1-4), La neublastina se une a GFRalfa3 junto con RET formando un complejo de señalización ternario (Baudet et al. 2000, Development, 127:4335; Baloh et al., 1998, Neuron, 21:1291), que se localiza predominantemente sobre neuronas sensoriales nociceptivas (Orozco et al., 2001, Eur. J. Neurosci., 13(11):2177). Estas neuronas detectan el dolor y las lesiones. Por tanto, la neublastina tiene aplicación clínica en el tratamiento general de neuropatía y más específicamente en el tratamiento de dolor neuropático. [0005] La neublastina y los otros miembros de la familia GDNF son miembros de la superfamilia del factor de crecimiento transformante beta (TGF beta) y por tanto, se caracterizan por la presencia de siete residuos de cisteína conservados con espaciado similar que forman la estructura de un lazo de cisteína (Saarma, 1999, Microsc. Res. Tech., 45:292). Cada monómero contiene dos enlaces disulfuro que forman una estructura de bucle cerrado que rodea el tercer disulfuro para formar una estructura de lazo apretado. La séptima cisteína contenida dentro de cada monómero forma un enlace disulfuro intermolecular, que une covalentemente los monómeros para formar el producto dimérico final (Rattenholl et al 2000, J. Mol Biol., 305:523). [0006] Los miembros de la familia TGF beta se sintetizan como pre-proproteínas que finalmente se secretan como un homodímero maduro después de la escisión del péptido señal y el pro-dominio (véase, por ejemplo, Rattenholl, et al., 2000, J. Mol Biol., 305:523; Fairlie et al., 2001, J. Biol. Chem., 276(20): 16911). Tanto el péptido señal como el pro-dominio median la secreción apropiada de los miembros de la familia TGF beta (Rattenholl et al., 2000, J. Mol Biol., 305:523; Rattenholl et al., 2001, Eur. J. Biochem., 268:3296).
Resumen
La invención se basa, al menos en parte, en el descubrimiento de que la neublastina se une a sulfato de heparina y que residuos aminoacídicos particulares en el polipéptido de neublastina contribuyen a este acontecimiento de unión. Se descubrió que la sustitución de residuos aminoacídicos seleccionados disminuía la unión de heparina por polipéptidos de neublastina variantes y aumentaba la bioactividad y biodisponibilidad de las variantes. [0008] En un aspecto, la invención muestra un polipéptido que contiene una secuencia de aminoácidos que es al menos un 80% idéntica a los aminoácidos 15-113 de la SEC ID Nº 1, donde la secuencia de aminoácidos contiene un aminoácido diferente de arginina en la posición correspondiente a la posición 48 y la posición 49 de la SEC ID Nº 1 (por ejemplo, la arginina se sustituye con un residuo aminoacídico no conservativo tal como ácido glutámico), donde el polipéptido, cuando se dimeriza, se une a un complejo que contiene GFRalfa3 y RET, y donde el polipéptido muestra unión disminuida a heparina en comparación con la proteína neublastina de tipo salvaje de la SEC ID Nº 1. [0009] Por ejemplo, el residuo de arginina en la posición 48 y el residuo de arginina en la posición 49 de la SEC ID Nº 1 pueden sustituirse con residuos aminoacídicos no conservativos (por ejemplo, ácido glutámico). [0010] En algunas realizaciones, la secuencia de aminoácidos es al menos un 90%, al menos un 95%, o al menos un 98% idéntica a los aminoácidos 15113 de la SEC ID Nº 1. [0011] También se describe un polipéptido que contiene los aminoácidos 15113 de la SEC ID Nº 5. En algunas realizaciones, el polipéptido contiene los aminoácidos 10-113 de la SEC ID Nº 5. En algunas realizaciones, el polipéptido contiene la secuencia de aminoácidos de la SEC ID Nº 5. [0012] La invención también muestra conjugados que contienen un polipéptido descrito en este documento conjugado con un polímero de origen no natural. Un polímero ejemplar es un polímero sintético soluble en agua tal como un polialquilenglicol (por ejemplo, polietilenglicol). [0013] La invención también muestra una proteína de fusión que contiene un polipéptido descrito en este documento y una secuencia de aminoácidos heteróloga. [0014] La invención también muestra un dímero que contiene dos de los polipéptidos, conjugados, o proteínas de fusión descritos en este documento. [0015] La invención también muestra una composición farmacéutica que contiene un polipéptido, dímero, conjugado, o proteína de fusión descrito en este documento y un vehículo o excipiente farmacéuticamente aceptable. [0016] También se describe un ácido nucleico que contiene una secuencia que codifica un polipéptido descrito en este documento, un vector de expresión que contiene el ácido nucleico, y una célula que contiene el vector de expresión. [0017] También se describe un método para preparar un polipéptido, incluyendo el método las siguientes etapas: (i) proporcionar una célula que contiene un vector de expresión que contiene un ácido nucleico que codifica un polipéptido descrito en este documento, y (ii) cultivar la célula en condiciones que permiten la expresión del ácido nucleico. [0018] La invención también muestra un polipéptido, dímero, conjugado, proteína de fusión, o composición farmacéutica descrita en este documento para su uso en el tratamiento o prevención de un trastorno del sistema nervioso en un mamífero. [0019] La invención también muestra un polipéptido, dímero, conjugado, proteína de fusión, o composición farmacéutica descrita en este documento para su uso en el tratamiento del dolor neuropático en un mamífero.
La invención también muestra un polipéptido, dímero, conjugado, proteína de fusión, o composición farmacéutica descrita en este documento para su uso en la activación del receptor RET en un mamífero administrándolo al mamífero. [0021] Una ventaja de los polipéptidos de neublastina variantes seleccionados descritos en este documento es que tienen capacidad de unión a heparina disminuida en comparación con la neublastina de tipo salvaje. La unión disminuida a heparina provoca una eliminación disminuida del polipéptido variante in vivo. [0022] Inesperadamente se descubrió que una variante del polipéptido de neublastina que tiene sustituciones en las posiciones de los aminoácidos 48 y 49 tenía capacidad de unión a heparina enormemente disminuida y potencia y biodisponibilidad enormemente aumentadas en comparación con mutantes de un único aminoácido y/o neublastina de tipo salvaje. Por ejemplo, se descubrió que el mutante doble mostraba un aumento de aproximadamente 185 veces en la exposición sérica en comparación con la neublastina de tipo salvaje. Además, se descubrió que este mutante doble mostraba un aumento de más de cinco veces en la expresión in vitro en comparación con la neublastina de tipo salvaje, facilitando de este modo la producción a gran escala de la proteína. [0023] Las ventajas y propiedades inesperadas de los polipéptidos de neublastina variantes permiten el tratamiento de sujetos usando dosis inferiores de proteína y/o permiten intervalos prolongados entre administraciones (en comparación con tratamientos con la proteína de tipo salvaje). [0024] Salvo que se defina de otro modo, todos los términos técnicos y científicos usados en este documento tienen el mismo significado que el comprendido habitualmente por un especialista en la técnica a la que pertenece esta invención. Aunque pueden usarse métodos y materiales similares o equivalentes a los descritos en este documento...
Reivindicaciones:
1. Polipéptido que comprende una secuencia de aminoácidos que es al menos un 80% idéntica a los aminoácidos 15-113 de la SEC ID Nº 1, en el que la secuencia de aminoácidos comprende un aminoácido diferente de arginina sustituido en las posiciones correspondientes a la posición 48 y la posición 49 de la SEC ID Nº 1, donde el polipéptido, cuando se dimeriza, se une a un complejo que contiene GFRalfa3 y RET, y donde el polipéptido muestra unión a heparina disminuida en comparación con la proteína neublastina de tipo salvaje de la SEC ID Nº 1.
2. Polipéptido de la reivindicación 1, en el que el residuo de arginina de la posición 48 y el residuo de arginina de la posición 49 de la SEC ID Nº 1 están sustituidas con residuos aminoacídicos no conservativos.
3. Polipéptido de la reivindicación 1, en el que el residuo de arginina de la posición 48 y el residuo de arginina de la posición 49 de la SEC ID Nº 1 están cada uno sustituidos con ácido glutámico.
4. Polipéptido de cualquiera de las reivindicaciones 1 a 3, en el que la secuencia de aminoácidos es al menos un 90% idéntica a los aminoácidos 15-113 de la SEC ID Nº 1.
5. Polipéptido de cualquiera de las reivindicaciones 1 a 3, en el que la secuencia de aminoácidos es al menos un 95% idéntica a los aminoácidos 15-113 de la SEC ID Nº 1.
6. Polipéptido de cualquiera de las reivindicaciones 1 a 3, en el que la secuencia de aminoácidos es al menos un 98% idéntica a los aminoácidos 15-113 de la SEC ID Nº 1.
7. Polipéptido que comprende los aminoácidos 15-113 de la SEC ID Nº 5.
8. Polipéptido de la reivindicación 7, donde el polipéptido comprende los aminoácidos 10-113 de la SEC ID N º5.
9. Polipéptido de la reivindicación 7, donde el polipéptido comprende la
secuencia de aminoácidos de la SEC ID Nº 5.
10. Polipéptido de la reivindicación 7, donde el polipéptido consiste en los aminoácidos 15-113 de la SEC ID Nº 5.
11. Polipéptido de la reivindicación 7, donde el polipéptido consiste en los aminoácidos 10-113 de la SEC ID Nº 5.
12. Polipéptido de la reivindicación 7, donde el polipéptido consiste en la secuencia de aminoácidos de la SEC ID Nº 5 ó 7.
13. Dímero que comprende dos polipéptidos de acuerdo con cualquiera de las reivindicaciones 1 a 12.
14. Conjugado que comprende el polipéptido de cualquiera de las reivindicaciones 1 a 12 conjugado con un polímero de origen no natural.
15. Conjugado de la reivindicación 14, en el que el polímero de origen no natural es un polialquilenglicol.
16. Conjugado de la reivindicación 15, en el que el polialquilenglicol es polietilenglicol.
17. Conjugado de cualquiera de las reivindicaciones 14 a 16, en el que el polímero de origen no natural está acoplado al polipéptido en el extremo amino.
18. Conjugado de cualquiera de las reivindicaciones 14 a 16, en el que el polímero de origen no natural está acoplado al polipéptido en un sitio de conjugación de polímero interno.
19. Proteína de fusión que comprende el polipéptido de cualquiera de las reivindicaciones 1 a 12 y una secuencia de aminoácidos heteróloga.
20. Composición farmacéutica que comprende el polipéptido de cualquiera de las reivindicaciones 1 a 12, el dímero de la reivindicación 13, el conjugado de una cualquiera de las reivindicaciones 14 a 18, o la proteína de fusión de
la reivindicación 19 y un vehículo o excipiente farmacéuticamente aceptable.
21. Polipéptido de una cualquiera de las reivindicaciones 1 a 12, el dímero de la reivindicación 13, el conjugado de cualquiera de las reivindicaciones 14 a 18, la proteína de fusión de la reivindicación 19, o la composición farmacéutica de la reivindicación 20 para su uso como medicamento.
22. Ácido nucleico que comprende una secuencia que codifica el polipéptido de cualquiera de las reivindicaciones 1 a 12.
23. Vector de expresión que comprende el ácido nucleico de la reivindicación 22.
24. Célula que comprende el vector de expresión de la reivindicación 23.
25. Procedimiento para preparar un polipéptido, el procedimiento comprendiendo: proporcionar la célula de la reivindicación 24, y cultivar la célula en condiciones que permitan la expresión del ácido nucleico.
26. Uso del polipéptido de cualquiera de las reivindicaciones 1 a 12, el dímero de la reivindicación 13, el conjugado de cualquiera de las reivindicaciones 14 a 18, o la proteína de fusión de la reivindicación 19 para la preparación de una composición farmacéutica destinada al tratamiento o la prevención de una afección del sistema nervioso en un mamífero.
27. Uso del polipéptido de cualquiera de las reivindicaciones 1 a 12, el dímero de la reivindicación 13, el conjugado de cualquiera de las reivindicaciones 14 a 18, o la proteína de fusión de la reivindicación 19 para la preparación de una composición farmacéutica destinado al tratamiento del dolor neuropático en un mamífero.
28. Uso del polipéptido de cualquiera de las reivindicaciones 1 a 12, el dímero de la reivindicación 13, el conjugado de cualquiera de las reivindicaciones 14 a 18, o la proteína de fusión de la reivindicación 19 para la preparación de una composición farmacéutica destinada a la activación del receptor RET en un mamífero.
29. Polipéptido de cualquiera de las reivindicaciones 1 a 12, el dímero de la reivindicación 13, el conjugado de cualquiera de las reivindicaciones 14 a 18, la proteína de fusión de la reivindicación 19, o la composición
5 farmacéutica de la reivindicación 20 para su uso en el tratamiento o prevención de una afección del sistema nervioso en un mamífero.
30. Polipéptido de cualquiera de las reivindicaciones 1 a 12, el dímero de la reivindicación 13, el conjugado de cualquiera de las reivindicaciones 14 a 18, la proteína de fusión de la reivindicación 19, o la composición farmacéutica de la reivindicación 20, para su uso en el tratamiento del dolor neuropático en un mamífero.
31. Polipéptido de cualquiera de las reivindicaciones 1 a 12, el dímero de la reivindicación 13, el conjugado de cualquiera de las reivindicaciones 14 a 18, la proteína de fusión de la reivindicación 19, o la composición farmacéutica de la reivindicación 20 para su uso en la activación del receptor RET en un mamífero.
32. Uso, polipéptido, dímero, conjugado, proteína de fusión o composición farmacéutica de cualquiera de las reivindicaciones 26 a 31, donde el mamífero es un ser humano.
Patentes similares o relacionadas:
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Biomarcador de enfermedad autoinmunitaria, del 15 de Julio de 2020, de Tzartos, Socrates: Un método de diagnóstico o pronóstico de una enfermedad autoinmunitaria asociada con la formación de lesiones desmielinizadas del sistema nervioso central (SNC) […]
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]
Procedimientos y composiciones para el tratamiento de una afección genética, del 24 de Junio de 2020, de Sangamo Therapeutics, Inc: Una célula precursora de glóbulos rojos genomanipulada caracterizada por una modificación genómica dentro del exón 2 o el exón 4 de BCL11A o dentro de BCL11A-XL […]
Reactivos SIRP-alfa de alta afinidad, del 24 de Junio de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un polipéptido SIRPα de alta afinidad que comprende al menos una y no más de 15 modificaciones de aminoácidos dentro del dominio d1 de una secuencia SIRPα de tipo […]
Estructuras artificiales de poliepítopos para uso en inmunoterapia, del 17 de Junio de 2020, de Invectys: Un vector de expresión de ADN o una mezcla de vectores de expresión de ADN que codifica al menos dos epítopos de CD4 de la transcriptasa inversa de la telomerasa […]
Inmunoterapia WT1 para enfermedad angiogénica intraocular, del 17 de Junio de 2020, de INTERNATIONAL INSTITUTE OF CANCER IMMUNOLOGY, INC.: Una composición farmacéutica que comprende un péptido WT1 o péptido WT1 variante para su uso en el tratamiento y/o prevención de una enfermedad […]