Variantes de cadena beta de HGF.
Molécula antagonista de HGF/C-Met que comprende un mutante de HGF que comprende una mutación en lacadena b de HGF en la posición V495,
G498, R502 más T503, o D672, en la que la mutación en la cadena b deHGF impide la inserción del extremo N terminal de la cadena b de HGF en un bolsillo de unión a HGF, y en la que elmutante de HGF resultante presenta una función biológica reducida en comparación con el HGF de tipo natural.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/014662.
Solicitante: GENENTECH, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1 DNA WAY SOUTH SAN FRANCISCO, CA 94080-4990 ESTADOS UNIDOS DE AMERICA.
Inventor/es: LAZARUS, ROBERT, A., KIRCHHOFER,DANIEL,K, WIESMANN,CHRISTIAN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
PDF original: ES-2446923_T3.pdf
Fragmento de la descripción:
Variantes de cadena beta de HGF
CAMPO TECNlCO [0001] La presente invencion se refiere generalmente a los campos de la biologia molecular y la regulacion del factor de crecimiento. Mas especificamente, la presente invencion se refiere a moduladores de la ruta de senalizacion de HFG/c-met y a usos de dichos moduladores. ANTECEDENTES [0002] El factor de crecimiento de hepatocitos (HGF) , tambien conocido como factor dispersor (SF) , es el ligando para Met (Bottaro et al., 1991) , una tirosina quinasa receptora codificada por el protooncogen c-met (Cooper et al.,
1984a &b) . La union de HGF a Met induce la fosforilacion del dominio quinasa intracelular que da como resultado la activacion de una compleja serie de rutas intracelulares que conducen al crecimiento, diferenciacion y migracion celular en diversos tipos de celulas; varios estudios publicados recientemente proporcionan una exhaustiva vision global (Birchmeier et al., 2003; Trusolino y Comoglio, 2002; Maulik et al., 2002) . Ademas de su importancia fundamental en el desarrollo embrionario y regeneracion tisular, la ruta de senalizacion de HGF/Met tambien estaba implicada en el crecimiento tumoral invasivo y metastasis y, por tanto, representa una diana terapeutica interesante (Birchmeier et al., 2003; Trusolino y Comoglio, 2002; Danilkovitch-Miagkova y Zbar, 2002; Ma et al., 2003) . [0003] HGF pertenece a la familia de factores de crecimiento relacionados con plasminogeno y comprende una cadena α de 69 kDa que contiene el dominio del dedo N-terminal (N) y cuatro dominios de Kringle (K1-K4) , y una cadena β de 34 kDa que tiene una gran similitud con dominios de proteasas de serina proteasas similares a quimotripsina del Clan PA (S) /FamiliaS1 (Nakamura et al., 1989; Donate et al., 1994; Rawlings et al., 2002) . Al igual que el plasminogeno y otros zimogenos de serina proteasa, el HGF se secreta en forma precursora de cadena sencilla (scHGF) . scHGF se une a proteoglicanos de heparan sulfato, tales como sindecan-1 (Derksen et al., 2002) en superficies celulares o en la matriz extracelular. Los proteoglicanos de heparan sulfato se unen al dominio N (Hartmann et al., 1998) , que tambien contribuye a la union de Met de alta afinidad junto con aminoacidos situados en K1 (Lokker et al., 1994) . Aunque scHGF es capaz de unirse a Met con alta afinidad, no puede activar al receptor (Lokker et al., 1992; Hartmann et al., 1992) . La adquisicion de la actividad de senalizacion de HGF depende de la escision proteolitica (activacion) de scHGF en Arg494-Val495 que da como resultado la formacion de HGF maduro, un heterodimero α/β unido mediante puentes disulfuro (Lokker et al., 1992; Hartmann et al., 1992; Naldini et al.,
1992) . El dominio de tipo proteasa de HGF (cadena º de HGF) esta desprovisto de actividad catalitica ya que carece de la triada catalitica requerida Asp [c102]-His [c57]-Ser [c195] (numeracion estandar de quimiotripsinogeno en parentesis) hallada en todas las serina proteasas (Perona y Craik, 1995; Hedstrom, 2002) , que tiene una Gln534 [c57] y Tyr673 [c195]. [0004] Debido a su importancia en la regulacion de la actividad de HGF, este proceso debe estar controlado estrechamente por enzimas convertidoras de HGF y sus inhibidores fisiologicos correspondientes. La activacion de scHGF se mide in vitro por serina proteasas similares a quimotripsina, incluyendo el activador del factor de crecimiento de hepatocitos (HGFA) (Miyazawa et al., 1993) , matriptasa/MT-SP1 (Takeuchi et al. 1999; Lin et al., 1999) , el activador de plasminogeno de tipo uroquinasa (Naldini et al., 1992) , factor Xlla (Shimomura et al., 1995) ,
factor Xla (Peek et al., 2002) y kalikreina plasmatica (Peek et al., 2002) . Similares a scHGF, estas proteasas se producen en forma de precursores inactivos; sus actividades enzimaticas tambien estan fuertemente reguladas por otras proteasas de activacion e inhibidores tanto de tipo Kunitz como de tipo serpina. [0005] Se han descrito las serina proteasas y su proceso de activacion (Donate et al., 1994) . En las serina proteasas, la escision de activacion del zimogeno produce una reordenacion conformacional del denominado "dominio de activacion" dando origen a un punto activo formado adecuadamente y la region de interaccion sustrato/inhibidor. El dominio de activacion constituye tres bucles expuestos a la superficie llamados bucles [c140], [c180] y [c220] y la insercion del extremo N terminal recien formado en un bolsillo hidrofobico (Huber y Bode, 1978) . En la proteina homologa estimuladora de macrofagos del par ligando/receptor (MSP) /Ron, la cadena β de MSP
similar a serina proteasa proporciona la energia principal para la union al receptor (Wang et al., 1997; Miller y Leonard, 1998) . Esto se invierte a partir del sistema HGF/Met, donde el punto de union al receptor de alta afinidad para Met esta en la cadena α de HGF (Lokker, et al., 1994; Okigaki et al., 1992) . [0006] La importancia del eje de senalizacion de HGF/Met en la funcion celular normal y en la etiologia de trastornos clinicos sugiere la necesidad de desarrollar medios terapeuticos altamente efectivos basados en la modulacion de este eje. La complejidad de esta ruta, sin embargo, particularmente a la luz del mecanismo poco entendido de las interacciones de HGF-HGF y HGF/Met, ha progresado lentamente en este frente y ha destacado la necesidad de desarrollar estrategias que se basen en un mejor entendimiento del mecanismo de accion de las interacciones de HGF-HGF y HGF/Met. La invencion descrita aqui a continuacion satisface esta necesidad y proporciona otras 65 ventajas.
DESCRlPClON DE LA lNVENClON
El factor de crecimiento de hepatocitos (HGF) , un factor de crecimiento relacionado con plasminogeno, se une a su Met de tirosina quinasa receptora (tambien referida en este documento como C-Met, c-Met o c-met) , que esta implicada en el desarrollo, regeneracion tisular y crecimiento tumoral invasivo. La propia cadena de HGF de tipo serina proteasa se une a Met. A parte de unirse a Met, no esta claro que regiones y residuos especificos en la cadena de HGF son necesarios para realizar la senalizacion adecuada a traves de la ruta de HGF/Met. Los presentes inventores predijeron que ciertas regiones/posiciones en la cadena contribuyen de manera importante a una actividad funcional correcta de HGF, donde estas contribuciones pueden implicar o no la union de la cadena de HGF a su receptor afin. Los resultados descritos en el presente documento aportan evidencias de que mutaciones en la region N terminal y/o la region de dimerizacion de la cadena de HGF pueden alterar la funcion biologica de HGF/Met, con o sin impedir sustancialmente la union de HGF (en particular la cadena de HGF) a c-Met- En general, pero no necesariamente, estas mutaciones no implican posiciones pensadas para comprender el "dominio de activacion" o "la region del sitio activo" del HGF de tipo natural.
Los analisis de mutacion descritos en este documento proporcionan una base para el diseno de una multitud de mutantes de HGF capaces de inhibir las interacciones de HGF/HGF de tipo natural y HGF/c-met en un espectro de potencias. Los ejemplos de dichos mutantes se describen en este documento. Estos mutantes son capaces de competir con HGF de tipo natural por la union a c-met, aunque muestran una capacidad reducida para realizar las funciones biologicas asociadas a c-met. Esto es particularmente ventajoso cuando la inhibicion completa o sustancial del eje HGF/c-met es indeseable; esto es particularmente importante puesto que HGF y c-met se expresan de forma ubicua en celulas y tejidos normales. Estos mutantes tambien pueden usarse como agentes terapeuticos ventajosos para tratar afecciones patologicas en las que la actividad biologica reducida, pero no su completa ausencia, de HGF/c-met es deseable. Los metodos y composiciones de la invencion se basan, como minimo en parte, en estos hallazgos que se describen con mas detalles a continuacion.
En un aspecto, la presente invencion proporciona una molecula antagonista de HGF/C-Met que comprende un mutante de HGF que comprende una mutacion en la region N terminal de la cadena de HGF tal como se define en las reivindicaciones.
Una mutacion en la region N terminal de la cadena de HGF puede ser cualquiera que impida la insercion del extremo N terminal de la cadena de HGF en un bolsillo de union de HGF. En una realizacion, el mutante de la cadena de HGF resultante se une a C-Met con una afinidad de union reducida en comparacion con la cadena de HGF de tipo natural. En una realizacion, el mutante de la cadena de HGF resultante se une a C-Met con una afinidad sustancialmente equivalente a la cadena de HGF de tipo natural. En una realizacion, el HGF de longitud completa resultante que contiene una cadena º de HGF mutada, se une a C-Met con una afinidad de union reducida... [Seguir leyendo]
Reivindicaciones:
1. Molecula antagonista de HGF/C-Met que comprende un mutante de HGF que comprende una mutacion en la cadena β de HGF en la posicion V495, G498, R502 mas T503, o D672, en la que la mutacion en la cadena β de HGF impide la insercion del extremo N terminal de la cadena β de HGF en un bolsillo de union a HGF, y en la que el mutante de HGF resultante presenta una funcion biologica reducida en comparacion con el HGF de tipo natural.
2. Molecula antagonista, segun la reivindicacion 1, en la que la funcion biologica es la proliferacion celular, la migracion celular, la fosforilacion de Met o la angiogenesis.
3. Molecula antagonista, segun la reivindicacion 1 o 2, en la que el mutante de HGF resultante se une a C-Met con una afinidad de union sustancialmente reducida en comparacion con el HGF de tipo natural.
4. Molecula antagonista, segun la reivindicacion 1 o 2, en la que el mutante de HGF resultante se une a C-met con una afinidad sustancialmente equivalente a la del HGF de tipo natural.
5. Molecula antagonista, segun cualquiera de las reivindicaciones anteriores, en la que la mutacion en la cadena β de HGF es V495G, V495A, G498l, G498P, G498V, R502del mas T503del, o D672N.
6. Molecula antagonista, segun cualquiera de las reivindicaciones anteriores, en la que la molecula comprende aminoacidos de tipo natural en las posiciones 534, 578, 619, 673, 692, 693, 694, 695, 696, 699 y/o 702.
7. Molecula antagonista, segun cualquiera de las reivindicaciones anteriores, en la que la molecula presenta una capacidad de senalizacion de C-met reducida en comparacion con el HGF de tipo natural.
8. Molecula antagonista, segun cualquiera de las reivindicaciones anteriores, en la que la molecula presenta una capacidad reducida para estimular la migracion celular en comparacion con el HGF de tipo natural.
9. Molecula antagonista, segun cualquiera de las reivindicaciones anteriores, en la que la molecula presenta una capacidad reducida para estimular la proliferacion celular en comparacion con el HGF de tipo natural.
10. Molecula antagonista, segun cualquiera de las reivindicaciones anteriores, en la que la molecula presenta una capacidad reducida para estimular la angiogenesis en comparacion con el HGF de tipo natural.
11. Molecula antagonista de HGF/c-met, segun cualquiera de las reivindicaciones 1 a 10, para utilizar en un metodo de reduccion de la activacion de c-Met en un sujeto.
12. Molecula antagonista para utilizar, segun la reivindicacion 11, para reducir la proliferacion de una celula en un sujeto.
13. Molecula antagonista para utilizar, segun la reivindicacion 11, para reducir la migracion de una celula en un sujeto.
14. Molecula antagonista para utilizar, segun la reivindicacion 11, para reducir la actividad angiogenica de una celula en un sujeto.
15. Molecula antagonista de HGF/c-met, segun cualquiera de las reivindicaciones 1 a 10, para utilizar en un metodo de tratamiento de una afeccion patologica asociada con la activacion de c-Met en un sujeto.
16. Molecula antagonista para utilizar, segun la reivindicacion 15, en la que la afeccion patologica es cancer.
17. Utilizacion de una molecula antagonista de HGF/c-Met, segun cualquiera de las reivindicaciones 1 a 10, en la preparacion de un medicamento para el tratamiento de una afeccion patologica asociada con la activacion de c-Met en un sujeto, en la que la afeccion patologica es cancer.
18. Acido nucleico que codifica la molecula antagonista de HGF/c-Met, segun cualquiera de las reivindicaciones 1
10.
19. Celula huesped, que comprende el acido nucleico segun la reivindicacion 18.
20. Articulo de fabricacion que comprende un recipiente que comprende una o mas moleculas antagonista de HGF/c-Met segun cualquiera de las reivindicaciones 1-10.
21. Metodo de produccion de la molecula antagonista de HGF/c-Met, segun cualquiera de las reivindicaciones 1-10, comprendiendo dicho metodo expresar en una celula huesped un acido nucleico que codifica la molecula antagonista, y recuperar la molecula antagonista de la celula.
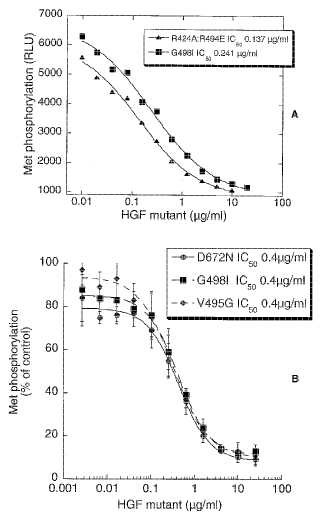
Figura 1A
Figura 1B
Union de mutantes de HGF de longitud completa a Met en un ensayo de union de competicion Mutante de HGF Union de competicion HGF/Met [numeracion de quimiotripsinogeno] lC50 (mut) /lC50 (wt) WT 1 V495A [c16] 0, 8 ± 0, 1 V495G [c16] 1, 7 ± 0, 1 V495del [c16del] 0, 7 ± 0, 2 D672N [c194] 2, 0 ± 0, 8 G498A [c19] 0, 7 ± 0, 2 G498l [c19] 1, 1 ± 0, 5 G498P [c19] 1, 1 ± 0, 2 G498V [c19] 1, 3 ± 0, 4 Figura 1C
lnhibicion de la migracion de celulas MDA-MB435 y la proliferacion de BxPC3 por mutantes de HGF de longitud completa (n = 4)
Mutante de HGF Migracion de MDA-MB435 Proliferacion de BxPC3
HGFmut 200 nM HGFmut 20 nM HGFmut 200 nM
% de control ± SD % de control ± SD % de control ± SD
V495G 28, 0 ± 19, 5 63, 4 ± 15, 5 -5, 3 ± 6, 6
D672N 26, 0 ± 7, 4 57, 4 ± 14, 1 4, 4 ± 9, 3
G498l 21, 1 ± 17, 6 38, 5 ± 20, 7 -12, 0 ± 11, 2
scHGF 15, 2 ± 6, 1 46, 5 (n = 2) 9, 3 (n = 2)
Figura 2A Figura 2B Figura 3A Figura 3B Figura 4
Patentes similares o relacionadas:
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Péptidos de unión beta amiloide y sus usos para el tratamiento y el diagnóstico de la demencia de Alzheimer, del 17 de Junio de 2020, de Priavoid GmbH: Péptido que contiene al menos una secuencia de aminoácidos que se une a especies beta amiloides y en el que la carga negativa del grupo carboxilo presente […]
Arginina desiminasa con reactividad cruzada reducida hacia anticuerpos para ADI - PEG 20 para el tratamiento del cáncer, del 6 de Mayo de 2020, de TDW Group: Una composición terapéutica que comprende una arginina desiminasa (ADI) aislada y un vehículo farmacéuticamente aceptable, en donde la ADI aislada comprende la secuencia de […]
Composiciones y métodos utilizando andamios de lisofosfatidilcolina, del 6 de Mayo de 2020, de NATIONAL UNIVERSITY OF SINGAPORE: Un método para seleccionar uno o más compuestos o ácidos grasos para determinar el transporte mediado por lisofosfatidilcolina (LPC) del uno o más compuestos o ácidos […]
Péptidos antimicrobianos y composiciones de los mismos, del 29 de Abril de 2020, de REVANCE THERAPEUTICS, INC: Composición farmacéutica o cosmética que comprende un péptido, en donde dicho péptido consiste en la secuencia de aminoácidos SEQ ID NO: 3 correspondiente […]
COMPOSICIÓN PARA LA ESTIMULACIÓN DEL SISTEMA INMUNE EN PECES QUE CONTIENE PÉPTIDOS RECOMBINANTES, PÉPTIDOS RECOMBINANTES INMUNOESTIMULANTES Y SECUENCIAS NUCLEOTÍDICAS QUE LOS CODIFICAN, del 23 de Abril de 2020, de UNIVERSIDAD DE CONCEPCION: La presente invención se refiere a una composición, una micropartícula y una formulación alimenticia que comprende péptidos recombinantes que estimulan el sistema inmune […]
Nuevo péptido con cuatro epítopos CTL unidos, del 15 de Abril de 2020, de TAIHO PHARMACEUTICAL CO., LTD.: Un péptido que consiste en 4 epítopos unidos, en el que los 4 péptidos de epítopo se seleccionan del grupo que consiste en los péptidos de epítopo CTL: el péptido como […]