VACUNAS CONTRA LA TOS FERINA ACELULARES Y PROCEDIMIENTOS DE PREPARACIÓN DE LAS MISMAS.
Utilización de la forma purificada de toxoide de la tos ferina,
hemoaglutinina filamentosa, pertactina y aglutinógenos fimbriales de B. pertussis en la elaboración de una preparación de vacuna de combinación contra la enfermedad causada por B. pertussis, para la administración a una población humana en situación de riesgo de enfermedad causada por B. pertussis para proporcionar protección contra la enfermedad causada por B. pertussis en la que cada dosis humana única de la preparación de vacuna contiene los antígenos de tos ferina siguientes, a saber de 5 a 30 μg de nitrógeno de dicho toxoide de la tos ferina, 5 a 30 μg de nitrógeno de dicha hemoaglutinina filamentosa, 3 a 15 μg de nitrógeno de pertactina, y 1 a 10 μg de nitrógeno de aglutinógenos fimbriales 2 (Agg2) y 3 (Agg3) y en la que la relación en peso de Agg2 a Agg3 es de 1,5:1 a 2:1 y en la que dicha preparación de vacuna proporciona dicha protección contra la enfermedad causada por B. pertussis en por lo menos el 70% de los miembros de una población en situación de riesgo que se puede determinar por un ensayo de eficacia clínica y en la que dicha vacuna está sustancialmente exenta de aglutinógeno 1 fimbrial
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E03078355.
Solicitante: SANOFI PASTEUR LIMITED.
Nacionalidad solicitante: Canadá.
Dirección: CONNAUGHT CAMPUS 1755 STEELES AVENUE WEST TORONTO, ON M2R 3T4 CANADA.
Inventor/es: TAN, LARRY, U., L., BARRETO, LUIS, THIPPHAWONG, JOHN, JACKSON, GAIL, E., D., BOUX, LESLIE, VOSE, JOHN, R., HERBERT, ANDREW, Fahim,Raafat E, Klein,Michael H.
Fecha de Publicación: .
Fecha Solicitud PCT: 2 de Mayo de 1996.
Clasificación Internacional de Patentes:
- A61K39/10B
- A61K39/116 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos bacterianos polivalentes.
- C07K14/235 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de Bordetella (G).
Clasificación PCT:
- A61K39/10 A61K 39/00 […] › Brucella; Bordetella, p. ej. Bordetella pertussis.
- A61K39/116 A61K 39/00 […] › Antígenos bacterianos polivalentes.
- A61P31/04 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › Agentes antibacterianos.
- A61P37/00 A61P […] › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
Clasificación antigua:
- A61K39/10 A61K 39/00 […] › Brucella; Bordetella, p. ej. Bordetella pertussis.
- A61K39/116 A61K 39/00 […] › Antígenos bacterianos polivalentes.
- A61P31/04 A61P 31/00 […] › Agentes antibacterianos.
- A61P37/00 A61P […] › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda.
PDF original: ES-2359806_T3.pdf
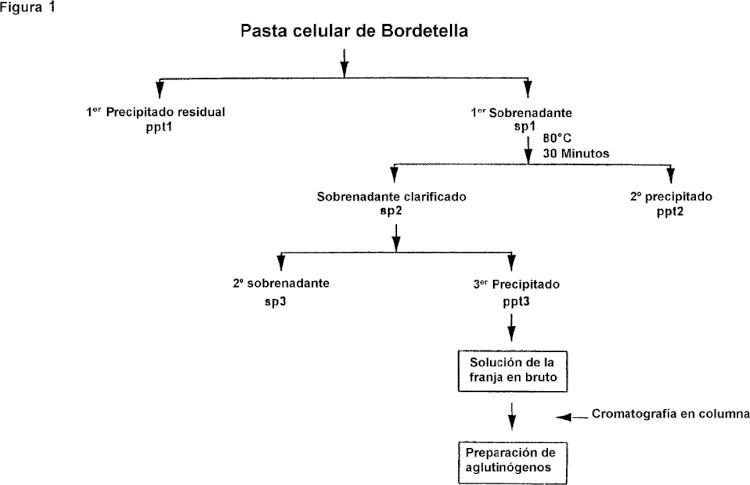
Fragmento de la descripción:
Campo de la invención
La presente invención se refiere a vacunas contra la tos ferina acelulares, a sus componentes y a su preparación.
Referencia a la solicitud relacionada
La presente solicitud es una continuación en parte de la solicitud de patente US nº 08/501.743 en trámite presentada el 12 de julio de 1995, que a su vez es una continuación en parte de la solicitud de patente US nº 08/433.646 en trámite presentada el 4 de mayo de 1995.
Antecedentes de la invención
La tos ferina o coqueluche es una infección grave, del aparato respiratorio superior muy contagiosa producida por Bordetella pertussis. La Organización Mundial de la salud estima que existen 60 millones de casos de tos ferina al año y 0,5 a 1 millón de muertes asociadas (ref. 1). En la presente memoria se hace referencia a varias referencias entre paréntesis para describir completamente el estado de la técnica a la que corresponde la presente invención. Toda la información bibliográfica de cada cita se encuentra al final de la memoria. En las poblaciones sin vacunar, se ha observado una incidencia de tos ferina hasta del 80% en niños menores de 5 años (ref. 2). Aunque la tos ferina se considera generalmente que es una enfermedad de la infancia, existen pruebas crecientes de enfermedad clínica y asintomática en adolescentes y adultos (refs. 3, 4 y 5).
La introducción de vacunas con células completas compuestas de cantidades eficaces de organismos de B. pertussis inactivados química y térmicamente en la década de 1940 fue responsable de una reducción drástica en el número de casos de tos ferina producida por B. pertussis. Los índices de eficacia de las vacunas de células completas se han estimado en hasta el 95% dependiendo de la definición del caso (ref. 6). Aunque la infección con
B. pertussis proporciona inmunidad de larga duración, existen pruebas crecientes de disminución de la protección después de la inmunización con vacunas de células completas (ref. 3). Varios informes que citan una relación entre la vacunación antitosferínica con células completas, la reactogenicidad y efectos secundarios graves condujeron a una disminución de la aceptación de la vacuna y epidemias renovadas consgiuientes (ref. 7). Más recientemente se han desarrollado vacunas contra la tos ferina de componente definido.
Antígenos para vacunas contra la tos ferina definidas
Se han desarrollado varias vacunas contra la tos ferina acelulares e incluyen los antígenos de Bordetella pertussis. La toxina de la tos ferina (PT), la hemoaglutinina filamentosa (HAF), la proteína de la membrana externa de 69 kDa (pertactina) y los aglutinógenos fimbriales (véase la tabla 1 a continuación. Las tablas aparecen al final de la memoria).
Toxina de la tos ferina
La toxina de la tos ferina es una exotoxina que es un miembro de la familia A/B de las toxinas bacterianas con actividad de ADP-ribosiltransferasa (ref. 8). El resto A de estas toxinas presenta la actividad de ADPribosiltransferasa y la fracción B interviene en la unión de la toxina a los receptores celulares del huésped y la traslocación de A a su punto de acción. El PT se facilita asimismo la adherencia de B. pertussis a las células epiteliales ciliadas (ref. 9) y también desempeña una función en la invasión de macrófagos por B. pertussis (ref. 10).
Todas las vacunas contra la tos ferina acelulares tienen incluido PT, lo que se ha propuesto como un factor de virulencia principal y antígeno protector (refs. 11, 12). La infección natural con B. pertussis genera respuestas a PT tanto humorales como mediadas por las células (refs. 13 a 17). Los lactantes tienen anticuerpos anti-PT obtenidos a través de la placenta (refs. 16, 18) y los anticuerpos anti-PT que contiene el calostro humano resultaban eficaces en la protección pasiva de ratones contra la infección por aerosol (ref. 19). Una respuesta inmunitaria mediada por células (IMC) a subunidades PT se ha demostrado después de la inmunización con una vacuna acelular (ref. 20) y una repuesta IMC al PT se generó después de la vacunación con células completas (ref. 13). El PT inactivado químicamente en vacunas de células completas o de componente es protector en modelos animales y en seres humanos (ref. 21). Además, los anticuerpos monoclonales específicos para la subunidad S1 protegen contra la infección por B. pertussis (refs. 22 y 23).
Los principales efectos patofisiológicos del PT son debidos a su actividad de ADP-ribosiltransferasa. El PT cataliza la transferencia de la ADP-ribosa del NAD a la proteína de unión del nucleótido guanina G1, destruyendo así el sistema celular regulador de la adenilato ciclasa (ref. 24). PT además evita la migración de macrófagos y linfocitos a zonas de inflamación e interfiere con la fagocitosis mediada por neutrófilos y la destrucción de bacterias (ref. 25). Se han utilizado numerosos ensayos in vitro e in vivo para evaluar la actividad enzimática de S1 y/o PT, incluyendo la ribosilación con ADP de la transducina bovina (ref. 26), el ensayo de agrupamiento de células del ovario de hámster chino (CHO) (ref. 27), la sensibilización con histamina (ref. 28), la leucocitosis y la NAD glucohidrolasa. Cuando se exponen al PT, las células CHO desarrollan una morfología agrupada característica. Este fenómeno depende de la unión de PT y el posterior traslado y actividad de ADP-ribosiltransferasa de S1 y de este modo el ensayo de agrupamiento de células CHO se utiliza extensamente para probar la integridad y toxicidad de las holotoxinas del PT.
Hemoaglutinina filamentosa
La hemoaglutinina filamentosa es un polipéptido largo (220 kDa) inocuo que media en el acoplamiento de B. pertussis a células ciliadas del aparato respiratorio superior durante la colonización bacteriana (refs. 9, 29). La infección natural produce anticuerpos anti-HAF e inmunidad mediada por células (refs. 13, 15, 17, 30 y 31). Los anticuerpos anti-HAF se encuentran en el calostro humano y se transmiten también a través de la placenta (refs. 17, 18 y 19). La vacunación con vacunas contra la tos ferina con células completas o acelulares genera anticuerpos anti-HAF y vacunas acelulares que contienen HAF también provocan una respuesta IMC a HAF (refs. 20, 32). HAF es un antígeno protector en un modelo de prueba de provocación respiratorio en ratón después de la inmunización activa o pasiva (refs. 33, 34). Sin embargo, HAF solo no protege en el ensayo de potencia de la prueba de provocación intracerebral en el ratón (ref. 28).
Proteína de la membrana externa de 69 kDa (Pertactina)
La proteína de 69 kDa es una proteína de la membrana externa que fue identificada originalmente en B. bronchiseptica (ref. 35). Se demostró que es un antígeno protector contra B. bronchiseptica y se identificó posteriormente tanto en B. pertussis como en B. parapertussis. La proteína de 69 kDa se une directamente a células eucarióticas (ref. 36) y la infección natural con B. pertussis provoca una respuesta humoral anti-P.69 (ref. 14) y P.69 provoca también una respuesta inmunitaria mediada por células (refs. 17, 37, 38). La vacunación con vacunas de células completas o acelulares produce anticuerpos anti-P.69 (refs. 32, 39) y las vacunas acelulares producen P.69 IMC (ref. 39). La pertactina protege contra la prueba de provocación por aerosol con B. pertussis (ref. 40) y en combinación con HAF, protege en la prueba de provocación intracerebral contra B. pertussis (ref. 41). La transferencia pasiva de anticuerpos anti-P.69 policlonales o monoclonales también protege a los ratones contra la prueba de provocación por aerosol (referencia 42).
Aglutinógenos
Los serotipos de B. pertussis están definidos por sus fimbrias aglutinantes. La OMS recomienda que las vacunas de células completas incluyan aglutinógenos (Agg) de los tipos 1, 2 y 3 ya que no son protectores cruzados (ref. 43). Agg 1 no es fimbrial y se encuentra en todas las cepas de B. pertussis mientras que Agg de los serotipos 2 y 3 son fimbriales. La infección natural o la inmunización con vacunas de células completas o acelulares producen anticuerpos anti-Agg (refs. 15, 32). Una respuesta inmunitaria específica mediada por células puede generarse en ratones por Agg 2 y Agg 3 después de la infección con aerosol (ref. 17). Agg 2 y 3 son protectoras en ratones frente la prueba de provocación respiratoria y el calostro humano que contiene anti-aglutinógenos protegerá también en este ensayo (refs. 19, 44, 45).
Vacunas acelulares
La primera vacuna... [Seguir leyendo]
Reivindicaciones:
1. Utilización de la forma purificada de toxoide de la tos ferina, hemoaglutinina filamentosa, pertactina y aglutinógenos fimbriales de B. pertussis en la elaboración de una preparación de vacuna de combinación contra la enfermedad causada por B. pertussis, para la administración a una población humana en situación de riesgo de enfermedad causada por B. pertussis para proporcionar protección contra la enfermedad causada por B. pertussis en la que cada dosis humana única de la preparación de vacuna contiene los antígenos de tos ferina siguientes, a saber de 5 a 30 μg de nitrógeno de dicho toxoide de la tos ferina, 5 a 30 μg de nitrógeno de dicha hemoaglutinina filamentosa, 3 a 15 μg de nitrógeno de pertactina, y 1 a 10 μg de nitrógeno de aglutinógenos fimbriales 2 (Agg2) y 3 (Agg3) y en la que la relación en peso de Agg2 a Agg3 es de 1,5:1 a 2:1 y en la que dicha preparación de vacuna proporciona dicha protección contra la enfermedad causada por B. pertussis en por lo menos el 70% de los miembros de una población en situación de riesgo que se puede determinar por un ensayo de eficacia clínica y en la que dicha vacuna está sustancialmente exenta de aglutinógeno 1 fimbrial.
2. Utilización según la reivindicación 1, en la que dicha preparación de vacuna contiene por lo menos un inmunógeno distinto de Bordetella.
3. Utilización según cualquiera de las reivindicaciones anteriores, en la que dicha preparación de vacuna contiene:
(a) 10 μg de nitrógeno de toxoide de la tos ferina, 5 μg de nitrógeno de hemoaglutinina filamentosa, 3 μg de nitrógeno de aglutinógenos y 5 μg de nitrógeno de pertactina en una dosis humana única; o
(b) 20 μg de nitrógeno de toxoide de la tos ferina, 20 μg de nitrógeno de hemoaglutinina filamentosa, 3 μg de nitrógeno de aglutinógenos y 5 μg de nitrógeno de pertactina en una dosis humana única.
4. Utilización según cualquiera de las reivindicaciones anteriores, en la que la extensión de la protección es de por lo menos 80% para un caso de tos ferina que presenta una tos espasmódica de una duración de por lo menos 21 días y una infección bacteriana confirmada.
5. Utilización según cualquiera de las reivindicaciones anteriores, en la que la extensión de la protección es de por lo menos 70% para un caso de tos ferina leve que presenta una tos de por lo menos un día de duración.
6. Utilización según cualquiera de las reivindicaciones anteriores, en la que dicha preparación de vacuna incluye un adyuvante.
26 27
Patentes similares o relacionadas:
Composición inmunógena para uso en vacunación contra estafilococos, del 11 de Noviembre de 2019, de GLAXOSMITHKLINE BIOLOGICALS SA: Una composición inmunógena que comprende: - ClfA estafiloc ócico aislado o un fragmento inmunógeno del mismo; y - SitC estafilocócico aislado […]
Composiciones y métodos para mejorar la inmunogenicidad de los conjugados de polisacárido-proteína, del 23 de Octubre de 2019, de Kanvax Biopharmaceuticals Ltd: Un conjugado de polisacárido-proteína que comprende una proteína transportadora quimérica y un antígeno polisacárido, en donde la proteína […]
Composición inmunógena, del 24 de Julio de 2019, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una composición inmunógena que comprende sacárido capsular del serogrupo A de N. meningitidis (MenA), sacárido capsular del serogrupo C de […]
Vacuna monodosis con Mycoplasma hyopneumoniae, del 10 de Abril de 2019, de Zoetis Services LLC: Uso de una bacterina de Mycoplasma hyopneumoniae para la fabricación de una vacuna para el tratamiento o prevención de una enfermedad o trastorno […]
Virus de la gripe porcina modificado por ingeniería genética y usos de los mismos, del 18 de Diciembre de 2018, de Icahn School of Medicine at Mount Sinai: Un virus de la gripe porcina atenuado, modificado por ingeniería genética, en donde el virus comprende un gen de NS1 de virus de la gripe porcina con una mutación que produce […]
Composiciones inmunogénicas que comprenden Lawsonia intercellularis, del 7 de Noviembre de 2018, de BOEHRINGER INGELHEIM VETMEDICA, INC.: Una vacuna de combinación que comprende i) antígeno L. intracellularis eficaz para reducir la incidencia o disminuir la gravedad de la enteropatía proliferativa […]
Péptido que contiene múltiples sequones de glicosilación ligada a N, del 1 de Octubre de 2018, de THE GOVERNORS OF THE UNIVERSITY OF ALBERTA: Un péptido que comprende por lo menos dos repeticiones, preferiblemente nueve repeticiones, de la secuencia de aminoácidos como se establece en la SEQ ID NO: 1, en el que las […]
Composición inmunógena, del 24 de Enero de 2018, de GLAXOSMITHKLINE BIOLOGICALS S.A.: Una composición inmunógena que comprende un conjugado de sacárido Hib y al menos otros dos conjugados de sacárido bacteriano en la que el conjugado Hib está […]