VACUNA CONTRA LA ENFERMEDAD HEMORRÁGICA VIRAL DEL CONEJO.
Vacuna contra el virus de la enfermedad hemorrágica del conejo que comprende una cantidad inmunológicamente efectiva de las cepas de dicho virus las cuales están depositadas en la Colección Europea de Cultivos Celulares (ECACC),
CEPR, Porton Down, Salisbury, Wiltshire, SP4 0JG, UK, con los números de depósito RHDVLO1 07060601 y RHDVLO2 07060602, opcionalmente junto con un portador fisiológicamente aceptable
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E08075222.
Solicitante: LABORATORIOS OVEJERO, S.A.
Nacionalidad solicitante: España.
Inventor/es: OVEJERO GUISASOLA,JUAN IGNACIO.
Fecha de Publicación: .
Fecha Solicitud PCT: 27 de Marzo de 2008.
Fecha Concesión Europea: 6 de Octubre de 2010.
Clasificación Internacional de Patentes:
- A61K39/12 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos virales.
- C07K14/08 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Virus ARN.
- C12N7/00 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
Clasificación PCT:
- A61K39/12 A61K 39/00 […] › Antígenos virales.
- C07K14/08 C07K 14/00 […] › Virus ARN.
- C12N7/00 C12N […] › Virus, p. ej. bacteriófagos; Composiciones que los contienen; Su preparación o purificación (preparaciones de uso médico que contienen virus A61K 35/76; preparación de composiciones de uso médico que contienen antígenos o anticuerpos virales, p. ej. vacunas virales, A61K 39/00).
- C12Q1/70 C12 […] › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen virus o bacteriófagos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
30 1
La presente invención se refiere a nuevas cepas del virus de la enfermedad hemorrágica del conejo (RHDV), y a una vacuna para proteger a los conejos contra la enfermedad hemorrágica del conejo (RHD) que contiene estas nuevas cepas. La invención también concierne a un proceso para la preparación de dicha vacuna.
ANTECEDENTES DE LA TÉCNICA
En la República Popular de China, se observaron en 1984 brotes de una enfermedad vírica aparentemente nueva aguda fatal y altamente contagiosa en los conejos. Las principales características epidemiológicas fueron un rápido contagio y mortalidad temprana. Los signos patológicos característicos fueron hemorragias en el sistema respiratorio, hígado, bazo, músculo cardiaco, y ocasionalmente en los riñones.
En varios países europeos, africanos y americanos se describieron también la aparición de brotes de una enfermedad que mostraba signos clínicos similares a los referidos en China. Hay informes documentados de Italia, Alemania, Francia y España.
El agente causal de la enfermedad es el virus denominado virus de la enfermedad hemorrágica del conejo (RHDV). Este virus se aisló por primera vez y de manera simultánea en España (Parra, F. y Prieto, M., 1990, J. Virology, 64:40134015) y Alemania (Ohlinger, V.F. et al., 1990, J. Virology, 64:33313336). El RHDV tiene un tamaño de 40 nm, sin envuelta y con ARN monocatenario como material genético. En base a los datos morfológicos, inicialmente se clasificó como pircornavirus (Pu, B. et al., 1985, Chin. J. Vet. Med. 11:1617) y parvovirus (Xu et al., 4th World Rabbit Congress (Cuarto Congreso Mundial de Cunicultura), supra). No obstante, de acuerdo con la información relativa al tamaño, densidad, morfología y estructura molecular del virión, se ha clasificado definitivamente como calicivirus.
La enfermedad afecta principalmente a conejos adultos. Las crías jóvenes y los conejos de engorde parecen tener una protección natural.
El periodo de incubación es de 2 a 3 días; la tasa de mortalidad es superior al 90%. Todos los conejos son susceptibles de infectarse con RHDV, pero los signos clínicos se observan normalmente sólo en aquellos animales de 40 a 50 días de edad. Habitualmente, los conejos infectados desarrollan fiebre y mueren repentinamente dentro de 12 a 36 horas de la aparición de los síntomas. En algunos casos, los únicos síntomas son chillidos terminales seguidos rápidamente de colapso y muerte. También se observa embotamiento, anorexia, congestión de la conjuntiva palpebral, o postración. Ocasionalmente, los animales desarrollan signos neurológicos incluyendo descoordinación, excitación, opistótonos, y movimientos acompasados de las
extremidades. Algunos conejos dan vueltas y se abalanzan rápidamente en sus jaulas; esto puede considerarse convulsiones o manía. En algunas ocasiones, se ha observado la aparición de síntomas respiratorios incluyendo disnea, y una descarga nasal espumosa sanguinolenta en la parte terminal. Aproximadamente del 5% al 10% de los animales experimentan un curso más crónico con ictericia severa, letargo, y pérdida de peso, y muerte dentro de una a dos semanas.
10 Tras el primer brote de la enfermedad en China, en 1984, los servicios veterinarios chinos pudieron controlar dicha enfermedad mediante el uso exhaustivo de una vacuna inactivada con formalina producida a partir de los tejidos de conejos infectados.
15 Se han identificado diferentes cepas conocidas del virus: aislado “España”, aislado “Chequia”, aislado “Alemania”, aislado “China”, y aislado “Iowa”. El aislado español, AST/89, está descrito en J. Cien. Virol., vol 75, 1994; páginas 24092413.
La morfología del virus revela que los viriones tienen una cápside, sin envuelta, redonda con simetría icosaédrica. Esta cápside isométrica tiene un diámetro de 3539 nm, que parece redonda o hexagonal de perfil. La estructura superficial de la cápside revela un patrón regular con particularidades distintivas, en donde la distribución de los capsómeros es claramente visible, y la cápside posee 32 depresiones en forma de copa.
25 El genoma del virus no está segmentado y consiste en una única molécula de ARN lineal, monocatenario, de sentido positivo que codifica proteínas estructurales. Los viriones constan de una única proteína estructural localizada en la cápside.
Actualmente, existen varias vacunas comerciales, conocidas como vacunas tisulares, basadas en el uso de extractos obtenidos de los órganos de conejos experimentalmente infectados, en los que el agente virulento ha sido inactivado térmica o químicamente. La eficiencia de estas preparaciones ha sido ensayada en laboratorio (J.E. Peeters, D. Vandergheynst y R. Geeroms. 1992. CuniSciences 7:101106) y en el campo, pero presentan serios inconvenientes relativos a la variabilidad antigénica y al riesgo biológico debidos a su modo de elaboración.
Vacuna Laboratorio Composición por dosis CYLAP® HVD Fort Dodge Veterinaria Virus inactivado de la enfermedad hemorrágica del conejo, ≥ 5.120 uHA. Dosis: 1 mL. CUNIPRAVACRHD Hipra Virus inactivado de la enfermedad hemorrágica del conejo. Dosis: 0,5 mL DERCUNIMIX Merial Laboratorios, S.A. Virus homólogo de la mixomatosis, DICT50 ≥ 102,7; Virus inactivado de la enfermedad hemorrágica del conejo, DP90 ≥ 5. Dosis: 0,2 mL.A pesar de los estudios de investigación antes descritos referentes a la producción de una vacuna contra la RHD todavía existe una necesidad por obtener una solución eficaz que facilite la 5 producción de una vacuna marcada.
SUMARIO DE LA INVENCIÓN
La presente invención se refiere a nuevas cepas del virus causal de la enfermedad 10 hemorrágica del conejo (RHDV), y a su uso en la preparación de una vacuna contra dicha enfermedad.
Por tanto, según un aspecto de la presente invención, se proporciona dos nuevas cepas aisladas del RHDV, las cuales se han depositado en la Colección Europea de Cultivos Celulares (ECACC), CEPR, Porton Down, Salisbury, Wiltshire, SP4 0JG, UK, de conformidad con las condiciones del Tratado de Budapest sobre el Reconocimiento Internacional del Depósito de Microorganismos a los fines del Procedimiento en Materia de Patentes (1977), y se las ha asignado los números de depósito RHDVLO1 07060601 y RHDVLO2 07060602, con fecha de depósito el 6 de junio de 2007.
20 Estos nuevos virus han sido designados por los inventores como LO1 y LO2 respectivamente, por cuya razón se aplicarán indiscriminadamente los términos RHDVLO1 07060601 y LO1, y RHDVLO2 07060602 y LO2 a lo largo de la presente descripción.
De acuerdo con otro aspecto, la invención proporciona una vacuna contra la enfermedad hemorrágica del conejo que comprende los virus con los números de depósito RHDVLO1 0706060 y RHDVLO2 07060602.
5 Un aspecto adicional de la presente invención está relacionado con el uso de dichas cepas del RHDV en la preparación de vacunas inmunizantes contra una infección viral causada por un RHDV, en donde la composición comprende una cantidad inmunológicamente efectiva de las cepas LO1 y LO2 y un portador fisiológicamente aceptable. Opcionalmente, la composición incluye un adyuvante. Las cepas RHD pueden estar totalmente inactivadas.
10 Según otro aspecto, la invención proporciona el uso de las cepas RHDVLO1 07060601 y RHDVLO2 07060602 del RHDV en la preparación de una vacuna inmunizante contra una infección viral causada por un virus de la enfermedad hemorrágica del conejo.
15 Según otro aspecto, la invención proporciona el uso de las cepas RHDVLO1 07060601 y RHDVLO2 07060602 inactivadas de la enfermedad hemorrágica del conejo en la fabricación de un medicamento que induzca inmunidad en un mamífero susceptible a la infección con el virus de la enfermedad hemorrágica del conejo.
20 En otro aspecto, la invención proporciona el uso de una mezcla pura homogénea inmunológicamente efectiva de las cepas RHDVLO1 07060601 y RHDVLO2 07060602 del virus de la enfermedad hemorrágica del conejo en la preparación de una vacuna inmunizante contra una infección viral causada por un virus de la enfermedad hemorrágica del conejo.
25 En un aspecto adicional, la invención proporciona un método de preparación de la vacuna como se ha definido anteriormente, que comprende: a) La mezcla de una cantidad inmunológicamente efectiva de las cepas del virus de la enfermedad hemorrágica...
Reivindicaciones:
1. Vacuna contra el virus de la enfermedad hemorrágica del conejo que comprende una cantidad inmunológicamente efectiva de las cepas de dicho virus las cuales están depositadas en la Colección Europea de Cultivos Celulares (ECACC), CEPR, Porton Down, Salisbury, Wiltshire, SP4 0JG, UK, con los números de depósito RHDVLO1 07060601 y RHDVLO2 07060602, opcionalmente junto con un portador fisiológicamente aceptable.
2. La vacuna según la reivindicación 1, que incluye un adyuvante seleccionado entre 10 hidróxido de aluminio, aceite mineral incompleto o mezclas de los mismos.
3. La vacuna según cualquiera de las reivindicaciones 12, caracterizada en que ambas cepas del virus de la enfermedad hemorrágica del conejo están químicamente inactivadas.
4. La vacuna según la reivindicación 3, en donde la inactivación química se lleva a cabo mediante el tratamiento del virus con un agente químico inactivante seleccionado entre [beta]propiolactona y formaldehído.
5. La vacuna según cualquiera de las reivindicaciones 14, caracterizada en que la proporción de la mezcla de cada uno de los virus de la vacuna fue de 128 uHA/dosis o superior para la cepa LO1 07060601, y de 128 uHA/dosis o superior para la cepa LO2 07060602 del virus RHD.
6. La vacuna según cualquiera de las reivindicaciones 15, caracterizada en que los virus 25 presentes en la vacuna están en una proporción comprendida entre 1:10 y 10:1.
7. La vacuna según cualquiera de las reivindicaciones 16, caracterizada en que los virus presentes en la vacuna están en una proporción comprendida entre 1:6 y 6:1.
8. La vacuna según cualquiera de las reivindicaciones 17, en donde los virus presentes en la vacuna están en una proporción de 1:1.
9. La vacuna según cualquiera de las reivindicaciones 18, caracterizada en que comprende una mezcla sustancialmente homogénea de las cepas RHDVLO1 07060601 y
35 RHDVLO2 07060602 del virus de la enfermedad hemorrágica del conejo que no está contaminada con más del 10% de otro aislado de dicho virus.
10. La vacuna según cualquiera de las reivindicaciones 19, caracterizada en que comprende una mezcla pura homogénea de las cepas RHDVLO1 07060601 y RHDVLO2 07060602 del virus de la enfermedad hemorrágica del conejo.
11. La vacuna según cualquiera de las reivindicaciones 110, caracterizada en que contiene una dosis viral efectiva que está dentro de un rango de 128 y 512 uHA/dosis.
12. El uso de una cepa del virus de la enfermedad hemorrágica del conejo que tiene una secuencia de nucleótidos descrita en SEQ.ID.NO:1 en la preparación de una vacuna inmunizante contra una infección viral causada por un virus de la enfermedad hemorrágica del conejo.
13. El uso de una cepa del virus de la enfermedad hemorrágica del conejo que tiene una
secuencia de nucleótidos descrita en SEQ.ID.NO:2 en la preparación de una vacuna inmunizante 15 contra una infección viral causada por un virus de la enfermedad hemorrágica del conejo.
14. El uso de una cepa inactivada del virus de la enfermedad hemorrágica del conejo que tiene una secuencia de nucleótidos descrita en SEQ.ID.NO:1 y de una cepa inactivada del virus de la enfermedad hemorrágica del conejo que tiene una secuencia de nucleótidos descrita en SEQ.ID.NO:2 en la fabricación de un medicamento que induzca inmunidad en un mamífero susceptible a la infección con el virus de la enfermedad hemorrágica del conejo.
15. El uso de una mezcla pura homogénea inmunológicamente efectiva de la cepa del virus de la enfermedad hemorrágica del conejo con la secuencia de nucleótidos descrita en SEQ.ID.NO:1 y la cepa inactivada del virus de la enfermedad hemorrágica con la secuencia de nucleótidos descrita en SEQ.ID.NO:2 en la preparación de una vacuna inmunizante contra una infección viral causada por un virus de la enfermedad hemorrágica del conejo.
16. Un método de preparación de la vacuna según cualquiera de las reivindicaciones 130 11, que comprende:
a) la mezcla de una cantidad inmunológicamente efectiva de las cepas del virus de la enfermedad hemorrágica del conejo las cuales están depositadas en la Colección Europea de Cultivos Celulares (ECACC), CEPR, Porton Down, Salisbury, Wiltshire, SP4 0JG, UK, con los números de depósito RHDVLO1 07060601 y RHDVLO2 07060602; b) la inactivación química opcional de las cepas del virus; y c) adyuvantación del producto final.
17. El método según la reivindicación 16, que comprende la inactivación química de las cepas del virus.
18. El método según la reivindicación 17, en donde la inactivación química se lleva a cabo mediante el tratamiento del virus con un agente químico inactivante seleccionado entre [beta]propiolactona y formaldehído.
19. Una cepa del virus de la enfermedad hemorrágica del conejo que está depositada en la Colección Europea de Cultivos Celulares (ECACC), CEPR, Porton Down, Salisbury, Wiltshire, SP4 0JG, UK, con el número de depósito RHDVLO1 07060601.
20. Una cepa del virus de la enfermedad hemorrágica del conejo que está depositada en la
Colección Europea de Cultivos Celulares (ECACC), CEPR, Porton Down, Salisbury, Wiltshire, 15 SP4 0JG, UK, con el número de depósito RHDVLO2 07060602.
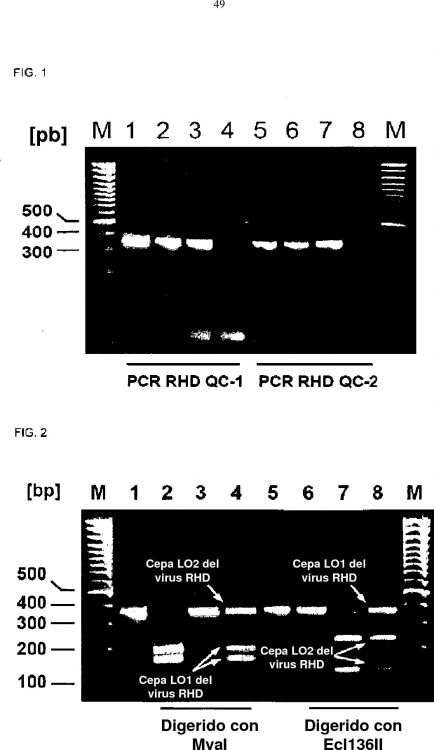
21. Un método para detectar y diferenciar las cepas atenuadas del virus RHD en una vacuna que tienen unas secuencias de nucleótidos descritas en SEQ.ID.NO:1 y SEQ.ID.NO:2, el cual comprende:
20 a) someter el ADN genómico de una muestra de la vacuna RHD a análisis de secuencias por medio de RTPCR y confirmar que este ADN genómico de dicha muestra de la vacuna RHD contiene el producto PCR específico de 359 pb y 371 pb; b) digerir el producto PCR con las endonucleasas de restricción Mval y EcI136ll; c) confirmar mediante análisis del polimorfismo de longitud de fragmentos de restricción la presencia de una secuencia de reconocimiento para Mval en la posición 2662 pero no para Ecl136II en la posición 2115 para la cepa LO1 del virus RHD que tiene una secuencia de nucleótidos descrita en SEQ.ID.NO:1, y una secuencia de reconocimiento para Ecl136II en la posición 2115 pero no para Mval en la posición 2662 para la cepa LO2 del virus RHD que tiene una secuencia de nucleótidos descrita en SEQ.ID.NO:2.
22. El método según la reivindicación 21, en donde el paso a) de la RTPCR se lleva a cabo utilizando los cebadores siguientes: i) un par de cebadores de SEQ.ID.NO: 3 y SEQ.ID.NO: 4 que son los cebadores upstream y downstream respectivamente para la detección de LO1; ii) un par de cebadores de SEQ.ID.NO: 7 y SEQ.ID.NO: 8 que son los cebadores upstream y downstream respectivamente para la detección de LO2.
23. El método según cualquiera de las reivindicaciones 2122, en donde el par de cebadores i) e ii) amplifican dos fragmentos internos del genoma del virus RHD abarcando, cada uno de ellos, uno de los dos desapareamientos existentes entre la secuencia genética de LO1 y la de LO2 en la posición 2115 y 2662 respectivamente.
Patentes similares o relacionadas:
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Señal para el empaquetamiento de vectores del virus de la gripe, del 24 de Junio de 2020, de WISCONSIN ALUMNI RESEARCH FOUNDATION: Un vector del virus de la gripe para la expresión y empaquetamiento de ARNv recombinante, en el que el vector comprende: secuencias correspondientes […]
Nueva especie de tobamovirus, del 17 de Junio de 2020, de Nunhems B.V: Un tobamovirus cuyo genoma comprende al menos 83% de identidad de secuencia con la SEQ ID NÚM.: 1 y en el que el virus causa síntomas sistémicos en plantas homocigotas […]
Vectores de AAV dirigidos a oligodendrocitos, del 10 de Junio de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un ácido nucleico que codifica una cápside de AAV, comprendiendo el ácido nucleico una secuencia codificante de la cápside de AAV que es al menos el 96 % idéntica […]
Métodos para la transducción y el procesamiento de células, del 27 de Mayo de 2020, de Juno Therapeutics, Inc: Un método de transducción, que comprende incubar, en una cavidad interna de una cámara de centrífuga, una composición de entrada que comprende células y partículas […]
Composiciones para tratar MPSI, del 22 de Abril de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector que lleva un casete de expresión que comprende un gen de la alfa-L-iduronidasa humana (hIDUA) que tiene la secuencia de nucleótidos de SEQ ID NO: […]
Métodos mejorados para producir terapias celulares adoptivas, del 22 de Abril de 2020, de Bluebird Bio, Inc: Un método in vitro para producir un producto terapéutico de células T que comprende: a) proporcionar una población de células mononucleares […]
Nuevo bacteriófago y composición que comprende el mismo, del 25 de Marzo de 2020, de CJ CHEILJEDANG CORPORATION: Un bacteriófago ΦCJ25 (KCCM11463P) que tiene una capacidad específica para matar Escherichia coli patógena aviar.