Uso de polisacáridos para la estimulación de la actividad enzimática.
Un procedimiento para la estimulación de la actividad enzimática de una enzima diana,
en que el procedimiento comprende:
(i) combinar una enzima diana, en que la enzima diana es:
(a) una enzima de oligosacáridos/polisacáridos seleccionada del grupo que consta de: galactosiltransferasa, GalNAc-transferasa, oligosacariltransferasa, N-acetilglucosaminilfosfotransferasa, O-glucosiltransferasa, N-glucosiltransferasa, α-manosidasa, ß-galactosidasa, sialidasa (neuraminidasa), ß-N-acetilhexosaminidasa, N-10 acetilglucosamina-1-fosfodiéster-α-N-acetilglucosaminidasa, N-glucanasa (N-glucosidasa F), O-glucanasa (endo-α-N-acetilgalactosaminidasa), endo-ß-N-acetilglucosaminidasa H, sialato-O-acetiltransferasa, sialato-O-acetilesterasa y α-glucosidasa o
(b) una hidrolasa lisosómica seleccionada del grupo que consta de: α-galactosidasa A, ceramidasa ácida, α-L-15 fucosidasa ácida, ß-glucocerebrosidasa ácida (GCR), ß-galactosidasa ácida, iduronato-2 sulfatasa, α-L-iduronidasa, galactocerebrosidasa, α-manosidasa ácida, ß-manosidasa ácida, arilsulfatasa B, arilsulfatasa A, N-acetilgalactosamina-6-sulfatosulfatasa, ß-galactosidasa ácida, esfingomielinasa ácida, α-glucosidasa ácida, ß-hexosaminidasa B, heparán-N-sulfatasa, α-N-acetilglucosaminidasa, acetil-CoA: α-glucosaminido-N-acetiltransferasa, N-acetilglucosaminina-6-sulfatosulfatasa, α-N-acetilgalactosaminidasa, sialidasa, ß-glucuronidasa y ß-hexosaminidasa A;
con de aproximadamente el 1 % a aproximadamente el 50 % p/v de un hidroxialquilalmidón y con un sustrato de la enzima diana, con lo que se produce una combinación; y
(ii) mantener la combinación en condiciones suficientes para estimular la actividad enzimática de la enzima diana, en que las condiciones son entre aproximadamente 1 °C y aproximadamente 40 °C.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/021092.
Solicitante: GENZYME CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 500 KENDALL STREET CAMBRIDGE, MA 02142-1108 ESTADOS UNIDOS DE AMERICA.
Inventor/es: RISKE,Frank, HAYES,Michael, LAZARUS,Gary.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/47 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que actúan sobre compuestos glicosílicos (3.2), p. ej. celulosas, lactasas.
- C08L3/08 QUIMICA; METALURGIA. › C08 COMPUESTOS MACROMOLECULARES ORGANICOS; SU PREPARACION O PRODUCCION QUIMICA; COMPOSICIONES BASADAS EN COMPUESTOS MACROMOLECULARES. › C08L COMPOSICIONES DE COMPUESTOS MACROMOLECULARES (composiciones basadas en monómeros polimerizables C08F, C08G; pinturas, tintas, barnices, colorantes, pulimentos, adhesivos D01F; filamentos o fibras artificiales D06). › C08L 3/00 Composiciones de almidón, amilosa o amilopectina o de sus derivados o productos de degradación. › Eteres.
- C12N9/24 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre compuestos glicosílicos (3.2).
- C12N9/36 C12N 9/00 […] › actúan sobre los enlaces beta-1,4 del ácido N-acetilmurámico con aceitilamino-2 deoxi-2-D-glucosa, p. ej. lisozima.
- C12N9/38 C12N 9/00 […] › actúan sobre los enlaces beta-galactosa-glicósido, p. ej. beta-galactosidasa.
- C12N9/96 C12N 9/00 […] › Estabilización de una enzima por formación de un aducto o de una composición; Formación de conjugaciones de enzimas.
PDF original: ES-2386972_T3.pdf
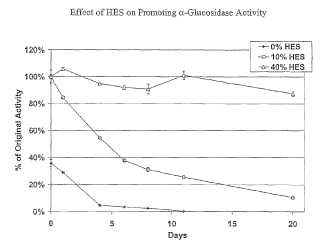
Fragmento de la descripción:
Uso de polisacáridos para la estimulación de la actividad enzimática.
CAMPO DE LA INVENCIÓN
Esta descripción se refiere a composiciones y procedimientos para la estimulación de la actividad enzimática mediante el uso de un polisacárido, incluido, pero sin limitarse a hidroxietilalmidón. Además, esta descripción se refiere a procedimientos para la preparación de proteínas, en que los procedimientos implican el uso de enzimas. Además, esta descripción se refiere a procedimientos para la preparación y/o formulación de enzimas y otras biomoléculas.
ANTECEDENTES DE LA INVENCIÓN
Las enzimas tienen utilidad en numerosas aplicaciones industriales. Por ejemplo, las enzimas se usan ampliamente en la industria de los detergentes (por ejemplo, amilasas y proteasas alcalinas bacterianas) , la industria de los zumos de frutas y hortalizas (por ejemplo, pectinasas y xilanasas) , la industria cárnica (por ejemplo, xilanasas, fitasas, β-glucanasa) , la industria del almidón (por ejemplo, amilasas) , la industria de la pulpa y el papel (por ejemplo, xilanasas) , la industria textil (por ejemplo, celulasas, polifenoloxidasas, amilasas, xilanasas y catalasas) y la industria del cuero (por ejemplo, proteasas y lipasas) (Cherr y y col., Curr. Opin. Biotechnol. 14: 438 – 443 (2003) ) .
También existe una serie de usos médicos y terapéuticos de enzimas y de los ácidos nucleicos que las codifican, incluido el tratamiento de sustitución enzimática (TSE) . En el tratamiento de sustitución enzimática, un paciente que presenta una deficiencia en la actividad de una enzima se trata por administración de la enzima que falta o es disfuncional (una “enzima de TSE”) . Las enzimas de TSE son útiles en el tratamiento de numerosas enfermedades. Por ejemplo, ciertos trastornos de almacenamiento lisosómico (TAL) pueden tratarse eficazmente mediante la administración de una enzima de TSE.
Otros ejemplos de enzimas de sustitución de importancia médica son la lactasa para la intolerancia a la lactosa y la sustitución de enzimas pancreáticas para el tratamiento de individuos con insuficiencia pancreática, incluida la insuficiencia pancreática debida a fibrosis cística (Wallace y col., Clin. Pharm. 12: 657 – 674 (1993) ) .
Los procedimientos para la estimulación de la actividad enzimática tendrían un valor significativo en numerosas industrias. Con respecto a la preparación de proteínas terapéuticas, en particular aquellas para el uso humano o veterinario, generalmente es deseable el uso de componentes que no son de origen animal (non-ADC) . Por lo tanto, existe en particular la necesidad de proporcionar nuevos procedimientos y composiciones para estimular la actividad de enzimas con componentes de origen no animal para diversas aplicaciones.
Vrkljan y col., Pharmaceutical Research, vol. 11, n° 7, 1994, páginas 1004 – 1008 describen el efecto de aditivos poliméricos sobre la agregación termoinducida de uroquinasa de bajo peso molecular.
RESUMEN DE LA INVENCIÓN
La presente descripción proporciona una composición que comprende (a) una enzima diana y (b) un polisacárido de origen no natural. La enzima diana puede ser, por ejemplo, una enzima de oligosacáridos/polisacáridos (es decir, una enzima que actúa sobre oligosacárido (s) /polisacárido (s) ) , una enzima de proteínas (es decir, una enzima que actúa sobre proteína (s) , como cinasas, fosforilasas) , una enzima de polinucleótidos (es decir, una enzima que actúa sobre polinucleótido (s) ) u otras enzimas de importancia industrial o médica, incluidas lipasas y similares. La enzima diana puede estar en disolución o inmovilizada sobre un soporte sólido.
En algunos casos, el polisacárido de origen no natural es un almidón modificado. Por ejemplo, el polisacárido de origen no natural puede ser un hidroxialquilalmidón, incluido, pero sin limitarse a hidroxietilalmidón (HES) . El polisacárido de origen no natural puede estar presente en una cantidad de aproximadamente el 0, 01 al 55 % p/v, de aproximadamente el 0, 1 % al 50 % p/v, de aproximadamente el 1 % al 50 % p/v, de aproximadamente el 5 % al 40 % p/v, de aproximadamente el 10 % al 40 % p/v, de aproximadamente el 15 % al 35 % p/v, de aproximadamente el 20 % al 30 % p/v, de aproximadamente el 0, 01 % a aproximadamente el 15 % p/v, de aproximadamente el 0, 1 % al 15 % p/v, de aproximadamente el 1 % al 10 % p/v, de aproximadamente el 5 % al 15 % p/v, de aproximadamente el 3 % al 7 % p/v o de aproximadamente el 4 % al 6 % p/v.
En este documento se describe también una composición que comprende (a) una enzima diana seleccionada del grupo que consta de enzimas de oligosacáridos/polisacáridos, enzimas de proteínas, enzimas de polinucleótidos y otras enzimas de importancia industrial o médica, (b) un polisacárido de origen no natural y (c) un sustrato de la enzima diana, en que la composición comprende de aproximadamente el 0, 01 % al 55 % p/v, de aproximadamente el 0, 1 % al 50 % p/v, de aproximadamente el 1 % al 50 % p/v, de aproximadamente el 5 % al 40 % p/v, de aproximadamente el 10 % al 40 % p/v, de aproximadamente el 15 % al 35 % p/v, de aproximadamente el 20 % al 30 % p/v, de aproximadamente el 0, 01 % a aproximadamente el 15 % p/v, de aproximadamente el 0, 1 % al 15 % p/v, de aproximadamente el 1 % al 10 % p/v, de aproximadamente el 5 % al 15 % p/v, de aproximadamente el 3 % al 7 % p/v o de aproximadamente el 4 % al 6 % p/v del polisacárido. El sustrato puede ser, por ejemplo, una proteína, un péptido, un polinucleótido, un nucleótido o una molécula pequeña sustrato de la enzima diana. En algunos casos específicos, el sustrato mismo de la enzima diana es una enzima, incluida, pero sin limitarse a una enzima de TSE, como una hidrolasa lisosómica.
En otros casos específicos, la descripción proporciona una composición en la que la enzima diana es una enzima de escisión de oligosacáridos, el polisacárido es HES y el sustrato es una glucoproteína. En otros casos ilustrativos, la enzima diana es β-glucocerebrosidasa, α-glucosidasa, α-galactosidasa, sialidasa, β-galactosidasa, βN-hexosaminidasa (por ejemplo, β-N-acetilhexosaminidasa) o laronidasa.
La descripción se dirige también a procedimientos para la estimulación de la actividad enzimática de una enzima diana. En un caso, el procedimiento comprende combinar una enzima diana con de aproximadamente el 0, 01 al 55 % p/v, de aproximadamente el 0, 1 % al 50 % p/v, de aproximadamente el 1 % al 50 % p/v, de aproximadamente el 5 % al 40 % p/v, de aproximadamente el 10 % al 40 % p/v, de aproximadamente el 15 % al 35 % p/v, de aproximadamente el 20 % al 30 % p/v, de aproximadamente el 0, 01 % a aproximadamente el 15 % p/v, de aproximadamente el 0, 1 % al 15 % p/v, de aproximadamente el 1 % al 10 % p/v, de aproximadamente el 5 % al 15 % p/v, de aproximadamente el 3 % al 7 % p/v o de aproximadamente el 4 % al 6 % de un polisacárido de origen no natural, con lo que se produce una combinación; y mantener la combinación en condiciones suficientes para estimular la actividad enzimática de la enzima diana.
La descripción también se dirige al uso de un polisacárido de origen no natural para la estimulación no criogénica de la actividad de una enzima en medio líquido, en que la concentración del polisacárido en la composición es de aproximadamente el 0, 01 al 55 % p/v, de aproximadamente el 0, 1 % al 50 % p/v, de aproximadamente el 1 % al 50 % p/v, de aproximadamente el 5 % al 40 % p/v, de aproximadamente el 10 % al 40 % p/v, de aproximadamente el 15 % al 35 % p/v, de aproximadamente el 20 % al 30 % p/v, de aproximadamente el 0, 01 % a aproximadamente el 15 % p/v, de aproximadamente el 0, 1 % al 15 % p/v, de aproximadamente el 1 % al 10 % p/v, de aproximadamente el 5 % al 15 % p/v, de aproximadamente el 3 % al 7 % p/v o de aproximadamente el 4 % al 6 %.
La descripción se dirige además a formulaciones enzimáticas (incluidas formulaciones líquidas y formulaciones reconstituidas) que comprenden un polisacárido de origen no natural.
La descripción se dirige además a composiciones farmacéuticas que comprenden enzimas diana cuya actividad ha sido estimulada por un polisacárido de origen no natural.
Sobre la base de la descripción contenida en este documento, la presente invención proporciona un procedimiento para la estimulación de la actividad enzimática de una enzima diana, en que el procedimiento comprende:
... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para la estimulación de la actividad enzimática de una enzima diana, en que el procedimiento comprende:
(i) combinar una enzima diana, en que la enzima diana es:
(a) una enzima de oligosacáridos/polisacáridos seleccionada del grupo que consta de: galactosiltransferasa, GalNAc-transferasa, oligosacariltransferasa, N-acetilglucosaminilfosfotransferasa, O-glucosiltransferasa, Nglucosiltransferasa, α-manosidasa, β-galactosidasa, sialidasa (neuraminidasa) , β-N-acetilhexosaminidasa, Nacetilglucosamina-1-fosfodiéster-α-N-acetilglucosaminidasa, N-glucanasa (N-glucosidasa F) , O-glucanasa (endo-αN-acetilgalactosaminidasa) , endo-β-N-acetilglucosaminidasa H, sialato-O-acetiltransferasa, sialato-O-acetilesterasa y α-glucosidasa o
(b) una hidrolasa lisosómica seleccionada del grupo que consta de: α-galactosidasa A, ceramidasa ácida, α-Lfucosidasa ácida, β-glucocerebrosidasa ácida (GCR) , β-galactosidasa ácida, iduronato-2 sulfatasa, α-L-iduronidasa, galactocerebrosidasa, α-manosidasa ácida, β-manosidasa ácida, arilsulfatasa B, arilsulfatasa A, Nacetilgalactosamina-6-sulfatosulfatasa, β-galactosidasa ácida, esfingomielinasa ácida, α-glucosidasa ácida, βhexosaminidasa B, heparán-N-sulfatasa, α-N-acetilglucosaminidasa, acetil-CoA: α-glucosaminido-Nacetiltransferasa, N-acetilglucosaminina-6-sulfatosulfatasa, α-N-acetilgalactosaminidasa, sialidasa, β-glucuronidasa y β-hexosaminidasa A;
con de aproximadamente el 1 % a aproximadamente el 50 % p/v de un hidroxialquilalmidón y con un sustrato de la enzima diana, con lo que se produce una combinación; y
(ii) mantener la combinación en condiciones suficientes para estimular la actividad enzimática de la enzima diana, en que las condiciones son entre aproximadamente 1 °C y aproximadamente 40 °C.
2. El procedimiento de la reivindicación 1, en el que el hidroxialquilalmidón se selecciona del grupo que consta de hidroximetilalmidón, hidroxietilalmidón (HES) , hidroxipropilalmidón e hidroxibutilalmidón.
3. El procedimiento de la reivindicación 2, en el que el hidroxialquilalmidón es hidroxietilalmidón (HES) .
4. El procedimiento de una cualquiera de las reivindicaciones 1 a 3, en que el sustrato es una hidrolasa lisosómica.
5. El procedimiento de la reivindicación 1, en el que la enzima diana se selecciona del grupo que consta de: sialidasa, β-galactosidasa, β-N-acetilhexosaminidasa y una combinación de estas; en que el polisacárido de origen no natural es HES; y en que el sustrato es β-glucocerebrosidasa.
6. El procedimiento de una cualquiera de las reivindicaciones 1 a 5, en el que el procedimiento comprende además permitir a la enzima diana modificar el sustrato para producir un sustrato modificado y recuperar el sustrato modificado.
7. El procedimiento de la reivindicación 1, en el que la enzima diana es una combinación de sialidasa, βgalactosidasa y β-hexosaminidasa; y en que el almidón de origen no natural es HES, que está presente en una cantidad de entre aproximadamente el 1 % y aproximadamente el 12 % p/v.
8. El procedimiento de la reivindicación 1, en el que las condiciones comprenden además un tampón de citrato y cloruro de calcio a un pH de aproximadamente 6.
Patentes similares o relacionadas:
Composiciones para la supresión de la formación de inhibidores contra el factor VIII en pacientes con hemofilia A., del 22 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Una composición que comprende material vegetal liofilizado que comprende al menos un fragmento de FVIII conjugado con la subunidad B de la toxina […]
Composiciones farmacéuticas para uso tópico basadas en ácido hialurónico sulfatado como promotor de absorción de la piel, del 1 de Julio de 2020, de FIDIA FARMACEUTICI S.P.A.: Una composición farmacéutica para uso tópico que contiene ácido hialurónico sulfatado como promotor de absorción de la piel de diclofenaco, ketoprofeno, ibuprofeno […]
Compuestos para el tratamiento de Trastornos Neuropsiquiátricos, del 24 de Junio de 2020, de Curemark LLC: Una composición que comprende enzimas digestivas para uso en el tratamiento del Trastorno Esquizofreniforme, en donde las enzimas digestivas comprenden amilasa, lipasa […]
Tratamiento de glucogenosis de tipo II, del 20 de Mayo de 2020, de DUKE UNIVERSITY: α-Glucosidasa ácida (GAA) humana recombinante producida en un cultivo de células de ovario de hámster chino para uso en un método de tratamiento de glucogenosis […]
Reticuladores químicos, del 22 de Abril de 2020, de AMICUS THERAPEUTICS, INC: Un método de realización de un péptido de direccionamiento lisosomal modificado que comprende: a. poner en contacto el factor de crecimiento similar […]
Regímenes de dosificación para el tratamiento de la enfermedad de Fabry, del 22 de Abril de 2020, de AMICUS THERAPEUTICS, INC: 1-desoxigalactonojirimicina para su uso en el tratamiento de enfermedad de Fabry, en donde el tratamiento comprende administrar a un paciente desde aproximadamente 50 mg hasta […]
Proteína, del 18 de Diciembre de 2019, de Dupont Nutrition Biosciences ApS: Un polipéptido aislado que presenta actividad de xilanasa, seleccionado del grupo que consiste en: (a) un polipéptido que comprende una secuencia de aminoácido que tiene […]
Composiciones de alfa-galactosidasa, del 18 de Diciembre de 2019, de PROTALIX LTD. (100.0%): Una proteína α-galactosidasa humana que comprende una glicina como el resto N-terminal en donde dicha proteína α-galactosidasa humana se fusiona traduccionalmente […]