USO DE LINEAS CELULARES ALOGENICAS PARA CARGAR CELULAS QUE PRESENTAN ANTIGENOS PARA ELICITAR RESPUESTAS INMUNES.
Uso de células dendríticas para preparar una composición farmacéutica para inducir una respuesta inmune citotóxica específica para un tumor en un paciente humano que presenta un tumor,
donde dichas células dendríticas se preparan in vitro mediante
(a) co-incubación de células dendríticas de dicho paciente con células tumorales humanas, alogénicas, apoptóticas, para formas células dendríticas cargadas,
donde dichas células tumorales alogénicas poseen al menos un antígeno compartido entre las células tumorales alogénicas y las células tumorales de dicho paciente, y
donde dicha respuesta inmune citotóxica está dirigida contra dicho antígeno tumoral compartido para causar rechazo del tumor
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US00/28670.
Solicitante: BAYLOR RESEARCH INSTITUTE.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: SUITE 125, 3434 LIVE OAK STREET,DALLAS, TX 75206.
Inventor/es: BANCHEREAU,JACQUES F, PALUCKA,ANNA,KAROLINA, BERARD,FREDERIC, BLANCO,PATRICK, NEIDHART-BERARD,EVE-MARIE, NOURI-SHIRAZI,MAHYAR.
Fecha de Publicación: .
Fecha Concesión Europea: 27 de Enero de 2010.
Clasificación Internacional de Patentes:
- A61K39/00D4
- A61K39/00D5
- A61K39/00D6
- C12N5/06B11D
Clasificación PCT:
- A61K39/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C12N5/071 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células o tejidos de vertebrados, p.ej. células o tejidos humanos.
Clasificación antigua:
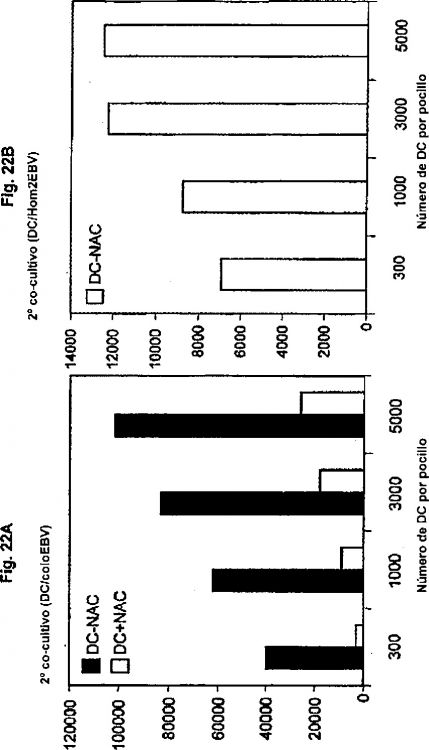
Fragmento de la descripción:
Uso de líneas celulares alogénicas para cargar células que presentan antígenos para elicitar respuestas inmunes.
Campo técnico de la invención
Esta invención se refiere a células inmunogénicas modificadas genéticamente.
Antecedentes
Las células dendríticas (denominadas en lo sucesivo "DC") son las únicas células presentadoras de antígenos, o APC, capaces de inducir respuestas inmunes primarias (Cella, et al. 1997. "Origin, maturation and antigen presenting functions of dendritic cells", Curr Opin Immunol 9: Banchereau, J., and R.M. Steinman. 1998. "Dendritic cells and the control of immunity", Nature 392:245). Los precursores de DC circulantes se dirigen a los tejidos donde residen como células capturadoras de antígenos inmaduras, con alta actividad de endocitosis y fagocitosis. Después de la captación de antígenos, las DC migran a los órganos linfoides secundarios, donde maduran y se convierten en células presentadoras de antígenos capaces de seleccionar y activar células T CD4+ vírgenes específicas de antígenos. Esto permite la diversificación de la respuesta y la activación de efectores específicos de antígenos como los linfocitos T citotóxicos específicos de antígenos (denominados en lo sucesivo "CTL") y células B, así como efectores no específicos, como las células NK, macrófagos y eosinófilos (Sogn, J.A. 1998. "Tumor immunology: the glass is half full", Immunity 9:757).
Las DC se han utilizado para provocar una respuesta inmune contra los tumores. La inducción de la inmunidad tumoral puede ser vista como un proceso de tres etapas que incluye: 1) presentación de antígenos asociados a tumores; 2) selección y activación de antígenos asociados a tumores - células T específicas, así como efectores no específicos, 3) localización de antígenos asociados a tumores - células T específicas para el sitio del tumor, y 4) reconocimiento de los elementos de restricción que conducen a la destrucción de las células tumorales. La Patente Estadounidense Nº 5.637.483, otorgada a Dranoff et al., describe un método por el cual las células tumorales modificadas que expresan citocinas como GM-CSF e IL-2, son irradiadas o se tornan incompetentes en cuanto a su proliferación y posteriormente administradas a un paciente para actuar como estimuladoras o supresoras del sistema inmunológico sistémico de un paciente. Experimentos en ratones han demostrado el desarrollo de respuestas antitumorales protectoras y terapéuticas inducidas por DC cargadas con antígenos asociados a tumores (Bell, et al. 1999. "Dendritic cells", Adv Immunol 72:255). Además, ensayos clínicos piloto en seres humanos demuestran la viabilidad de la administración de DC y la capacidad de DC cargadas con péptidos de inducir respuestas de células T específicas para péptidos en pacientes con linfoma, melanoma maligno y carcinoma de próstata (Mukherji, et al. 1995. "Induction of antigen-specific cytolytic T cells in situ in human melanoma by immunization with synthetic peptide-pulsed autologous antigen presenting cells", Proc Natl Acad Sci USA 92:8078; Hsu, et al. 1996. "Vaccination of patients with B-cell lymphoma using autologous antigen-pulsed dendritic cells", Nat Med 2:52; Gilboa, E., et al. 1998. "Immunotherapy of cancer with dendritic cell-based vaccines", Cancer Immunol Immunother 46:82; Nestle, et al. 1998. "Vaccination of melanoma patients with peptide- or tumor lysate-pulsed dendritic cells", Nat Med 4:328; Tjoa, et al. 1998. "Evaluation of phase I/Il clinical trials in prostate cancer with dendritic cells and PSMA peptides", Prostate 36:39).
Para que las DC afecten el sistema inmunológico, las células deben poseer fragmentos peptídicos procesados para interactuar con las células T, o estar "cargadas". Uno de los desafíos críticos para el uso de DC como vectores de inmunoterapia es la identificación de un abordaje eficiente para la carga de antígenos. Se han empleado varios sistemas para suministrar antígenos asociados a tumores a las DC que incluyen: 1) péptidos definidos de secuencias conocidas (Mayordomo, et al. 1995. "Bone marrow-derived dendritic cells pulsed with synthetic tumor peptides elicit protective and therapeutic antitumor immunity", Nat Med 1:1297; Celluzzi, et al. 1996. "Peptide-pulsed dendritic cells induce antigen-specific CTL-mediated protective tumor immunity", J Exp Med 183:283); 2) péptidos indefinidos eluidos con ácido de tumores autólogos (Zitvogel, et al. 1996. "Therapy of murine tumors with tumor peptide-pulsed 2dendritic cells: dependence on T cells, B7 costimulation, and T helper cell 1-associated cytokines", J Exp Med 183:87); 3) lisados de tumor enteros (Fields, et al. 1998. "Murine dendritic cells pulsed with whole tumor lysates mediate potent antitumor immune responses in vitro and in vivo", Proc Natl Acad Sci USA 95:9482); 4) vectores de retrovirus y adenovirus (Song, et al. 1997. "Dendritic cells genetically modified with an adenovirus vector encoding the cDNA for a model antigen induce protective and therapeutic antitumor immunity", J Exp Med 186:1247; Specht, et al. 1997. "Dendritic cells retrovirally transduced with a model antigen gene are therapeutically effective against established pulmonary metastases", J Exp Med 186:1213); 5) ARN derivado de células tumorales (Boczkowski, et al. 1996. "Dendritic cells pulsed with RNA are potent antigen-presenting cells in vitro and in vivo", J Exp Med 184:465); y 6) fusión de DC con células tumorales (Gong, et al. 1998. "Reversal of tolerance to human MUCI antigen in MUCI transgenic mice immunized with fusions of dendritic and carcinoma cells", Proc Natl Acad Sci USA 95:6279).
Aunque todos los métodos para suministrar antígenos asociados a tumores descritos anteriormente inducen respuestas de células T y causan efectos anti- tumorales considerables, cada uno tiene sus desventajas potenciales (Sogn, J.A. 1998. "Tumor immunology: the glass is half full", Immunity 9:757). Ante todo, los abordajes basados en péptidos están limitados por 1) el conocimiento del haplotipo del MHC de cada paciente; 2) el conocimiento de los motivos de unión al MHC clase I correspondiente de los antígenos asociados al tumor; 3) la variabilidad de la afinidad de unión al MHC clase I de los péptidos sintéticos; y 4) el conocimiento de si varios péptidos definidos, o cuáles de ellos, representan antígenos asociados a tumores in vivo.
A diferencia de un abordaje basado en péptidos que requiere información sobre el haplotipo del MHC y la secuencia del péptido, el tejido tumoral no fraccionado puede proporcionar epitopos de MHC clase I y de MHC clase II sin la identificación de antígenos asociados a tumores. Estudios recientes han demostrado la capacidad de las DC para capturar células muertas o moribundas y provocar respuestas CTL secundarias restringidas de MHC clase I (Albert, et al. 1998. "Dendritic cells acquire antigen from apoptotic cells and induce class l- restricted CTLs", Nature 392:86; Albert, et al. 1998. "Tumor-specific killer cells in paraneoplastic cerebellar degeneration", Nat Med 4:1321). Estos estudios indicaron que 1) las DC cargadas con células infectadas con virus de influenza muertas o moribundas pueden activar los linfocitos para montar respuestas CTL específicas para virus; y 2) las DC que capturan células tumorales muertas o moribundas pueden presentar antígenos a células T específicas para péptidos de antígenos asociados a tumores que se obtuvieron de pacientes con degeneración cerebelosa paraneoplásica. Debido a la posibilidad de que las DC modificadas genéticamente contribuyan de manera positiva en el tratamiento de las enfermedades humanas, se desea un método sencillo para su producción.
La Patente Estadounidense Nº 5.851.756 otorgada a Steinman et al. revela métodos por los cuales pueden producirse in vitro cultivos proliferantes de precursores de DC y DC maduras. Steinman et al. describen la producción de antígenos dependientes de células T usando cultivos de DC maduras, donde los antígenos se componen de antígenos modificados por DC o DC activadas por antígenos. Steinman et al. describen además que los antígenos modificados por DC o las DC activadas por antígenos pueden ser utilizados como inmunógenos para vacunas o el tratamiento de enfermedades infecciosas.
Los principales problemas en la inmunoterapia tumoral experimentados en los métodos presentados anteriormente son el número...
Reivindicaciones:
1. Uso de células dendríticas para preparar una composición farmacéutica para inducir una respuesta inmune citotóxica específica para un tumor en un paciente humano que presenta un tumor, donde dichas células dendríticas se preparan in vitro mediante
(a) co-incubación de células dendríticas de dicho paciente con células tumorales humanas, alogénicas, apoptóticas, para formas células dendríticas cargadas,
donde dichas células tumorales alogénicas poseen al menos un antígeno compartido entre las células tumorales alogénicas y las células tumorales de dicho paciente, y
donde dicha respuesta inmune citotóxica está dirigida contra dicho antígeno tumoral compartido para causar rechazo del tumor.
2. El uso de la Reivindicación 1, donde dichas células apoptóticas se obtienen a partir de líneas celulares alogénicas.
3. El uso de la Reivindicación 1 o 2, donde dicha respuesta inmune citotóxica está dirigida contra antígenos tumorales múltiples compartidos.
4. Uso de células T citotóxicas para preparar una composición farmacéutica para inducir una respuesta inmune específica para un tumor en un paciente humano que presenta un tumor, donde dichas células T citotóxicas se preparan in vitro mediante:
(a) co-incubación de células dendríticas humanas con células tumorales humanas alogénicas, apoptóticas, para formar células dendríticas cargadas; y
(b) co-cultivo de dichas células dendríticas cargadas con células T humanas vírgenes para formar células T citotóxicas,
donde dichas células tumorales alogénicas poseen al menos un antígeno compartido entre las células tumorales alogénicas y las células tumorales de dicho paciente, y
donde dicha respuesta inmune citotóxica está dirigida contra dicho antígeno tumoral compartido.
5. El uso de la Reivindicación 4, donde dichas células apoptóticas alogénicas se obtienen a partir de líneas celulares alogénicas.
6. El uso de la Reivindicación 4 o 5, donde dicha respuesta inmune citotóxica está dirigida contra antígenos tumorales múltiples compartidos.
7. El uso de las Reivindicaciones 4 a 6, donde las células citotóxicas son células citotóxicas naturales o células T citotóxicas naturales.
8. El uso de las Reivindicaciones 4 a 6, donde las células citotóxicas son CD4 positivas.
9. El uso de las Reivindicaciones 4 a 6, donde las células citotóxicas son CD8 positivas.
10. Un ensayo in vitro para determinar el grado de actividad citotóxica de las células citotóxicas contra células tumorales de un paciente que comprende:
(a) co-incubar células dendríticas humanas con células tumorales humanas alogénicas, apoptóticas, que poseen antígenos para los cuales se desea una respuesta inmune a fin de formar células dendríticas cargadas;
(b) co-cultivar dichas células dendríticas cargadas con células precursoras citotóxicas para formar células citotóxicas;
(c) aislar dichas células citotóxicas;
(d) incubar dichas células citotóxicas con dichas células tumorales del paciente; y
(e) monitorear la muerte de dichas células tumorales del paciente,
donde el grado de muerte de las células tumorales es proporcional a la actividad citotóxica de dichas células citotóxicas.
Patentes similares o relacionadas:
NOVEDOSAS FORMULACIONES PARA VACUNAS DE PÉPTIDOS ASOCIADOS A TUMORES, UNIDOS A MOLÉCULAS DEL ANTÍGENO DE LEUCOCITO HUMANO (HLA) DE CLASO I O II, del 14 de Febrero de 2012, de IMMATICS BIOTECHNOLOGIES GMBH: Una formulación farmacéutica que comprende: entre 2 y 18 péptidos asociados a tumor; en donde cada péptido tiene una longitud de entre 8 y 22 aminoácidos; […]
CÉLULAS GENÉTICAMENTE MODIFICADAS QUE EXPRESAN UN INHIBIDOR DE TGF-BETA, SIENDO LAS CÉLULAS CÉLULAS DE CÁNCER DE PULMÓN, del 3 de Febrero de 2012, de NovaRx: Composición farmacéutica que comprende una cantidad terapéuticamente eficaz de células genéticamente modificadas que contienen una construcción […]
VACUNA DE ADN CONTRA LAS CÉLULAS ENDOTELIALES PROLIFERATIVAS Y MÉTODOS DE UTILIZACIÓN DE LA MISMA, del 10 de Enero de 2012, de THE SCRIPPS RESEARCH INSTITUTE: Vacuna de ADN eficaz para provocar una respuesta inmunitaria contra las células endoteliales proliferativas, que comprende un constructo de ADN que codifica de manera […]
PRODUCCIÓN Y USO DE LÍNEAS DE CÉLULAS TUMORALES HUMANAS CD124 Y CD116 POSITIVAS EN LA PRODUCCIÓN DE AGENTES DE INMUNOTERAPIA ALOGÉNICOS O SEMIALOGÉNICOS, del 26 de Diciembre de 2011, de GLYCOTOPE GMBH: Método para la producción de células o líneas celulares dendríticas efectivas caracterizado en que la línea celular MUTZ-3 CD124 y CD116 positiva se pone en contacto […]
FORMULACIONES DE COMBINACIONES DE ADYUVANTES, del 7 de Noviembre de 2011, de WYETH HOLDINGS CORPORATION: Una composición antigénica que comprende un antígeno seleccionado procedente de un virus, una bacteria, un hongo o un parásito patógeno, o de una célula cancerosa o una […]
USO DE VEGF MUTADO PARA LA TERAPIA ANTIANGIOGENICA, del 29 de Septiembre de 2011, de CENTRO DE INGENIERIA GENETICA Y BIOTECNOLOGIA (CIGB): Aplicacion de secuencias oligonucleotídicas y polipeptídicas de moléculas pertenecientes a la familia del factor de permeabilidad vascular (VPF), sus receptores […]
PÉPTIDO ANTÍGENO ANTICÁNCER DERIVADO DE SPARC Y COMPOSICIÓN FARMACÉUTICA QUE COMPRENDE EL MISMO, del 21 de Septiembre de 2011, de ONCO THERAPY SCIENCE, INC: Un peptido de cualquiera de los siguientes: (A) un peptido que consiste en la secuencia de aminoacidos mostrada en cualquiera de las SEC. ID. no 1 a no 3; o (B) […]
COMPOSICIONES Y MÉTODOS PARA INMUNOTERAPIA A BASE DE CÉLULAS DENDRÍTICAS, del 12 de Julio de 2011, de DENDREON CORPORATION: Una proteína de fusión de HER-2 inmunoestimuladora, que comprende: un componente de secuencia antigénica polipeptídica o proteínica y un componente […]