USO DE BISFOSFONATOS EN EL TRATAMIENTO DE LA REESTENOSIS VASCULAR.
Uso de un bisfosfonato encapsulado dentro de un liposoma para la preparación de un medicamento para el tratamiento de la reestenosis,
en el que los liposomas tienen un diámetro de entre 0,15 y 300 nm
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E04006854.
Solicitante: YISSUM RESEARCH DEVELOPMENT COMPANY OF THE HEBREW UNIVERSITY OF JERUSALEM
HADASIT MEDICAL RESEARCH SERVICES AND DEVELOPMENT LTD.
Nacionalidad solicitante: Israel.
Dirección: 46 JABOTINSKY STREET,JERUSALEM 92 182.
Inventor/es: GOLOMB, GERSHON, DANEBERG, HAIM, MINKKINEN,DR. JUKKA, FISHBEIN,DR. ILIA.
Fecha de Publicación: .
Fecha Solicitud PCT: 14 de Julio de 1999.
Fecha Concesión Europea: 16 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61K31/66 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos del fósforo.
- A61K31/662 A61K 31/00 […] › Acidos de fósforo o sus esteres que tienen enlaces P—C, p. ej. foscarnet, triclorfon.
Clasificación PCT:
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Uso de bisfosfonatos en el tratamiento de la reestenosis vascular.
Campo de la invención
La presente invención se refiere a composiciones que pueden prevenir, inhibir o reducir la reestenosis (denominada algunas veces en la técnica "arterioesclerosis acelerada" y "estrechamiento tras angioplastia").
Técnica anterior
Se considera que las siguientes referencias son pertinentes para el fin de entender los antecedentes de la presente invención.
1. Waller, B.F., Orr, C.M, VanTassel J., et al. Clin-Cardiol. 20(2):153-60, (1997).
2. Anderson, W.D, King, S. Br., Curr-Opin-Cardiol., 11(6):583-90, (1996).
3. Moorman, D.L., Kruyer, W.B., Jackson, W.G., Aviat-Space-Environ-Med. 67(10):990-6, (1996).
4. Laurent S, Vanhoutte P, Cavero I, et al., Fundam. Clin. Pharmacol., 10(3):243-57, (1996).
5. Walsh, K., Perlman, Semin-Interv-Cardiol., 1(3):173-9, (1996).
6. Schwartz, R.S., Semin-Interv-Cardiol., 2(2):83-8, (1997).
7. Allaire, E, Clowes, A.W. Ann. Thorac. Surg., 63:582-591, (1997).
8. Hamon. M., Bauters, C., McFadden, E.P, et al., Eur. Heart J., 16:33s-48s, (1995).
9. Gottsauner-Wolf, M., Moliterno, D.J, Lincoff, A.M., Topol, E.J., Clin. Cardiol., 19:347-356, (1996).
10. Herrman, J.P.R., Hermans, W.R.M., Vos, J., Serruys, P.W., Drugs, 46:18-52, (1993).
11. Leclerc, G., Voisine, P., Bouchard, M., Fleser, A., Martel, R. Elsevier Science, 722-724, (1995).
12. Topol, E., The NY Academy of Sciences, 225-277, (1997).
13. Fleisch, H., en: Bisphosphonates in bone disease. Parthenon Publishing Group Inc., págs. 184-186 (1997).
14. Mönkkönen, J., Taskinen, M., Auriola, S., Urtti, J. Drug Target, 2:299-308, (1994).
15. Kramsche, D.M., y Chan, C.T., Circ. Res., 42:562-572, (1978).
16. Braunwald, E. Heart Disease en: A textbook of cardiovascular medicine; 5ª ed., W.B. Saunders Company: Filadelfia, (1997).
17. Gennaro Alfonso, R. Remington, en: The Science and Practice of Pharmacy, Mack Publishing, Easton PA, 19ª ed., (1995).
18. Mönkkönen, J., y Heath, T.D., Calcif. Tissue Int., 53:139-145, (1993).
19. M. Donbrow en: Microencapsulation and Nanoparticles in Medicine and Pharmacy, CRC Press, Boca Ratón, FL, p. 347.
Las referencias anteriores se reconocerán en el texto a continuación indicando su número (tal como se muestra en corchetes) de la lista anterior.
Antecedentes de la invención
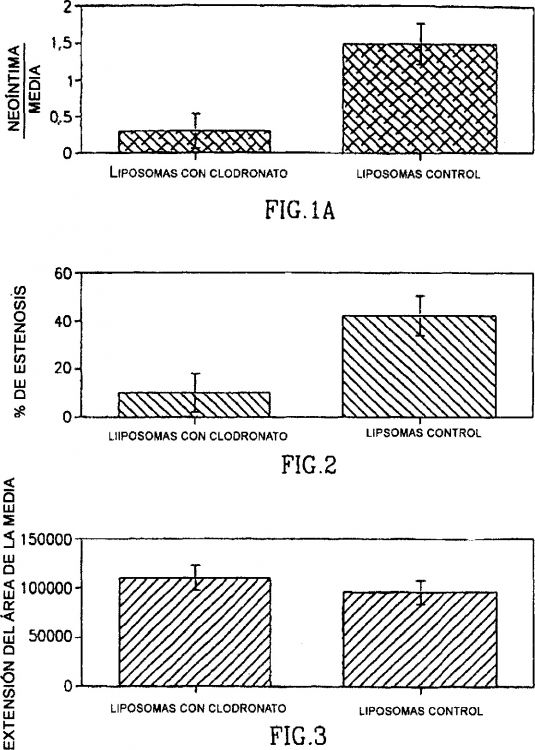
Durante la década pasada, se han mejorado en gran medida los medios mecánicos para lograr la revascularización de vasos ateroscleróticos obstructivos. Los procedimientos de angioplastia coronaria transluminal percutánea (ACTP) incluyen pero sin limitarse a, dilatación con balón, aterectomía por escisión, colocación de endoprótesis endoluminales, rotablación y ablación con láser. Sin embargo, la revascularización induce trombosis, e hiperplasia de la neoíntima, que a su vez provoca reestenosis en una proporción sustancial de arterias coronarias tras la angioplastia con balón satisfactoria y en injerto de derivación aortocoronario de vena safena y otros injertos coronarios. Además, la hiperplasia de la íntima provoca reestenosis en muchas angioplastias femorales superficiales, endarterectomías carotídeas y derivaciones de vena femoro-distal. La introducción de endoprótesis endovasculares ha contribuido a reducir la incidencia de reestenosis, pero este problema todavía sigue siendo significativo(1-9). A pesar de la extensa investigación sobre la incidencia, el ritmo, los mecanismos y las intervenciones farmacológicas en modelos de seres humanos y animales, hasta la fecha no existe ninguna terapia que evite sistemáticamente la reestenosis coronaria(10-12). Actualmente todavía se desean en gran medida composiciones y métodos para la reducción o prevención de la reestenosis.
Los bisfosfonatos (BP) (anteriormente denominados difosfonatos) son compuestos caracterizados por dos enlaces C-P. Si los dos enlaces se ubican en el mismo átomo de carbono (P-C-P), se denominan bisfosfonatos geminales. Los BP son análogos del pirofosfato inorgánico endógeno que está implicado en la regulación de la formación y resorción óseas. El término bisfosfonato se usa generalmente para bisfosfonatos geminales y no geminales. Los BP y los pirofosfatos a veces pueden formar juntos cadenas poliméricas. Los BP actúan sobre el hueso debido a su afinidad por el mineral óseo y son inhibidores potentes de la resorción ósea y la calcificación ectópica. Principalmente, los BP o el pirofosfato se han usado clínicamente como (a) agentes antiosteolíticos en pacientes con aumento de la destrucción ósea, especialmente enfermedad de Paget, enfermedad ósea tumoral y osteoporosis; (b) marcadores esqueléticos para fines de diagnóstico (unidos a 99mTc); (c) inhibidores de la calcificación en pacientes con osificación y calcificación ectópica, y (d) agentes antisarro añadidos a la pasta de dientes(13).
Sumario de la invención
La presente invención proporciona el uso de un bisfosfonato encapsulado dentro de un liposoma para la preparación de un medicamento para el tratamiento de la reestenosis, en el que los liposomas tienen un diámetro de entre 0,15 y 300 nm.
La expresión "cantidad eficaz" pretende indicar una cantidad del principio activo que es eficaz para lograr el resultado terapéutico deseado, concretamente la prevención o reducción de la reestenosis vascular. La cantidad eficaz puede depender de varios factores incluyendo: peso y género del individuo tratado; el tipo de procedimiento médico, por ejemplo, si la reestenosis vascular que va a inhibirse es tras angioplastia con balón, angioplastia con balón seguida del despliegue de una endoprótesis, etc.; el modo de administración del principio activo (concretamente, si se administra sistémica o directamente al sitio); el tipo de portador que está usándose (por ejemplo, si es un portador que libera rápidamente el principio activo o un portador que lo libera a lo largo de un periodo de tiempo); el régimen terapéutico (por ejemplo, si se administra el principio activo una vez al día, varias veces al día o una vez cada pocos días); factores clínicos que influyen en la velocidad de desarrollo de la reestenosis tales como diabetes, tabaquismo, hipercolesterolemia, enfermedades renales, etc.; factores anatómicos tales como si hay estenosis preangioplastia grave, obstrucción total, ubicación de la arteria coronaria descendente anterior izquierda, lesión de injerto de vena safena, lesiones largas, ACTP de múltiples lesiones o múltiples vasos, de la forma farmacéutica de la composición; etc. Además, las variables del procedimiento también pueden afectar a la dosificación tal como una mayor estenois residual tras ACTP, disección grave, desgarro de la íntima, tamaño apropiado del balón y la presencia de trombos. El experto, mediante experimentación de tipo rutinario, no debe tener dificultades sustanciales para determinar la cantidad eficaz en cada caso.
La invención puede aplicarse a la prevención, la reducción o el tratamiento de la reestenosis vascular y principalmente, pero sin limitarse a, la reestenosis coronaria tras angioplastia. La reestenosis vascular resulta de diversos procedimientos de angioplastia incluyendo angioplastia con balón, implantación de endoprótesis intravasculares u otros métodos de angioplastia percutánea (incluyendo angioplastia de arterias coronarias, arterias carótidas y otros vasos susceptibles de angioplastia) así como para reestenosis que resulta de estenosis de injerto vascular (por ejemplo, tras cirugía de derivación)(16). Además, la invención también puede aplicarse a su uso para la prevención, la reducción o el tratamiento de la reestenosis vascular...
Reivindicaciones:
1. Uso de un bisfosfonato encapsulado dentro de un liposoma para la preparación de un medicamento para el tratamiento de la reestenosis, en el que los liposomas tienen un diámetro de entre 0,15 y 300 nm.
2. Uso según la reivindicación 1, en el que dicho bisfosfonato comprende un compuesto que tiene la siguiente fórmula (I):

en la que R1 es H, OH o grupo halogenado; y
R2 es halógeno; alquenilo C2-C10 o alquilo C1-C10 lineal o ramificado opcionalmente sustituido con heteroaril o heterociclil-alquil(C1-C10)amino o cicloalquil(C3-C8)amino, en donde el amino puede ser una amina primaria, secundaria o terciaria; -HNY en donde Y es hidrógeno, cicloalquilo C3-C8, arilo o heteroarilo; o -SZ en donde Z es fenilo o piridinilo clorosustituido.
3. Uso según la reivindicación 1 ó 2, en el que dicho bisfosfonato se selecciona del grupo que consiste en clodronato, etidronato, tiludronato, pamidronato y alendronato.
4. Uso según cualquiera de las reivindicaciones anteriores, en el que el medicamento se prepara para administración intravenosa, intraarterial, intramuscular o subcutánea.
5. Uso según cualquiera de las reivindicaciones anteriores, en el que el medicamento se prepara para administración sistémica.
6. Uso según cualquiera de las reivindicaciones anteriores, en el que la reestenosis es reestenosis coronaria.
Patentes similares o relacionadas:
Proteínas de unión a antígeno para proproteína convertasa subtilisina kexina tipo 9 (PCSK9), del 6 de Mayo de 2020, de AMGEN INC.: Una proteína de unión a antígeno, donde dicha proteína de unión a antígeno (i) comprende (a) un dominio variable de cadena ligera que comprende una secuencia […]
 Compuestos secuestrantes de dicarbonilo dirigidos a mitocondrias, del 29 de Abril de 2020, de United Kingdom Research and Innovation: Un compuesto de fórmula 1:
A-L-B
Fórmula 1
o una sal farmacéuticamente aceptable del mismo, en la que:
A es un resto secuestrante de […]
Compuestos secuestrantes de dicarbonilo dirigidos a mitocondrias, del 29 de Abril de 2020, de United Kingdom Research and Innovation: Un compuesto de fórmula 1:
A-L-B
Fórmula 1
o una sal farmacéuticamente aceptable del mismo, en la que:
A es un resto secuestrante de […]
Composición de líquido de diálisis que comprende sustancias inhibidoras de la cristalización, del 12 de Febrero de 2020, de UNIVERSITAT DE LES ILLES BALEARS: Una formulación intravenosa que comprende inositol-fosfato y/o cualquiera de sus sales para su uso en el mantenimiento o aumento de los niveles de inositol-fosfato […]
Formulaciones y formas de dosificación de fosfolípidos oxidados, del 11 de Diciembre de 2019, de VASCULAR BIOGENICS LTD: Una composición farmacéutica que comprende un fosfolípido oxidado que tiene una estructura según la fórmula (I):**Fórmula** en donde R1 […]
Osmolitos para la reducción de los efectos secundarios de esteroides o antihistamínicos, del 8 de Noviembre de 2019, de BITOP AG: Medicamento que contiene como principio activo al menos un soluto compatible para su administración para el tratamiento de reacciones inflamatorias agudas […]
Formulaciones terapéuticas sostenidas inhalables, del 2 de Julio de 2019, de Civitas Therapeutics, Inc. (100.0%): Partículas no poliméricas para la administración pulmonar de un agente terapéutico, profiláctico o diagnóstico, comprendiendo las partículas: (a) un agente terapéutico, […]
Nuevas fenoxiacetamidas anilladas, del 5 de Junio de 2019, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I),**Fórmula** en la que R1 y R2 se seleccionan independientemente entre etilo, 2-hidroxietilo, 2-tetrahidrofuranilmetilo y […]
Óxido de arilfósforo y sulfuro de arilfósforo espirocíclicos, del 29 de Mayo de 2019, de Qilu Pharmaceutical Co., Ltd: Un compuesto representado por la fórmula (I) o la fórmula (II) o una sal farmacéuticamente aceptable del mismo,**Fórmula** en las que, T1 se selecciona […]