TRATAMIENTO DE LA LEUCEMIA MIELOGENA CRONICA, RESISTENTE O INTOLERANTEAL STI571, QUE CONSISTE EN HOMOHARRIGTONINA SOLA O COMBINADA CON OTROS AGENTES.
Utilización de homoharringtonina para la preparación de un fármaco destinado al tratamiento de la leucemia mielógena crónica,
una afección mieloproliferativa relacionada o una leucemia linfocítica aguda Ph positiva en un sujeto animal que muestra resistencia o intolerancia al tratamiento con STI571
Tipo: Resumen de patente/invención. Número de Solicitud: W0203992IB.
Solicitante: CHEMGENEX PHARMACEUTICALS LIMITED.
Nacionalidad solicitante: Australia.
Dirección: LEVEL 4, 199 MOORABOOL ST,GEELONG, VICTORIA 3220.
Inventor/es: ROBIN, JEAN-PIERRE, MAHON,FRANCOIS-XAVIER, MAISONNEUVE,HERVE, MALOISEL,FREDERICK,C/O HOPITAL DE HAUTEPIERRE, BLANCHARD,JULIE.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/496 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piperazinas no condensadas conteniendo otros heterociclos, p. ej. rifampicina, tiotixeno.
- A61K31/55 A61K 31/00 […] › que tienen ciclos con siete eslabones, p. ej. azelastina, pentilentetrazol.
- A61K31/7068 A61K 31/00 […] › teniendo grupos oxo unidos directamente al ciclo de pirimidina, p. ej. citidina, ácido citidílico.
Clasificación PCT:
- A61K31/55 A61K 31/00 […] › que tienen ciclos con siete eslabones, p. ej. azelastina, pentilentetrazol.
Clasificación antigua:
- A61K31/55 A61K 31/00 […] › que tienen ciclos con siete eslabones, p. ej. azelastina, pentilentetrazol.
Fragmento de la descripción:
Tratamiento de la leucemia mielógena crónica, resistente o intolerante al STI571, que consiste en la homoharringtonina sola o combinada con otros agentes.
La presente invención se refiere a la homoharringtonina sola o combinada con STI571 y/u otros agentes antileucémicos para su utilización en el tratamiento de sujetos afectados de leucemia mielógena crónica resistente o intolerante al tratamiento con STI571.
La leucemia mielógena crónica (LMC) es una enfermedad mieloproliferativa que afecta aproximadamente a 4.500 nuevos casos por año en los Estados Unidos o en Europa. La supervivencia promedio de dicha enfermedad es de aproximadamente 3 años sin tratamiento. Desde la introducción de la terapia estándar por interferón alfa (INF), la supervivencia promedio de dicha leucemia alcanza aproximadamente los 7 años. Sin embargo, cuando los pacientes se vuelven resistentes al interferón, tiene lugar el progreso hacia las fases agudas. Hasta años recientes, existían únicamente unos pocos fármacos capaces de inducir una nueva remisión. [Ref 1-5] La homoharringtonina, un alcaloide aislado a partir del género Cefalotaxus [Ref 1, 2, 6, 7], y más recientemente el STI571, un producto sintético, son fármacos recientes que pueden provocar una nueva remisión en los pacientes resistentes a INF. Además, el STI571 ha sido aprobado recientemente en los Estados Unidos como terapia principal de la LMC.
El STI571 se está convirtiendo en el estándar de terapia para la LMC; estudios clínicos recientes indican que se obtienen buenos resultados en pacientes con fase crónica de LMC: > 90% de respuesta hematológica completa, incluyendo 50% de respuesta citogenética. Sin embargo, se observan resultados limitados en la fase acelerada (< 40%), y se obtiene una eficacia pobre en la fase blástica (< 10% de respuesta hematológica completa), incluyendo una remisión muy fugaz. [Ref 8] Además, tras 15 meses con STI571, recientemente hemos descubierto que el riesgo real de progreso hacia la fase acelerada o la fase blástica era mayor del 30% [Ref 9] (resultados no publicados). Para superar dichas limitaciones terapéuticas, recientemente se han probado combinaciones de STI571 con la terapia estándar existente basada en INF (incluyendo una nueva forma de INF, tal como PEG INF). El análisis preliminar de dichas combinaciones indica que la adición de INF o PEG INF no cambia realmente la eficacia de cada fármaco administrado individualmente [Ref 9] (resultados no publicados).
En consecuencia, existe una necesidad de métodos mejorados de tratamiento de la LMC que proporcionen una remisión a largo término. En vista de las limitaciones del STI571, existe una necesidad de terapias que proporcionen resultados mejorados en el tratamiento de la fase acelerada de la LMC y la fase blástica.
Recientemente, se ha publicado que la combinación de STI571 y homoharringtonina muestra un efecto citotóxico aditivo o sinérgico in Vitro, [Ref 10-13] que permite su uso clínico como combinación. En otro estudio preliminar, se ha indicado que la homoharringtonina muestra actividad en una línea celular mieloide estándar hecha resistente in vitro al STI571.
Recientemente, se ha descubierto que las células procedentes de pacientes con leucemia mielógena crónica resistente al STI571 muestran una buena sensibilidad a la homoharringtonina [14] (resultados no publicados). También se ha descubierto que los pacientes resistentes o intolerantes al STI571 muestran respuesta hematológica a la homoharringtonina, y además dicha respuesta es a veces temporal (Robin, J. P. y otros, resultados no publicados). Dicho descubrimiento se pudo explicar por la rápida aparición de nuevos clones malignos en los que se "encontró" un mecanismo alternativo de apoptosis mediante un procedimiento de selección de mutaciones de las células leucémicas.
Se pueden encontrar argumentos adicionales de apoyo a la existencia de dicho mecanismo en artículos recientes que indican que los dos fármacos inducen una liberación de la inhibición de las caspasas (una señal molecular clave en el desencadenamiento de la apoptosis) de acuerdo con dos rutas alternativas:
- - En primer lugar, para la homoharringtonina, independiente de la generación de especies reactivas de oxígeno (ROS); [Ref 15]
- - En segundo lugar, para el STI, dependiente de las ROS; [Ref 16].
Además, la Ara-C, un cuarto agente que actualmente se combina con INF, homoharringtonina y, más recientemente, STI571, induce apoptosis de acuerdo con un mecanismo dependiente de ROS [Ref 17]. (Algunos descubrimientos indican que la citotoxicidad de interferón alfa actuaría de acuerdo con un mecanismo dependiente de ROS [Ref 18]).
Este hecho indica que la homoharringtonina se puede utilizar como un nuevo tratamiento de pacientes resistentes a la LMC, pero también que los métodos estándares de tratamiento que incluyen la eliminación de la terapia existente resistente y su sustitución por la nueva y supuestamente activa deben ser mejorados.
La presente invención se basa en el descubrimiento de que el tratamiento de la LMC utilizando la combinación de STI571 y homoharringtonina ha dado lugar a resultados mejorados de tratamiento, y de que el tratamiento con homoharringtonina da lugar a un tratamiento efectivo de la LMC resistente o intolerante al STI571. La presente invención también se basa en el descubrimiento de que el tratamiento de la LMC utilizando inicialmente STI571 y a continuación homoharringtonina en ausencia de STI571 puede dar lugar a una respuesta temporal.
La eficacia del régimen HAA (homoharringtonina combinada con Ara-C y aclarubicina) en la leucemia mieloide aguda (AML) ha sido evaluada en pacientes no tratados. Los pacientes tratados no mostraron ninguna resistencia o intolerancia al STI571. (Abstract f: Chinese Journal of Clinical Oncology, 1998, 25 (10), 758-759).
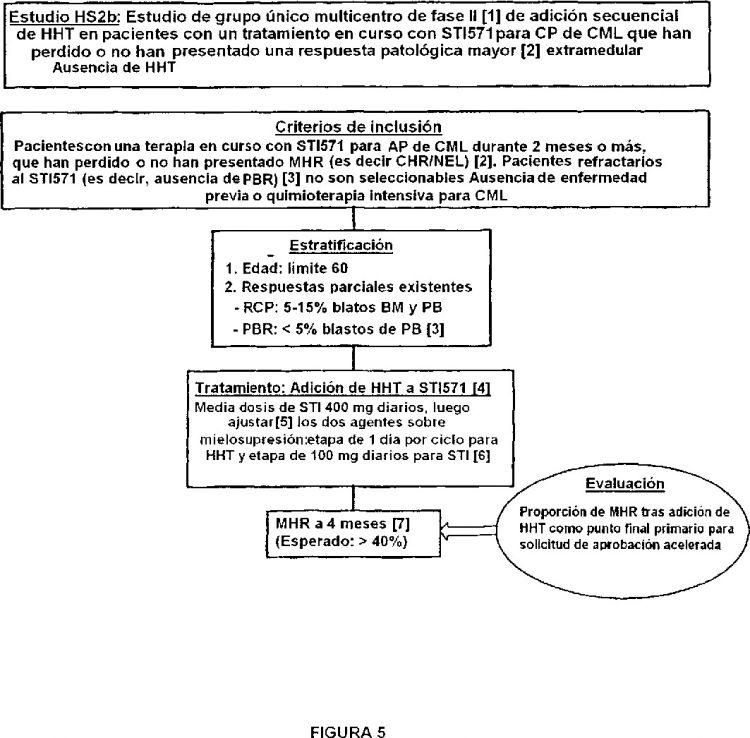
La presente invención da a conocer una nueva terapia basada en homoharringtonina para su utilización en el tratamiento de los pacientes con leucemia mielógena crónica, otras enfermedades mieloproliferativas relacionadas y leucemia linfocítica aguda Ph positiva, con el fin de sortear la resistencia primaria o secundaria y/o la intolerancia al STI571, y capaz de inducir o mejorar la respuesta hematológica y/o la respuesta citogenética y, finalmente, la supervivencia, con una toxicidad suave no hematológica. La homoharringtonina se combina preferentemente con uno o más otros agentes antileucémicos, incluyendo el propio STI571. En otras formas de realización, la homoharringtonina se combina simultáneamente con uno o más otros agentes antileucémicos, incluyendo el propio STI571, del que se prosigue la administración. En otros aspectos, la homoharringtonina se puede combinar secuencialmente con uno o más otros agentes antileucémicos, incluyendo el mismo STI571, del que se prosigue la administración. En otros aspectos, la homoharringtonina se puede combinar secuencialmente por adición a terapia con STI571 existente, incluyendo en pacientes que han perdido la respuesta o no han respondido a dicho agente, según las siguientes etapas (a) a (d), y opcionalmente (e): (a) los pacientes con leucemia mielógena crónica, finalmente resistentes a la terapia estándar con interferón alfa, son tratados con STI571 (400 a 800 mg diarios, permanentemente) hasta obtener una respuesta citogenética completa (para pacientes de novo) o, por lo menos, una respuesta hematológica completa (para todas las demás fases más avanzadas); (b) en dichos pacientes parcialmente resistentes al STI571, el mismo no se elimina, sino que se reduce a de 300 a 400 mg diarios, en los pacientes que no han presentado o han perdido su respuesta citogenética o hematológica completa; (c) la homoharringtonina se administra por vía subcutánea y/o intravenosa o/y oral, a una dosis de 0,25 a 5 mg/m2, preferentemente a una dosis de 2,5 mg/m2, preferentemente durante 2 a 14 días por ciclo de 28 días; (d) finalmente, las dosis de homoharringtonina y/o STI571 se ajustan de acuerdo con la citopenia y/o los efectos secundarios; y (e) opcionalmente, un nucleósido de administración subcutánea o intravenosa oral, sinérgico con la homoharringtonina, preferentemente citarabina, se puede añadir simultánea o secuencialmente a la homoharringtonina.
La presente invención se refiere a un método de tratamiento de la leucemia mielógena crónica, una afección mieloproliferativa relacionada o una leucemia linfocítica aguda positiva a Ph en un sujeto animal, que comprende:
Reivindicaciones:
1. Utilización de homoharringtonina para la preparación de un fármaco destinado al tratamiento de la leucemia mielógena crónica, una afección mieloproliferativa relacionada o una leucemia linfocítica aguda Ph positiva en un sujeto animal que muestra resistencia o intolerancia al tratamiento con STI571.
2. Utilización según la reivindicación 1, en la que la homoharringtonina se combina con uno o más otros agentes antileucémicos, que incluyen el STI571.
3. Utilización según las reivindicaciones 1 ó 2, en la que la homoharringtonina se administra simultáneamente con uno o más otros agentes antileucémicos, que incluyen el STI571.
4. Utilización según la reivindicación 3, en la que el STI571 es continuado desde el tratamiento previo.
5. Utilización según la reivindicación 2, en la que la homoharringtonina se administra secuencialmente con uno o más otros agentes antileucémicos.
6. Utilización según la reivindicación 5, en la que la homoharringtonina se administra secuencialmente con uno o más otros agentes antileucémicos que incluyen el mismo STI571, que es continuado.
7. Utilización según la reivindicación 6, en la que la homoharringtonina se administra secuencialmente por adición a la terapia de STI571 existente, que incluye a pacientes que han perdido la respuesta o no han respondido al STI571, según las etapas siguientes (a) a (d), y opcionalmente (e):
- (a) administrar a los pacientes con leucemia mielógena crónica, opcionalmente resistentes a terapia estándar con interferón alfa, STI571, preferentemente 400 a 800 mg diarios, hasta que se obtiene una respuesta citogenética completa, preferentemente para pacientes de novo, o por lo menos una respuesta hematológica completa, preferentemente para todas las otras fases más avanzadas,
- (b) en dichos pacientes parcialmente resistentes a STI571, reducir a de 300 a 400 mg diarios pero sin eliminar el tratamiento con STI571, en los pacientes que no han presentado o han perdido su respuesta citogenética o hematológica completa,
- (c) administrar homoharringtonina subcutáneamente y/o intravenosamente y/o oralmente, a una dosis de 0,25 a 5 mg/m2, preferentemente a dosis de 2,5 mg/m2, preferentemente durante 2 a 14 días por ciclo de 28 días;
- (d) ajustar la dosis de homoharringtonina y/o la dosis de STI571 de acuerdo con la citopenia y/o los efectos secundarios;
- (e) opcionalmente, administrar subcutáneamente o intravenosamente un nucleósido oral sinérgico con la homoharringtonina, en la que se puede añadir dicho nucleósido oral simultánea o secuencialmente a la homoharringtonina.
8. Utilización según la reivindicación 7, en la que dicho nucleósido oral de la etapa (e) es la citarabina, en la que se puede añadir la citarabina simultánea o secuencialmente a la homoharringtonina.
9. Utilización de la homoharringtonina y el STI571 para la preparación de un fármaco destinado a la inhibición de la proliferación de una célula mieloide hiperproliferativa resistente al STI571, en la que:
10. Utilización de homoharringtonina y STI571 para la preparación de un fármaco destinado al tratamiento de la leucemia mielógena crónica, una afección mieloproliferativa relacionada o una leucemia linfocítica aguda Ph positiva en un sujeto animal que presenta resistencia y/o intolerancia al STI571 tras un primer curso de tratamiento con STI571, en la que el fármaco se administra al paciente en un segundo curso de tratamiento en una cantidad efectiva para inhibir la proliferación de las células mieloides.
11. Utilización según las reivindicaciones 1 a 6, en la que dicho fármaco puede superar la resistencia y/o la intolerancia al STI571.
12. Utilización según las reivindicaciones 1 a 6, en la que dicho fármaco induce una respuesta hematológica, y/o una respuesta citogenética y/o la supervivencia, con una toxicidad no hematológica débil.
13. Utilización según la reivindicación 2, en la que la eficacia del fármaco aumenta a través de los efectos sinérgicos del STI571 y la homoharringtonina.
14. Utilización según las reivindicaciones 2 a 6, en la que los otros agentes antileucémicos son el interferón alfa y/o uno o más nucleósidos y/o un inhibidor de la farnesil transferasa (FTI).
15. Utilización según la reivindicación 6, en la que los otros agentes antileucémicos son el interferón alfa o el PEG interferón.
16. Utilización según la reivindicación 6, en la que los otros agentes antileucémicos son un nucleósido.
17. Utilización según la reivindicación 14, en la que los otros agentes antileucémicos son un inhibidor de la farnesil transferasa (FTI).
18. Utilización según la reivindicación 16, en la que los nucleósidos son la citarabina (Ara-C) y/o la decitabina y/o la troxacitabina.
19. Utilización según la reivindicación 18, en la que un nucleósido es la citarabina (Ara-C).
20. Utilización según la reivindicación 14, en la que los otros agentes son una combinación de interferón alfa y citarabina.
21. Utilización según una de las reivindicaciones anteriores, en la que el animal es un ser humano.
Patentes similares o relacionadas:
Tratamientos de combinación que comprenden imidazopirazinonas para el tratamiento de trastornos psiquiátricos y/o cognitivos, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de Fórmula (I) **(Ver fórmula)** en donde n es 0 o 1; q es 0 o 1; R1 se selecciona del grupo que consiste en bencilo, indanilo, indolina y heteroarilos […]
Combinación de agonistas inversos del receptor de histamina-3 con inhibidores de acetilcolinesterasa, del 24 de Junio de 2020, de SUVEN LIFE SCIENCES LIMITED: Una combinación que comprende un agonista inverso del receptor de histamina-3 y un inhibidor de acetilcolinesterasa; en donde el agonista inverso del receptor de histamina-3 […]
Amidas heterocíclicas como inhibidores de quinasa, del 3 de Junio de 2020, de GlaxoSmithKline Intellectual Property Development Limited: Un compuesto que es **(Ver fórmula)** o un tautómero del mismo o una sal del mismo.
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 14 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un fármaco inhibidor de la ruta de TGF-ß1 y estimulador de endoglina o una composición farmacéutica del mismo, […]
Inhibidores de EZH2 (potenciador del homólogo Zeste 2), del 13 de Mayo de 2020, de Glaxosmithkline Intellectual Property (No. 2) Limited: Un compuesto según la Fórmula (I) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la que: representa un enlace sencillo […]
INHIBIDORES DE TGF-ß1 Y PRODUCTORES DE ENDOGLINA PARA SU USO EN EL TRATAMIENTO DE EPIDERMÓLISIS BULLOSA, del 8 de Mayo de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Inhibidores de TGF-{beta}1 y productores de endoglina para su uso en el tratamiento de epidermólisis bullosa. La presente invención se refiere a un fármaco inhibidor […]
Benzazepinas fusionadas para el tratamiento de la tartamudez, del 29 de Abril de 2020, de Emalex Biosciences, Inc: Un antagonista selectivo para el receptor D1 y/o selectivo para D5 para su uso en el tratamiento de la tartamudez en un sujeto.
Compuestos de oxima como agonistas del receptor muscarínico M1 y/o M4, del 15 de Abril de 2020, de HEPTARES THERAPEUTICS LIMITED: Un compuesto de la fórmula : **(Ver fórmula)** o una sal del mismo, en donde: p es 0, 1 o 2; q es 0, 1 o 2; Y es N, O, S o C; X1 y X2 son grupos […]