Tratamiento de hepatitis vírica.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/000574.
Solicitante: ROMARK LABORATORIES, L.C..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3000 BAYPORT DRIVE SUITE 200 TAMPA, FL 33607-8416 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ROSSIGNOL, JEAN-FRANCOIS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/426 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › 1,3-Tiazoles.
- A61K38/21 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Interferones.
PDF original: ES-2422556_T3.pdf
Fragmento de la descripción:
Tratamiento de hepatitis vírica Derechos gubernamentales El Gobierno de EE.UU. tiene ciertos derechos sobre esta invención conforme al contrato nº NO1-AI-30046 concedido por el NIAID.
Referencia cruzada a solicitudes relacionadas Esta solicitud reivindica prioridad en virtud del título 35 de la U.S.C. apartado 119 sobre la solicitud de patente provisional de Estados Unidos nº de serie 60/757.036, presentada el 9 de enero de 2006, cuya divulgación se incorpora como referencia a la presente memoria.
Campo técnico
La presente divulgación se refiere a métodos para tratar hepatitis vírica, a compuestos útiles en el tratamiento de hepatitis vírica y a composiciones farmacéuticas que comprenden dichos compuestos.
Antecedentes Hepatitis hace referencia a una variedad de afecciones que implican la inflamación del hígado. La hepatitis vírica, de la que existen varios tipos (por ejemplo, hepatitis A. B, C, D y E) , es una inflamación del hígado debido a una infección vírica. Cada tipo de hepatitis vírica puede exhibir diferentes síntomas y puede caracterizarse por diferentes enfoques de tratamiento y prevención. Por ejemplo, se han desarrollado vacunas para hepatitis A y B, pero no para hepatitis C o E.
El objetivo principal del tratamiento de hepatitis C crónica es eliminar el ARN vírico detectable de la sangre. Los pacientes que carecen de ARN del virus de la hepatitis C detectable en la sangre 24 semanas después de completar la terapia tienen típicamente un pronóstico favorable y pueden considerarse curados del virus. Dicha condición es conocida como respuesta virológica mantenida. Para pacientes que no consiguen una respuesta virológica mantenida, puede haber otros beneficios más sutiles del tratamiento, tales como retardar la progresión de la cicatrización hepática (fibrosis) .
El tratamiento del virus de la hepatitis C (HCV) implica comúnmente la administración de interferón inyectable (o interferón pegilado inyectable) , ribavirina o una combinación de los mismos. El interferón a es una glucoproteína de origen natural que se secreta por las células en respuesta a infecciones víricas. Ejerce sus efectos mediante la unión a un receptor de membrana. La unión a receptor inicia una serie de acontecimientos de señalización intracelulares que conducen por último a una expresión potenciada de ciertos genes. Esto conduce al potenciamiento e inducción de ciertas actividades celulares incluyendo el aumento de la destrucción de células diana por linfocitos y la inhibición de la replicación vírica en células infectadas. La ribavirina es un nucleósido sintético que tiene actividad contra un amplio espectro de virus.
El interferón a, con o sin ribavirina, está asociado a muchos efectos secundarios. Síntomas de tipo gripe, depresión, erupciones, otras reacciones inusuales y recuentos sanguíneos anormales son ejemplos comunes de dichos efectos secundarios. La ribavirina está asociada a un riesgo significativo de desarrollo fetal anormal. Por consiguiente, las mujeres que estén potencialmente embarazadas no deberían empezar la terapia hasta obtener un informe de una prueba de embarazo negativa. Se aconseja a las pacientes femeninas que eviten quedarse embarazadas durante el tratamiento. Se aconseja a los pacientes que usan interferón a y ribavirina que se hagan análisis de sangre aproximadamente una vez al mes, y algo más frecuentemente al inicio del tratamiento. Ciertos grupos de pacientes no pueden tomar ribavirina, por ejemplo aquellos con anemia, enfermedad cardiaca o enfermedad renal. En dichos casos, se prescribe típicamente el interferón a pegilado solo. Se aconseja a algunos pacientes con hepatitis C (por ejemplo, pacientes que tienen también enfermedad hepática avanzada) que no tomen interferón a o interferón a pegilado debido al riesgo de efectos secundarios graves. Para dichos pacientes, no se reconoce como eficaz y seguro para tratar la hepatitis C ningún método anteriormente disponible de tratamiento.
Existe por lo tanto la necesidad en la materia de desarrollar un tratamiento eficaz de la hepatitis C. Un tratamiento ideal conseguiría una respuesta virológica mantenida en un amplio intervalo de pacientes. Dicho tratamiento emplearía agentes activos fácilmente disponibles y tendría efectos secundarios mínimos. Cuando se emplea la administración conjunta de interferón a, un tratamiento ideal requeriría cantidades reducidas de interferón a (concretamente, frecuencia de administración reducida, cantidad de administración reducida, o ambas) en comparación con el tratamiento tradicional.
Sumario de la divulgación
La presente invención está dirigida a abordar una o más de los inconvenientes anteriormente mencionados de los tratamientos conocidos para hepatitis C vírica.
En una realización entonces, la divulgación describe una composición para uso en el tratamiento de un paciente que padece hepatitis C. La composición para uso en el tratamiento de hepatitis C comprende un compuesto seleccionado de nitazoxanida, tizoxanida o una mezcla de las mismas.
En aún otra realización, la divulgación describe una composición para uso en un método de tratamiento de un paciente que padece hepatitis C. El método comprende pretratar el paciente durante un periodo de tiempo predeterminado con una primera composición que comprende una cantidad terapéuticamente eficaz de un compuesto seleccionado de nitazoxanida, tizoxanida o una mezcla de las mismas. El método comprende además administrar al paciente, después del periodo de tiempo predeterminado, una cantidad terapéuticamente eficaz de una segunda composición que comprende un agente activo seleccionado del grupo consistente en un interferón, un agente antidiabético, ribavirina y 2-metilcitidina.
En aún otra realización, la divulgación describe una composición que comprende: (a) uno o más compuestos seleccionados de nitazoxanida, tizoxanida o una mezcla de las mismas, (b) un interferón y/o (c) un agente antidiabético.
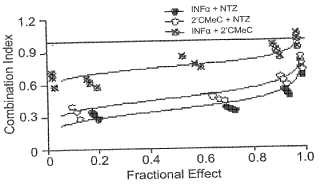
Breve descripción de los dibujos Las Figuras 1a y 1b son gráficas que ilustran la actividad sinérgica de nitazoxanida con interferón a-2b o 2'-Cmetilcitidina frente a la replicación de HCV en una estirpe celular que contiene replicón de HCV.
Las Figuras 2a y 2b son gráficas que ilustran la actividad sinérgica cuando se trata una estirpe celular que contiene replicón de HCV en primer lugar con nitazoxanida y entonces con nitazoxanida más interferón a-2b.
La Figura 3 es un diagrama del destino de los pacientes que muestra la selección de los participantes para el experimento descrito en el ejemplo 5.
La Figura 4, descrita en el ejemplo 5, es una gráfica que muestra los niveles de ARN de HCV séricos cuantitativos medios con el tiempo para diferentes grupos de tratamiento.
La Figura 5, descrita en el ejemplo 5, es una gráfica que muestra los niveles de ARN de HCV séricos cuantitativos con el tiempo para diferentes pacientes.
La Figura 6 es un diagrama del destino de los pacientes que muestra la selección de los participantes para el experimento descrito en el ejemplo 6.
La Figura 7, descrita en el ejemplo 6, es una gráfica que muestra el recuento de plaquetas frente al tiempo para pacientes administrados con interferón a-2b pegilado más cualquiera de Alinia® o un placebo.
La Figura 8, descrita en el ejemplo 6, es una gráfica que muestra el recuento de neutrófilos frente al tiempo para pacientes administrados con interferón a-2b pegilado más cualquiera de Alinia® o un placebo.
Descripción detallada de la invención Definiciones y nomenclatura:
Antes de describir la presente invención con detalle, ha de entenderse que, a menos que se indique otra cosa, esta invención no está limitada a dosificaciones, formulaciones o métodos de uso particulares, ya que estos pueden variar. Ha de entenderse también que la terminología usada en la presente memoria es con el fin de describir solo realizaciones particulares, y no se pretende que sea limitante.
Debe observarse que, como se usa en esta memoria descriptiva y las reivindicaciones adjuntas, las formas singulares “un”, “una” y “el/la” incluyen los referentes plurales a menos que el contexto dicte claramente otra cosa. Por tanto, por ejemplo, “una forma de dosificación” hace referencia no solo a una sola forma de dosificación sino también a una combinación de dos o más formas de dosificación diferentes, “un agente activo” hace referencia a una combinación de agentes activos así como a un solo agente activo, y similares.
Como se usan en la memoria descriptiva y las reivindicaciones adjuntas, los términos “por ejemplo”,... [Seguir leyendo]
Reivindicaciones:
1. Una composición para uso en el tratamiento de hepatitis C que comprende un compuesto seleccionado de nitazoxanida y tizoxanida o una mezcla de las mismas.
2. La composición de la reivindicación 1 para el uso de la reivindicación 1, que comprende además un portador farmacéuticamente aceptable.
3. La composición de la reivindicación 1 para el uso de la reivindicación 1, en la que la composición comprende una mezcla de nitazoxanida y tizoxanida.
4. La composición de la reivindicación 2 para el uso de la reivindicación 1, que comprende además uno o más agentes biológicamente activos adicionales seleccionados del grupo consistente en un interferón, un agente antidiabético y 2-metilcitidina.
5. La composición de la reivindicación 1 para el uso de la reivindicación 1, que comprende administrar el compuesto al paciente durante un periodo de tiempo de entre aproximadamente 3 días y aproximadamente 24 semanas, seguido de administración del compuesto y un interferón al paciente durante un periodo de entre aproximadamente 1 semana y aproximadamente 48 semanas.
6. La composición de la reivindicación 1 para el uso de la reivindicación 1, que comprende administrar el compuesto al paciente durante un periodo de entre aproximadamente 3 días y aproximadamente 2 años.
7. La composición de la reivindicación 1 para el uso de la reivindicación 1, que comprende además el uso de uno o más agentes activos adicionales del grupo consistente en un interferón, un agente antidiabético, ribavirina y 2metilcitidina.
8. La composición de la reivindicación 7 para el uso de la reivindicación 1, en la que el uno o más agentes activos adicionales comprenden un interferón.
9. La composición de la reivindicación 8 para el uso de la reivindicación 1, en la que el interferón se formula separadamente del compuesto.
10. La composición de la reivindicación 8 para el uso de la reivindicación 1, en la que el interferón es interferón a-2a interferón a-2b o un conjugado de polietilenglicol con interferón a-2a o interferón a-2b.
11. La composición de la reivindicación 8 para el uso de la reivindicación 1, en la que el interferón se administra al paciente durante un periodo de aproximadamente 1 semana a aproximadamente 48 semanas.
12. La composición de la reivindicación 11 para el uso de la reivindicación 1, en la que el interferón se administra al paciente durante un periodo de aproximadamente 1 semana a aproximadamente 4-12 semanas.
13. La composición de la reivindicación 8 para el uso de la reivindicación 1, en la que el interferón se administra al paciente entre 1 y 3 veces cada semana.
14. La composición de la reivindicación 8 para el uso de la reivindicación 1, en la que la administración del interferón se inicia después de tratar el paciente con el compuesto durante un periodo de tiempo predeterminado.
15. La composición de la reivindicación 14 para el uso de la reivindicación 1, en la que el periodo de tiempo predeterminado es de entre aproximadamente 3 días y aproximadamente 6 meses.
16. La composición de la reivindicación 15 para el uso de la reivindicación 1, en la que el periodo de tiempo predeterminado es de entre aproximadamente 1 semana y aproximadamente 4 semanas.
17. La composición de la reivindicación 1 para el uso de la reivindicación 1, en la que el compuesto se administra al paciente de una a tres veces cada día durante un periodo de tiempo predeterminado.
18. La composición de la reivindicación 7 para el uso de la reivindicación 1, en la que el uno o más agentes activos adicionales comprenden un agente antidiabético.
19. La composición de la reivindicación 18 para el uso de la reivindicación 1, en la que el agente antidiabético se formula separadamente del compuesto.
20. La composición de la reivindicación 2 para el uso de la reivindicación 1, en la que la composición comprende el compuesto y uno o más agentes activos adicionales seleccionados del grupo consistente en un interferón, un agente antidiabético, ribavirina y 2-metilcitidina.
21. La composición de la reivindicación 20 para el uso de la reivindicación 1, que comprende además un agente antidiabético.
22. La composición de la reivindicación 20 para el uso de la reivindicación 1, que comprende además un interferón.
23. La composición de la reivindicación 20 para el uso de la reivindicación 1, que comprende además un interferón y un agente antidiabético.
24. Una composición para uso en un método de tratamiento de hepatitis C que comprende nitazoxanida, tizoxanida o una mezcla de las mismas, en la que el método comprende: (a) pretratar el paciente durante un periodo de tiempo predeterminado con la composición y (b) después del periodo de tiempo predeterminado, administrar al paciente una cantidad terapéuticamente eficaz de una segunda composición que comprende un agente activo seleccionado del grupo consistente en un interferón, un agente antidiabético, ribavirina y 2-metilcitidina.
25. La composición de la reivindicación 24 para el uso de la reivindicación 24, en la que el periodo de tiempo predeterminado es de entre aproximadamente 3 días y aproximadamente 3 meses.
26. La composición de la reivindicación 25 para el uso de la reivindicación 24, en la que el periodo de tiempo predeterminado es de entre aproximadamente 1 semana y aproximadamente 4 semanas.
27. La composición de la reivindicación 24 para el uso de la reivindicación 24, en la que el agente activo es un interferón seleccionado de interferón a-2a, interferón a-2b y un conjugado de polietilenglicol con interferón a-2a o interferón a-2b.
28. La composición de la reivindicación 27 para el uso de la reivindicación 24, en la que la segunda composición comprende además un compuesto seleccionado de nitazoxanida, tizoxanida o una mezcla de las mismas.
29. Una combinación para uso en el tratamiento de hepatitis C que comprende un interferón y un compuesto seleccionado de nitazoxanida, tizoxanida o una mezcla de las mismas.
30. La combinación de la reivindicación 29 para el uso de la reivindicación 29, en la que se reduce la cantidad de interferón requerida para conseguir una respuesta mantenida en el paciente en comparación con la cantidad de interferón requerida para conseguir una respuesta mantenida en el paciente sin administración de nitazoxanida, tizoxanida o mezclas de las mismas.
31. La combinación de la reivindicación 29 para el uso de la reivindicación 29, en la que se reduce la cantidad de interferón requerida para conseguir una respuesta mantenida en el paciente en comparación con la cantidad de interferón requerida para conseguir una respuesta mantenida en el paciente cuando se trata con una combinación de ribavirina e interferón.
32. La combinación de la reivindicación 29 para el uso de la reivindicación 29, en la que la composición proporciona al paciente una oportunidad aumentada de tener ARN de HCV sérico reducido después del tratamiento en comparación con una composición para tratar hepatitis C con una combinación de ribavirina e interferón.
33. La combinación de la reivindicación 29 para el uso de la reivindicación 29, en la que la composición proporciona al paciente una oportunidad similar de tener ARN de HCV sérico reducido después del tratamiento en comparación con una composición para tratar hepatitis C con una combinación de ribavirina e interferón.
34. La combinación de la reivindicación 29 para el uso de la reivindicación 29, en la que la composición produce menos efectos secundarios en comparación con una composición para tratar hepatitis C con una combinación de ribavirina e interferón.
35. Una composición para uso en un método de tratamiento de hepatitis C que comprende nitazoxanida, en la que el método comprende
a) pretratar el paciente con una dosis diaria de 100 mg a 2000 mg de nitazoxanida durante un periodo de tiempo predeterminado de 3 días a 4 semanas; y
b) después del periodo de tiempo predeterminado, tratar al paciente durante 1-48 semanas con un interferón, opcionalmente en combinación con nitazoxanida y/o ribavirina.
36. La composición de la reivindicación 35 para el uso de la reivindicación 35, en la que el interferón se selecciona de interferón a-2a, interferón a-2b y un conjugado de polietilenglicol con interferón a-2a o interferón a-2b.
37. La composición de la reivindicación 35 para el uso de la reivindicación 35, en la que se evita completamente el uso de ribavirina.
38. La composición de la reivindicación 35 para el uso de la reivindicación 35, en la que el periodo de tiempo predeterminado es de 1 semana a 4 semanas.
Fig. 1a Fig. 1b Fig. 2a Fig. 2b Diagrama de flujo del destino de los pacientes
FIG. 3 FIG. 4 FIG. 5 Diagrama de flujo del destino de los pacientes FIG. 6 FIG. 7 FIG. 8
Patentes similares o relacionadas:
Moléculas de fusión anticuerpos-mutante de interferón modificadas, del 6 de Mayo de 2020, de ImmunGene, Inc: Una molécula de fusión genéticamente modificada que comprende un anticuerpo antígeno asociado a tumor (AAT) (Ab) unido a una molécula mutante de interferón alfa (IFN-α), […]
Politerapia para el tratamiento de infecciones por VHB, del 25 de Marzo de 2020, de Novira Therapeutics Inc: rn inhibidor del ensamblaje de la cápside y peginterferón alfa-2a, siendo el inhibidor del ensamblaje de la cápside un compuesto de fórmula IVc: **(Ver fórmula)** o […]
Métodos y composiciones para suministrar agentes activos con propiedades farmacológicas potenciadas, del 11 de Marzo de 2020, de DUKE UNIVERSITY: Una formulación farmacéutica que comprende una cantidad efectiva de un agente terapéutico conjugado con un péptido similar a la elastina (ELP), […]
Productos conjugados de proteína-polímero, del 12 de Febrero de 2020, de PharmaEssentia Corporation: Un producto conjugado para su uso en el tratamiento de la mielofibrosis idiopática, policitemia vera o trombocitemia esencial, que tiene la fórmula **(Ver fórmula)** […]
Compuestos de polímero de polialquileno y usos de los mismos, del 20 de Noviembre de 2019, de Biogen MA Inc: Una composición farmacéutica que comprende un conjugado y un vehículo, adyuvante, diluyente, conservante y/o solubilizante farmacéuticamente […]
Procedimientos de tratamiento o prevención de enfermedades neurológicas, del 6 de Noviembre de 2019, de Mesoblast, Inc: Una población de células enriquecida con células multipotentes STRO-1+, TNAP+ para su uso en el tratamiento o prevención de una enfermedad neurológica inflamatoria, […]
Heterodímero proteínico y uso del mismo, del 18 de Septiembre de 2019, de Dingfu Biotarget Co., Ltd: Complejo proteínico, que comprende una cadena pesada y una cadena ligera de un anticuerpo específico para un antígeno tumoral; y una […]
Fusocinas que implican citocinas con afinidades de unión al receptor fuertemente reducidas, del 11 de Septiembre de 2019, de VIB VZW: Una composición que comprende una proteína de fusión que comprende al menos dos citocinas, donde las citocinas son XCL1 e IFNα2, y donde IFNα2 comprende […]