TIMOSINA ALFA1 UNIDA A FASE SOLIDA Y METODO DE SINTESIS.
El péptido conjugado de fórmula I **(Ver fórmula)** en donde cada residuo de aminoácido está individualmente protegido o no protegido,
R3 es una resina PEG en fase sólida la cual comprende un enlazador integral, R2 es un enlazador injertado con x siendo 0 ó 1 y R1 es hidrógeno, un grupo de protección o un radical peptidilo, preferiblemente un radical peptidilo que cuenta con menos de 50, preferiblemente menos de 25 residuos de aminoácido, y en donde si R1 es un radical peptidilo, los residuos de aminoácido individuales de dicho radical están individualmente protegidos o no están protegidos y el extremo N-terminal de dicho radical está libre, está acetilado o está protegido con un grupo de protección Y
Tipo: Resumen de patente/invención. Número de Solicitud: W06004192EP.
Solicitante: LONZA AG.
Nacionalidad solicitante: Suiza.
Dirección: MUNCHENSTEINERSTRASSE 38,4052 BASEL.
Inventor/es: TULLA PUCHE,JUDIT, ALBERICIO,FERNANDO, CRUZ,LUIS,JAVIER, GARCIA,RAMOS YESICA.
Fecha de Publicación: .
Fecha Concesión Europea: 26 de Agosto de 2009.
Clasificación Internacional de Patentes:
- A61K47/48H4P
- A61K47/48W26
- C07K1/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › sobre soportes.
- C07K14/575N
- C07K17/08 C07K […] › C07K 17/00 Péptidos fijados sobre un soporte o inmovilizados; Su preparación. › siendo el soporte un polímero sintético.
- C07K7/06A
- C07K7/08A
Clasificación PCT:
- C07K1/04 C07K 1/00 […] › sobre soportes.
- C07K14/575 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Hormonas.
- C07K17/08 C07K 17/00 […] › siendo el soporte un polímero sintético.
Fragmento de la descripción:
Timosina a1 unida a fase sólida y método de síntesis.
La presente invención se refiere a un método de síntesis de péptidos en fase sólida para un péptido que es extraordinariamente difícil de sintetizar, y a los péptidos conjugados en fase sólida respectivos.
El reto de la síntesis de péptidos en fase sólida es que a pesar de que existen métodos rutinarios bien establecidos, la síntesis exitosa y eficiente es altamente dependiente de la secuencia del péptido a ser sintetizado.
Algunas secuencias peptídicas, tomadas de segmentos de proteínas o péptidos naturales, simplemente funcionan mucho peor que otros en los mismos materiales de resinas usados muy exitosamente con muchos péptidos "normales". En la literatura, una sintonización precisa frecuentemente cuidadosa de sistemas de solventes ha sido propuesta en vista de prevenir la agregación entre-cadena de la resina en virtud de la formación beta-laminar. Aun entonces, el diseño de solventes usando diclorometano, N-metil-pirrolidona o dimetilformamida, eventualmente complementados con solventes polares particulares que estabilizan una estructura helicoidal tales como el trifluoro-etanol, está lejos de proporcionar un remedio general para péptidos difíciles.
La Timosina a1 (nombre farmacéutico internacional sin propietario: timalfasina) es una hormona de péptido 28-mer N-acetilada que ocurre en la glándula del timo humano y es usada como fármaco para tratar hepatitis B crónica.
Su síntesis en fase sólida lineal completa ha sido descrita anteriormente pero sufre de rendimientos bajos hasta ahora. Desafortunadamente, la secuencia de aminoácidos de la Timosina a1 no ofrece una glicina o prolina que podría ser usada como un residuo que se une en una aproximación de acoplamiento del segmento clásico en una aproximación gradual para la síntesis.
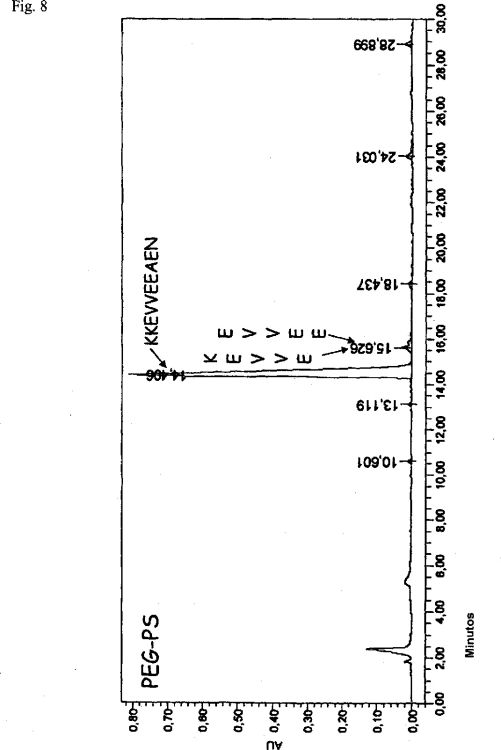
Echner et al. (Liebigs Ann. Chem. 1988, 1095-1097) describe la síntesis lineal en fase sólida en una resina de poliestireno Wang. Aunque la eficiencia de acoplamiento es alegadamente verificada después de cada acoplamiento con el reactivo BOP en DMF por medio de la Prueba de Kaiser, se efectúa el acoplamiento con el reactivo BOP en DMF por medio de la Prueba de Kaiser, únicamente después de cada quinto acoplamiento que cubre el péptido no acoplado mediante acetilación. El desdoblamiento del péptido protegido y terminalmente acetilado de la resina es logrado con ácido trifluoroacético concentrado; posteriormente la resina y la fase líquida son separados mediante filtración y el producto del péptido es recolectado mediante precipitación con dietiléter. El precipitado recolectado de esta manera es cuantificado y es designado "producto crudo" el rendimiento es calculado como de 76%. Solo posteriormente, se intenta una primera purificación cromatográfica del producto crudo, seguida por HPLC de fase inversa. No se indicó el rendimiento para el producto puro así obtenido.
Un problema con la aproximación de Echner es que el acoplamiento de cadena incompleto, que conlleva a variantes de secuencia indeseables reducidas durante la síntesis, no se toma en cuenta para el calculo del rendimiento. "Producto crudo" equivale a cada especie peptídica obtenida durante la síntesis, incluyendo el péptido incompletamente desprotegido/alquilado. Sin embargo, la pureza del péptido obtenido a partir de síntesis lineal es un problema cuando se tratan péptidos difíciles; De manera interesante, Echner no da ninguna indicación del rendimiento de producto purificado así obtenido, ni proporciona ningún cromatograma de HPLC en la publicación como se hacer de forma rutinaria en la técnica para proporcionar calidad de síntesis. En nuestra opinión, el esquema sintético de Echner proporciona únicamente rendimientos muy bajos del producto correcto, un gran parte del producto incorrecto del péptido constituye la mayoría del producto crudo.
Otro problema con la aproximación de Echner que el mismo autor plantea (p. 1095, columna izquierdo, 3er. párrafo) es la carga de la resina de Wang con el aminoácido C-terminal de la Timosina a1 que es una asparagina; la carga que Echner alcanza es de 0,15 mmol/g, que es extremadamente baja. El aminoácido Fmoc-Asn(4,4'-dimetoxi-difenilmetil-)-OH debe ser usado para la carga de la resina sin correr el riesgo de reacciones secundarias de degradación. La publicación por parte de Xiang Han (Zhonggen Yaoweter thxue Zathi, 2009, 14(1), 27-29) describe otra síntesis de timosina. Es un objetivo de la presente invención visualizar una síntesis mejorada en fase sólida para la Timosina a1. Este objetivo se cumple mediante el método de la reivindicación 1.
De conformidad con la presente invención, se proporciona un método para sintetizar en una fase sólida Timosina a1 o una versión truncada en C-terminal que comprende los residuos 1-27 o una versión truncada en N-terminal que comprende al menos los residuos 19-28 o una versión truncada que comprende al menos los residuos 19-27 de Timosina a1 madura, que comprende las etapas de
- a. acoplar un residuo FMOC-Glu o FMOC-Asn protegido adecuadamente en una resina PEG, dicha resina PEG seleccionada preferiblemente del grupo que comprende resinas mixtas de poliestireno-PEG, resinas mixtas de PEG poliéter-poliéster o resinas mixtas de PEG poliéter-poliamida y resinas PEG esencialmente puras.
- b. alargar la cadena del péptido mediante síntesis FMOC en donde las cadenas laterales de aminoácidos individuales pueden ser derivatizadas con grupos de protección adecuados
- c. acetilar opcionalmente el ultimo residuo N-terminal y
- d. cortar el péptido de la resina.
El presente método permite sintetizar el péptido timalfasina en una pureza sin precedente y por lo tanto alto rendimiento en una sola aproximación de síntesis lineal en fase sólida. De conformidad con la presente invención, puede ser factible no obstante sintetizar solo un fragmento C-terminal en una fase sólida y constituir cualquier péptido completo o en por lo menos una versión más larga del péptido mediante el acoplamiento del segmento, usando en una modalidad preferida el acoplamiento de un fragmento N-terminal que tiene una Ser o Thr C-terminal el cual está protegido para racemización mediante el método del dipéptido pseudoprolina (Wöhr et al., J. Am. Chem. Soc. 118, 9218).
Preferiblemente, el péptido a ser sintetizado es la Timosina a1 (también referido como Timosina a1 activa, madura para distinguirla de péptidos precursores) que tiene la secuencia
en donde las cadenas de aminoácidos individuales están no protegidas o están protegidas convenientemente, según sea necesario para un residuo de aminoácido individual dado como se sabe en el arte (ver Bodansky, infra, por ejemplo). Más preferiblemente, tal péptido está acetilado en el extremo N-terminal en una etapa subsiguiente a la síntesis lineal pero antes de desdoblarlo de la resina. La timalfasina natural la cual es usada también como un producto farmacéutico está acetilada en su extremo N-terminal.
Notablemente, los presentes inventores han encontrado que es principalmente la mitad C-terminal del péptido timalfasina, de aproximadamente los residuos 19-28, la que incurre en la mayoría de las impurezas por supresiones de cadena y por lo tanto pérdidas en el rendimiento del producto final generadas durante la síntesis en fase lineal. Se ha encontrado que esta parte del péptido es extremadamente difícil de sintetizar.
Viceversa, durante la síntesis lineal es también posible usar tales dipéptidos de oxazolidina de conformidad con Wöhr et al., supra. Un beneficio de usar tal dipéptido en lugar de un aminoácido protegido individual, preferiblemente Fmoc-, puede ser inferido de la secuencia de timalfasina en particular para el dipéptido Asp-Thr; el uso del derivado del dipéptido de oxazolidina ayudaría aquí a evitar la formación de aspartimida durante la síntesis.
De manera similar, la prevención de la formación de glutarimida puede requerir el uso de grupos especiales de protección.
Aunque la presente invención prefiere enfáticamente la química del Fmoc para llevar a cabo las reacciones de acoplamiento, la química del Boc puede asimismo ser usada en otra modalidad...
Reivindicaciones:
1. El péptido conjugado de fórmula I
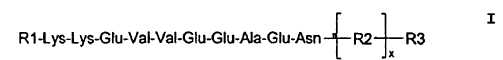
en donde cada residuo de aminoácido está individualmente protegido o no protegido, R3 es una resina PEG en fase sólida la cual comprende un enlazador integral, R2 es un enlazador injertado con x siendo 0 ó 1 y R1 es hidrógeno, un grupo de protección o un radical peptidilo, preferiblemente un radical peptidilo que cuenta con menos de 50, preferiblemente menos de 25 residuos de aminoácido, y en donde si R1 es un radical peptidilo, los residuos de aminoácido individuales de dicho radical están individualmente protegidos o no están protegidos y el extremo N-terminal de dicho radical está libre, está acetilado o está protegido con un grupo de protección Y.
2. El péptido conjugado según la reivindicación anterior, caracterizado por que el grupo de protección Y es un grupo Fmoc, un grupo tipo Dde, un grupo Boc o un derivado de dichos grupos de protección, preferiblemente un derivado de un grupo tipo Dde o Fmoc, que comprende una porción que permite la unión de afinidad reversible del péptido así protegido a un material de matriz sólida adecuado de cromatografía.
3. El péptido conjugado según la reivindicación 1, caracterizado por que el grupo de protección Y permite la unión de afinidad reversible a un material de matriz sólida de cromatografía con afinidad a un metal inmovilizado.
4. El péptido conjugado según una de las reivindicaciones anteriores, caracterizado por que R1 es Y-Ser-Asp-Ala-Ala-Val-Asp-Thr-Ser-Ser-Glu-Ile-Thr-Thr-Lys-Asp-Leu-Lys-Glu-, Ac-Ser-Asp-Ala-Ala-Val-Asp-Thr-Ser-Ser-Glu-Ile-Thr-Thr-Lys-Asp-Leu-Lys-Glu o H-Ser-Asp-Ala-Ala-Val-Asp-Thr-Ser-Ser-Glu-Ile-Thr-Thr-Lys-Asp-Leu-Lys-Glu-Leu-Lys-Glu en donde Y tiene el significado mencionado anteriormente.
5. Método para sintetizar Timosina a1, una versión truncada en el extremo C-terminal de Timosina a1 que comprende los residuos 1-27, una versión truncada en N-terminal de Timosina a1 que comprende al menos los residuos 19-28 o una versión truncada que comprende al menos los residuos 19-27 de Timosina a1 madura en una fase sólida, que comprende las etapas de
- a. acoplar un residuo FMOC-Glu, FMOC-Asp o FMOC-Asn protegido adecuadamente en una resina PEG en fase sólida, dicha resina PEG seleccionada preferiblemente del grupo que comprende resinas mixtas de poliestireno-PEG, resinas mixtas de PEG poliéter-poliéster o resinas mixtas de PEG poliéter-poliamida y resinas PEG esencialmente puras.
- b. alargar la cadena del péptido mediante síntesis FMOC en donde las cadenas laterales de los aminoácidos individuales pueden ser derivatizadas con grupos de protección adecuados
- c. acetilar opcionalmente el ultimo residuo N-terminal y
- d. cortar el péptido de la resina.
6. El método según la reivindicación 5, caracterizado por que el péptido sintetizado es Timosina a1 que tiene la secuencia
en donde las cadenas de aminoácido individuales no están protegidas o están protegidas convenientemente.
7. El método según la reivindicación 5, caracterizado por que la resina PEG es una resina anfifílica.
8. El método según la reivindicación 7, caracterizado por que la capacidad de carga de la resina PEG es al menos de 0,5 mmol/g, estando dicha resina PEG preferiblemente esencialmente exenta de una porción copolimérica de poliestireno.
9. El método según la reivindicación 7, caracterizado por que la resina PEG, con la excepción de los enlazadores integral y/o injertados, es una resina de poliéter-PEG sustancialmente pura, preferiblemente es una resina de PEG-poliéter pura.
Patentes similares o relacionadas:
Secuenciación por síntesis usando óptica de lectura por pulsos, del 19 de Febrero de 2020, de IBIS BIOSCIENCES, INC: Un sistema para fotoescindir y explorar análogos de nucleótidos que comprende: a) un sustrato que comprende una pluralidad de pocillos que contienen cada uno, o están configurados […]
Conjugado de péptido-resina y su utilización, del 18 de Septiembre de 2019, de Chemical & Biopharmaceutical Laboratories of Patras S.A: Un procedimiento para preparar un péptido, o una sal del mismo, de un conjugado de péptido-resina de las Fórmulas (2b), (2c), (2d), (2e) o (2f),**Fórmula** […]
Polipéptidos de relaxina modificados y sus usos, del 5 de Junio de 2019, de AMBRX, INC: Un polipéptido de relaxina modificado que comprende un aminoácido codificado de modo no natural, en donde: (a) el polipéptido de relaxina comprende el polipéptido de cadena […]
Conjugados de polisacáridos y proteínas acoplados reversiblemente a través de enlaces imina, del 3 de Abril de 2019, de THERAPURE BIOPHARMA INC.: Una composición de polisacárido oxidado-proteína para su uso como agente terapéutico o de diagnóstico, en donde la composición comprende un polisacárido oxidado […]
Procedimiento de síntesis de proteínas, del 5 de Marzo de 2019, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (C.N.R.S.): Procedimiento de ensamblaje de fragmentos peptídicos para fabricar un polipéptido que comprende n fragmentos peptídicos y al menos n-1 aminoácidos […]
Procedimientos para la preparación de análogos de oxitocina, del 18 de Febrero de 2019, de F. HOFFMANN-LA ROCHE AG: Procedimiento para la preparación de análogos de oxitocina de fórmula I **Fórmula** en la que R1 es hidrógeno o alquilo C1-7 y R2 es hidrógeno […]
Método para preparar exenatida, del 29 de Octubre de 2018, de Hybio Pharmaceutical Co., Ltd: Un método para la preparación de exenatida, que se caracteriza por comprender las siguientes etapas: Etapa 1: se obtiene serina-resina mediante un primer […]
Síntesis de péptidos en fase sólida con BOC y FMOC, del 18 de Septiembre de 2018, de Ipsen Manufacturing Ireland Limited: Un método para preparar un péptido de fórmula H-D-β-Nal-[Cys-Tyr-D-Trp-Lys-Val-Cys]-Thr-NH2, en donde dicho método comprende las etapas de: (a) anclar […]