SUMINISTRO VASCULAR LOCAL DE 2-METOXIESTRADIOL EN COMBINACION CON RAPAMICINA PARA PREVENIR LA REESTENOSIS DESPUES DE UNA LESION VASCULAR.
Un dispositivo médico que comprende:
una estructura implantable;
una matriz de cubierta base, que incluye una combinación de rapamicina y 2-metoxiestradiol, en dosis terapéuticas, incorporadas en un primer material polimérico que comprende un fluoropolímero, estando la matriz de cubierta base fijada a la superficie del dispositivo médico implantable; y
una cubierta superior, que incluye un segundo material polimérico que comprende un polímero acrílico, fijado a la matriz de cubierta base para controlar la velocidad de elución de la rapamicina y del 2-metoxiestradiol,
en el que el segundo material polimérico es incompatible con el primer material polimérico, creando de este modo ambos una barrera física y química para la elución de rapamicina y 2-metoxiestradiol
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E05251712.
Solicitante: CORDIS CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 14201 N.W. 60TH AVENUE,MIAMI LAKES, FLORIDA 33014.
Inventor/es: FALOTICO, ROBERT, PARRY,TOM JAY, ZHAO,JONATHON Z.
Fecha de Publicación: .
Fecha Solicitud PCT: 21 de Marzo de 2005.
Fecha Concesión Europea: 21 de Julio de 2010.
Clasificación Internacional de Patentes:
- A61L27/34 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Materiales macromoleculares.
- A61L27/54 A61L 27/00 […] › Materiales biológicamente activos, p. ej. sustancias terapéuticas.
- A61L31/10 A61L […] › A61L 31/00 Materiales para otros artículos quirúrgicos. › Materiales macromoleculares.
- A61L31/16 A61L 31/00 […] › Materiales biológicamente activos, p. ej. sustancias terapéuticas.
Clasificación PCT:
- A61L31/16 A61L 31/00 […] › Materiales biológicamente activos, p. ej. sustancias terapéuticas.
Clasificación antigua:
- A61L31/16 A61L 31/00 […] › Materiales biológicamente activos, p. ej. sustancias terapéuticas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
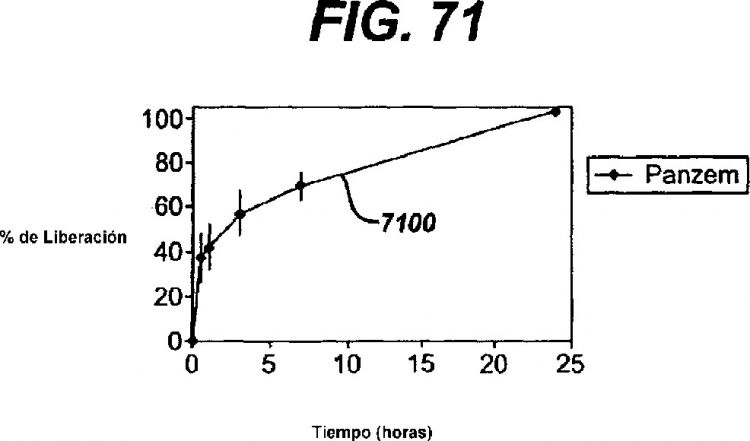
Fragmento de la descripción:
Suministro vascular local de 2-metoxiestradiol en combinación con rapamicina para prevenir la reestenosis después de una lesión vascular.
Antecedentes de la invención
La presente invención se refiere a la administración local de fármaco/combinaciones de fármaco para la prevención y el tratamiento de enfermedades vasculares y, más particularmente, a dispositivos médicos intraluminales para el suministro local de fármaco/combinaciones de fármaco para la prevención y el tratamiento de una enfermedad vascular causada por lesión y procedimientos y dispositivos para mantener las fármaco/combinaciones de fármaco en los dispositivos médicos intraluminales, así como para evitar el daño al dispositivo médico. La presente invención también se refiere a dispositivos médicos, incluyendo endoprótesis vasculares, injertos, dispositivos anastomóticos, vendajes perivasculares, suturas y grapas que tienen fármacos, agentes y/o compuestos fijados a ellos para tratar y prevenir la enfermedad y minimizar o eliminar sustancialmente la reacción de un organismo biológico a la introducción del dispositivo médico en el organismo. Además, los fármacos, agentes y/o compuestos pueden utilizarse para promover la curación y endotelización. La presente invención también se refiere a revestimientos para el control de las tasas de elución de fármacos, agentes y/o compuestos de dispositivos médicos implantables.
Muchos individuos sufren de enfermedades circulatorias causadas por un bloqueo progresivo de los vasos sanguíneos que perfunde el corazón y otros órganos principales. Bloqueos más graves de vasos sanguíneos en dichos individuos con frecuencia conducen a hipertensión, lesión isquémica, accidente cerebrovascular o infarto de miocardio. Las lesiones ateroscleróticas, que limitan u obstruyen el flujo sanguíneo coronario, son la principal causa de enfermedad cardiaca isquémica. La angioplastia coronaria transluminal percutánea es un procedimiento médico cuyo propósito es aumentar el flujo sanguíneo a través de una arteria. La angioplastia coronaria transluminal percutánea es el tratamiento predominante para la estenosis de los vasos coronarios. El creciente uso de este procedimiento es atribuible a su tasa de éxito relativamente alta y su invasividad mínima comparada con la cirugía de derivación coronaria. Una limitación asociada con la angioplastia coronaria transluminal percutánea es el cierre brusco del vaso, que puede ocurrir inmediatamente después del procedimiento, y la reestenosis, que ocurre gradualmente después del procedimiento. Adicionalmente, la reestenosis es un problema crónico en pacientes que se han sometido a injertos de derivación de la vena safena. El mecanismo de oclusión aguda parece implicar diversos factores y puede resultar del retroceso vascular con el resultante cierre de la arteria y/o deposición de plaquetas sanguíneas y fibrina a lo largo de la longitud dañada del vaso sanguíneo que acaba de abrirse.
La reestenosis después de angioplastia coronaria transluminal percutánea es un proceso más gradual iniciado por una lesión vascular. Múltiples procesos, incluyendo trombosis, inflamación, liberación de factores de crecimiento y citocina, proliferación celular, migración celular y síntesis de matriz extracelular contribuyen, cada uno, al proceso reestenótico.
Aunque el mecanismo exacto de la reestenosis no se comprende completamente, se han identificado los aspectos generales del proceso de reestenosis. En la pared arterial normal, las células de músculo liso proliferan a una tasa baja, aproximadamente menos de 0,1 por ciento por día. Las células de músculo liso de las paredes vasculares existen en un fenotipo contráctil caracterizado por tener del ochenta al noventa por ciento del volumen citoplásmico celular ocupado por el aparato contráctil. El retículo endoplásmico, Golgi y ribosomas libres son escasos y se localizan en la región perinuclear. La matriz extracelular rodea a las células de músculo liso y es rica en glucosaminoglicanos de tipo heparina, que se cree que son responsables de mantener las células de músculo liso en su estado fenotípico contráctil (Campbell y Campbell, 1985).
Tas la expansión por presión de un catéter de globo intracoronario durante la angioplastia, las células de músculo liso y células endoteliales dentro de la pared vascular sufren lesiones, iniciando una respuesta trombótica e inflamatoria. Los factores de crecimiento derivados de células tales como factor de crecimiento derivado de plaquetas, factor de crecimiento de fibroblastos básico, factor de crecimiento epidérmico, trombina, etc., liberados de plaquetas, macrófagos invasores y/o leucocitos o procedentes directamente de las células de músculo liso provocan una respuesta proliferativa y migratoria en células de músculo liso mediales. Estas células sufren un cambio del fenotipo contráctil al fenotipo sintético caracterizado por solamente unos pocos haces de filamentos contráctiles, extenso retículo endoplásmico rugoso, Golgi y ribosomas libres. La proliferación/migración comienza usualmente en un periodo de uno a dos días después de la lesión y alcanza su máximo varios días después (Campbell y Campbell, 1987; Clowes y Schwartz, 1985).
Las células hijas migran a la capa de la íntima de músculo liso arterial y continúan proliferando y secretando cantidades significativas de proteínas de la matriz extracelular. La proliferación, migración y síntesis de matriz extracelular continúan hasta que la capa endotelial dañada se repara, momento en el cual la proliferación se ralentiza dentro de la íntima, usualmente en el periodo de siete a catorce días después de la lesión. El tejido de nueva formación se llama neoíntima. El estrechamiento vascular posterior que sucede durante los siguientes tres a seis meses se debe principalmente a remodelación negativa o constrictiva.
Simultáneamente con la proliferación local y la migración, las células inflamatorias se adhieren al sitio de la lesión vascular. En el periodo de tres a siete días después de la lesión, las células inflamatorias han migrado a las capas más profundas de la pared vascular. En modelos animales que emplean lesión por globo o implantación de endoprótesis vascular, las células inflamatorias pueden persistir en el sitio de la lesión vascular durante al menos treinta días (Tanaka y col., 1993; Edelman y col., 1998). Las células inflamatorias, por lo tanto, están presentes y pueden contribuir a la fase tanto aguda como crónica de la reestenosis.
Se han examinado numerosos agentes con respecto a sus supuestas acciones antiproliferativas en reestenosis y se ha mostrado algo de actividad en modelos animales experimentales. Algunos de los agentes que han mostrado que reducen satisfactoriamente el alcance de la hiperplasia de la íntima en modelos animales incluyen: heparina y fragmentos de heparina (Clowes, A.W. y Karnovsky M., Nature 265: 25-26, 1977; Guyton, J.R. y col., Circ. Res., 46: 625-634, 1980; Clowes, A.W. y Clowes, M.M., Lab. Invest. 52: 611-616, 1985; Clowes, A.W. y Clowes, M.M., Circ. Res. 58: 839-845, 1986; Majesky y col., Circ. Res. 61: 296-300, 1987; Snow y col., Am. J. Pathol. 137: 313-330, 1990; Okada, T. y col., Neurosurgery 25: 92-98, 1989), colchicina (Currier, J.W. y col., Circ. 80: 11-66, 1989), taxol (Sollot, S.J. y col., J. Clin. Invest. 95: 1869-1876, 1995), inhibidores de la enzima de conversión de angiotensina (ECA) (Powell, J.S. y col., Science, 245: 186-188, 1989), angiopeptina (Lundergan, C.F. y col. Am. J. Cardiol. 17(Suppl. B):132B-136B, 1991), ciclosporina A (Jonasson, L. y col., Proc. Natl., Acad. Sci., 85: 2303, 1988), anticuerpo de cabra anti PDGF de conejo (Ferns, G.A.A., y col., Science 253: 1129-1132, 1991), terbinafina (Nemecek, G.M. y col., J. Pharmacol. Exp. Thera. 248: 1167-1174, 1989), trapidil (Liu, M.W. y col., Circ. 81: 1089-1093, 1990), tranilast (Fukuyama, J. y col., Eur. J. Pharmacol. 318: 327-332, 1996), interferón gamma (Hansson, G.K. y Holm, J., Circ. 84: 1266-1272, 1991), rapamicina (Marx, S.O. y col., Circ. Res. 76: 412-417, 1995), esteroides (Colburn, M.D. y col., J. Vasc. Surg. 15: 510-518, 1992), véase también Berk, B.C. y col., J. Am. Coll. Cardiol. 17: 111B-117B, 1991), radiación ionizante (Weinberger, J. y col., lnt. J. Rad. Onc. Biol. Phys. 36: 767-775, 1996), toxinas de fusión (Farb, A. y col., Circ. Res. 80: 542-550, 1997), oligonucleótidos antisentido (Simons, M. y col., Nature 359: 67-70, 1992) y vectores génicos (Chang, M.W. y col., J. Clin. Invest. 96: 2260-2268, 1995). La acción antiproliferativa en células...
Reivindicaciones:
1. Un dispositivo médico que comprende:
una estructura implantable;
una matriz de cubierta base, que incluye una combinación de rapamicina y 2-metoxiestradiol, en dosis terapéuticas, incorporadas en un primer material polimérico que comprende un fluoropolímero, estando la matriz de cubierta base fijada a la superficie del dispositivo médico implantable; y
una cubierta superior, que incluye un segundo material polimérico que comprende un polímero acrílico, fijado a la matriz de cubierta base para controlar la velocidad de elución de la rapamicina y del 2-metoxiestradiol,
en el que el segundo material polimérico es incompatible con el primer material polimérico, creando de este modo ambos una barrera física y química para la elución de rapamicina y 2-metoxiestradiol.
2. El dispositivo médico de acuerdo con una cualquiera de las reivindicaciones precedentes, en el que la estructura implantable comprende una endoprótesis vascular.
3. El dispositivo médico de acuerdo con una cualquiera de las reivindicaciones 1 a 2, en el que la estructura implantable comprende una endoprótesis-injerto.
4. El dispositivo médico de acuerdo con una cualquiera de las reivindicaciones 1 a 2, en el que la estructura implantable comprende un dispositivo de anastomosis.
Patentes similares o relacionadas:
Películas de proteína de múltiples capas, métodos de preparación y dispositivos de suministro de fármacos e implantes biomédicos que emplean las películas, del 15 de Julio de 2020, de AddBIO AB: Un implante biomédico que comprende un sustrato de implante y una película de proteína de múltiples capas en al menos una porción de la superficie del sustrato de implante, […]
Dispositivo médico que tiene un revestimiento que comprende ACCS, del 15 de Julio de 2020, de Noveome Biotherapeutics, Inc: Un dispositivo médico implantable que tiene un revestimiento en su superficie, útil para la implantación quirúrgica en el cuerpo de un sujeto, […]
Matriz de soporte de injerto para reparación de cartílago y procedimiento de obtención de la misma, del 1 de Julio de 2020, de ETH ZURICH: Un procedimiento de proporción de una matriz de soporte de injerto para reparación de cartílagos, particularmente en un paciente humano, que comprende las etapas de: […]
Composición de fármaco y revestimiento asociado, del 1 de Julio de 2020, de W.L. GORE & ASSOCIATES, INC.: Un producto sanitario para administrar un agente terapéutico a un tejido, y el producto tiene una capa de revestimiento aplicada en una superficie del producto, y la capa […]
Métodos y dispositivos para trasplante celular, del 10 de Junio de 2020, de Sernova Corporation: Un dispositivo para implantar células en un cuerpo huésped, que comprende: un andamio poroso que comprende al menos una cámara que tiene un extremo proximal y un extremo […]
Composiciones y métodos para el tratamiento de huecos óseos y fracturas abiertas, del 22 de Abril de 2020, de Polypid Ltd: Una composición farmacéutica que comprende partículas de relleno óseo recubiertas y no recubiertas en una proporción entre aproximadamente 1:3 […]
Procedimientos de preparación de un hidrogel esterilizado de modo terminal que proviene de matriz extracelular, del 22 de Abril de 2020, de UNIVERSITY OF PITTSBURGH OF THE COMMONWEALTH SYSTEM OF HIGHER EDUCATION: Un procedimiento de preparación de un material digerido de matriz extracelular esterilizado de modo terminal capaz de gelificar, que comprende: (i) solubilizar la matriz […]
Formulación de FGF-18 en hidrogeles de alginato/colágeno, del 15 de Abril de 2020, de Ares Trading SA: Un sistema de gelificación de dos componentes, en donde dicho sistema de gelificación se forma a partir de: a. un primer componente (solución 1) […]