SOPORTES MACROPOROSOS TRIDIMENSIONALES PARA INGENIERIA TISULAR.
Soportes macroporosos tridimensionales para ingeniería tisular.
La presente invención describe un soporte tridimensional que consiste en una matriz polimérica y partículas de tamaño nanométrico o micrométrico de un material inorgánico dispersas y homogéneamente distribuidas en dicha matriz. El soporte comprende una red continua de macroporos y microporos interconectados, y puede comprender además una fase de hidroxiapatita biomimética continua. El soporte es útil en aplicaciones de ingeniería tisular. La presente invención describe asimismo un procedimiento para la obtención del soporte, y su empleo
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200800390.
Solicitante: UNIVERSIDAD POLITECNICA DE VALENCIA
FUNDACION COMUNIDAD VALENCIANA CENTRO INVESTIGACION PRINCIPE FELIPE.
Nacionalidad solicitante: España.
Provincia: VALENCIA.
Inventor/es: GOMEZ RIBELLES,JOSE LUIS, SUAY ANTON,JULIO JOSE, MONLEON PRADAS,MANUEL, LEBOURGH,MYRIAM.
Fecha de Solicitud: 4 de Febrero de 2008.
Fecha de Publicación: .
Fecha de Concesión: 27 de Abril de 2011.
Clasificación Internacional de Patentes:
- A61L27/46 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › con cargas inorgánicas que contienen fósforo.
- A61L31/12D4
Clasificación PCT:
PDF original: ES-2331678_A1.pdf

Fragmento de la descripción:
Soportes macroporosos tridimensionales para ingeniería tisular.
Campo de la invención
La presente invención se encuadra dentro del campo de la ingeniería tisular, y más particularmente se refiere a un soporte macroporoso tridimensional, que puede ser biodegradable y reabsorbible y que comprende una matriz polímerica orgánica reforzada con partículas inorgánicas dispersas en ella, y, opcionalmente, un recubrimiento de hidroxiapatita biomimética. La invención se refiere asimismo a un procedimiento para la obtención de dicho soporte, así como al empleo del mismo en aplicaciones de ingeniería tisular.
Antecedentes de la invención
La pérdida masiva de tejido óseo debido a distintas causas como pueden ser accidentes, enfermedades graves como el cáncer etc... necesita a menudo de un implante o sustituto óseo para su recuperación.
El implante de sustituto óseo más utilizado actualmente es el auto-injerto. Esta técnica sin embargo conlleva problemas como padecimiento de dolor por parte del paciente, posible necrosis en la zona de extracción del hueso y limitación en la cantidad de material óseo que es posible obtener. El uso de aloinjertos (tejido óseo de cadáver) tiene graves inconvenientes como la trasmisión de enfermedades o rechazo inmunológico [Truumees E, Herkowitz HN. Alternatives to autologous bone Harvest in spine surgery. In: UPOJ volume 12 spring. 1999. p. 77-88. Conrad EU, Gretch DR, Obermeyer KR, et al; Transmission of the hepatitis-C virus by tissue transplantation. J Bone Joint Surg Am 1995;77-A:214-24. Friedlaender GE, Strong DM, Tomford W, Mankin HJ. Longterm follow-up of patients with osteochondral allografts. A correlation between immunologic responses and clinical outcome. Orthop Clin North Am 1999;30:583-8].
Frente a este tipo de estrategias cada vez cobra más importancia la ingeniería tisular que se define como la aplicación de los principios y los métodos de la ingeniería y las ciencias de la vida hacia el conocimiento fundamental de las relaciones entre estructura y funciones en tejidos de mamíferos, normales y patológicos; y el desarrollo de sustitutos biológicos para recuperar, mantener o mejorar la funcionalidad de los tejidos [Williams D., Materials Today (2004) 7, 24].
Las estrategias que se siguen en la ingeniería de tejidos y órganos se centran habitualmente en alguno de los tres enfoques principales siguientes: terapias basadas en células [Ma P.X., Materials Today (2004) 7, 30, Rodriguez H., et al, Tissue Engineered Medical Products (Temps). ASM International, STP 1452, PA, 2004, pag. 84], terapias basadas en soportes [Langer R., Vacanti J.P., Science (1993) 260, 920; Williams D., Materials Today (2004) 7, 24], y terapias basadas en moléculas bioactivas [Bloch J., Fine E.G., Bouche N., Zurn A.D., Aebischer P, Experimental Neurology (2001) 172, 425; King G.N. et al, Journal of Dental Research (1997) 76, 1460].
La aplicación del concepto de ingeniería tisular a la regeneración ósea ha permitido el desarrollo de distintos tipos de soportes macroporosos tridimensionales, conocidos y denominados también, de ahora en adelante, como "scaffolds", que deben servir de soporte para el crecimiento del hueso (osteoconducción) e inducir la diferenciación de las células osteogénicas hacia osteoblastos y osteoclastos (osteoinducción).
Varios materiales han demostrado ser osteoconductores (fosfatos cálcicos, vidrios bioactivos, cerámicas...). Este tipo de materiales permite un enlace directo al hueso por la similitud química con los componentes minerales de éste. Sin embargo no tienen buenas propiedades mecánicas, son frágiles y quebradizos, lo que compromete la viabilidad del implante y mucho más si el material debe ser poroso. Los materiales de este tipo disponibles en la actualidad, no ofrecen además una porosidad adecuada (ni en proporción ni en tamaño). Además la alta rigidez de las cerámicas macizas o poco porosas puede traer consigo la aparición del fenómeno de protección de cargas lo que es nefasto para el implante y su entorno.
Por otra parte se han desarrollado materiales poliméricos con propiedades mecánicas más próximas al tejido óseo que se quiere restituir, "scaffolds", de estructura y morfología similar al hueso que se quiere hacer proliferar. Aunque existe una gama de polímeros bioreabsorbibles, biocompatibles y de aplicación en contacto con el tejido óseo, estos materiales no son capaces de establecer enlaces químicos directos con el hueso. Este tipo de planteamiento está descrito en la patente US2003008395, pero el "scaffold" de PLGA divulgado, aunque tenga una estructura porosa abierta, no tiene características osteoinductoras.
Por las razones previamente expuestas, en este campo últimamente la atención se dirige a los materiales compuestos de una matriz polimérica y cargas inorgánicas en distintas proporciones. Se puede tratar de partículas cerámicas bioactivas en proporción media o elevada (en implantes porosos hasta un 60%) en una matriz polimérica como muestra la patente WO9846164, o bien de una gran cantidad de partículas con una mínima proporción de material orgánico como agente ligante (binder) tal como muestra la patente US4192021. Otras patentes que proponen diversos materiales compuestos son US5017627 que divulga un material poliolefínico no biodegradable con partículas inorgánicas; US5552454 que divulga ceras y resinas poliméricas con cerámicas biocompatibles. Las patentes mencionadas consideran el uso de los materiales mencionados para la obtención de soportes macroporosos, pero no describen técnicas de síntesis de los mismos, ni como conseguir obtener las morfologías en el soporte que se necesitan para la regeneración efectiva del hueso (porosidad, tamaño de poro, superficie efectiva etc...).
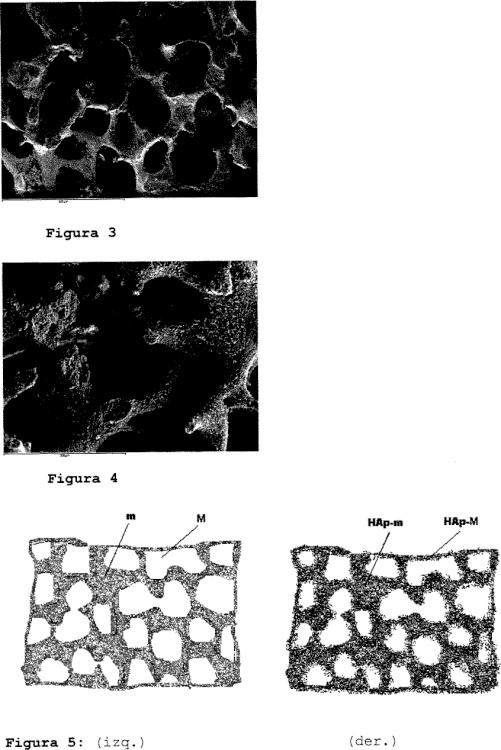
La mayoría de las cargas inorgánicas utilizadas en los materiales descritos, como cerámicas, fosfatos cálcicos etc., tienen aún en forma nanométrica, una bioactividad limitada. Un nuevo enfoque biomimético ha visto la luz, inspirado por los trabajos de P. Ma, Kokubo et al [Kokubo T, Kushitani H, Sakka S, Kitsugi T, Yamamuro T. Solution able to reproduce in vivo surface-structure change in bioactive glass-ceramic A-W. J Biomed Mater Res 1990;24:723-34; Oyane A, Kawashita M, Nakanishi K, Kokubo T, Minoda M, Miyamoto T, Nakamura T. Bonelike apatite formation on ethylene-vinyl alcohol copolymer modi.ed with silane coupling agent and calcium silicate solutions. Biomaterials 2003;24: 1729-35; Oyane A, Kawashita M, Kokubo T, Minoda M, Miyamoto T, Nakamura T. Bonelike apatite formation on ethylene-vinyl alcohol copolymer modified with a silane coupling agent and titania solution. J. Ceram. Soc. Japan 2002;110:248-54. Kawashita M, Nakao M, Minoda M, Kim HM, Beppu T,Miyamoto T, Kokubo T, Nakamura T. Apatite-forming ability of carboxyl group-containing polymer gels in a simulated body fluid. Biomaterials 2003;24:2477-84]. Se trata de hacer precipitar sobre los soportes macroporosos desarrollados los minerales desde un fluido corporal simulado (SBF), tal como ocurre en el cuerpo humano sobre distintos tejidos. Se ha desarrollado una técnica de recubrimiento de los soportes con hidroxiapatita biomimética que vale en todos los materiales que tengan grupos funcionales de tipo hidroxilo tales como los carboxilos, silanoles, TiOH, etc. Los resultados publicados (Preparation of bonelike apatite composite for tissue engineering scaffold; Hirotaka Maedaa, Toshihiro Kasuga, Masayuki Nogamia, Minoru Ueda, Science and Technology of Advanced Materials 6 (2005) 48-53) permiten intuir que las propiedades biológicas de la hidroxiapatita así obtenida son significativamente mejores que las de los fosfatos cálcicos o apatitas sintéticas tradicionales. Las causas que explican estos mejores resultados son variadas. Entre otras el pequeño tamaño de los cristales, que favorece la redisolución de los mismos en el organismo. Se trata éste de un fenómeno que no se observa con las apatitas sintéticas sinterizadas a altas temperaturas, que son altamente estables y no se descomponen. Otra causa es que la composición química de este tipo de apatita es mucho más similar a la del hueso natural.
Se conocen en el estado de la técnica diversas solicitudes de patentes, que describen la preparación de "scaffolds" con características muy diversas que se obtienen mediante el uso de variados procesos de fabricación y materiales para la regeneración ósea.
La solicitud US2003082808... [Seguir leyendo]
Reivindicaciones:
1. Un soporte tridimensional que consiste en una matriz polimérica que comprende partículas de tamaño nanométrico o micrométrico de un material inorgánico dispersas y homogéneamente distribuidas en dicha matriz polimérica.
2. Soporte según la reivindicación 1, que presenta una doble estructura porosa con una red de macroporos interconectados entre sí de tamaño comprendido entre 50 y 1000 micras con gargantas de conexión entre los macroporos de tamaños de diámetro medios superiores a 100 μm, y una segunda red de microporos interconectados entre sí, y con los macroporos, de tamaño comprendido entre 1 y 10 micras.
3. Soporte según la reivindicación 1 o 2, que presenta una porosidad en volumen comprendida entre un 50 y 95% y un módulo elástico comprendido entre 0,1 MPa y 100 MPa.
4. Soporte según cualquiera de las reivindicaciones 1 a 3, en el que el polímero de la matriz polimérica es biocompatible.
5. Soporte según cualquiera de las reivindicaciones 1 a 4, en el que el polímero comprende grupos hidroxilo.
6. Soporte según cualquiera de las reivindicaciones 4 a 5, en el que el polímero se selecciona de entre policaprolactona, ácido poliláctico, copolímeros de ácido láctico y ácido glicólico, copolímeros de ácido láctico y etilenglicol, co-polímeros de lisina y ácido láctico, copolímeros de etilenglicol y ácido fumárico, polipropilenfumarato y sus mezclas.
7. Soporte según cualquiera de las reivindicaciones 4 a 6, en el que el polímero es policaprolactona.
8. Soporte según cualquiera de las reivindicaciones 1 a 7 en el que las partículas de tamaño nanométrico o micrométrico son de hidroxiapatita, fluorohidroxiapatita, disiliciuro de calcio, fosfato cálcico y sus mezclas.
9. Soporte según la reivindicación 8, en el que las partículas presentan un tamaño comprendido entre 50-300 nm.
10. Soporte según la reivindicación 9, en el que las partículas presentan un tamaño inferior a 100 nm.
11. Soporte según cualquiera de las reivindicaciones 1 a 10 que comprende además en las superficies de los microporos y macroporos núcleos inductores de la cristalización de hidroxiapatita.
12. Soporte según cualquiera de las reivindicaciones 1 a 10, que comprende además de la matriz polimérica un recubrimiento continuo y homogéneo de hidroxiapatita biomimética en la superficie de los macroporos y microporos.
13. Un procedimiento para obtener un soporte según cualquiera de las reivindicaciones anteriores que comprende las etapas de:
14. Procedimiento según la reivindicación 13, en el que la disolución de un polímero presenta una concentración comprendida entre 10% al 40% en peso de polímero con respecto al peso total de la disolución.
15. Procedimiento según la reivindicación 14, en el que el disolvente se selecciona de entre dimetilsulfóxido, cloruro de metileno, acetato de etilo, cloroformo, n-heptano, n-hexano, n-pentano, dioxano, benceno, xileno, acetona, naftaleno y sus mezclas.
16. Procedimiento según la reivindicación 15, en el que el disolvente es dioxano.
17. Procedimiento según cualquiera de las reivindicación 14 o 15, en el que la disolución de polímero se mezcla con las partículas de refuerzo y se homogeneiza con ultrasonidos.
18. Procedimiento según la reivindicación 13, en el que el material de las partículas de porógeno se selecciona de entre el grupo formado por monosacáridos, polisacáridos, sales orgánicas, sales inorgánicas, microesferas acrílicas, microfibras poliméricas y sus mezclas.
19. Procedimiento según la reivindicación 18, en la que las partículas de porógeno se añaden a la disolución de polímero con las partículas de refuerzo en una proporción comprendida entre 40/60 a 70/30 en peso de partículas de porógeno con respecto al peso de la disolución.
20. Procedimiento según la reivindicación 18 ó 19, en el que el tamaño del diámetro de las partículas de porógeno está comprendido entre 100 y 300 μm.
21. Procedimiento según la reivindicación 13, en el que la mezcla homogénea se congela hasta obtener una pieza solidificada.
22. Procedimiento según la reivindicación 13, en el que se extrae el primer disolvente de la pieza solidificada por difusión en frío sumergiéndola en un segundo disolvente que se encuentra a una temperatura de -20ºC y sin que la temperatura del primer disolvente exceda la de su punto de fusión.
23. Procedimiento según la reivindicación 22, en el que el segundo disolvente se encuentra a una temperatura de -20ºC.
24. Procedimiento según la reivindicación 23, en el que el segundo disolvente se selecciona de entre un disolvente orgánico, un inorgánico y sus mezclas.
25. Procedimiento según la reivindicación 24, en el que el segundo disolvente se selecciona de entre etanol y mezclas de etanol y agua.
26. Procedimiento según la reivindicación 13, en el que las partículas de porógeno se extraen a temperatura ambiente de la pieza solidificada sumergiendo la pieza en un tercer disolvente capaz de disolver las partículas de porógeno.
27. Procedimiento según la reivindicación 26, en el que el tercer disolvente se selecciona de entre etanol, agua, acetona y sus mezclas.
28. Procedimiento según cualquiera de las reivindicaciones 13 a 27, que comprende además una etapa de tratamiento superficial del soporte, que forma núcleos inductores de la cristalización de hidroxiapatita biomimética distribuidos por las superficies de los macroporos y de los microporos.
29. Procedimiento según la reivindicación 28, en el que la etapa de tratamiento comprende las siguientes etapas:
- 1) tratamiento del soporte por exposición a un plasma de un gas o por immersión en una disolución de hidróxido sódico.
- 2) inmersión el soporte obtenido en 1) alternativamente en soluciones que contienen cada una iones Ca2+ o PO43-.
- 3) inmersión del soporte obtenido en fluido corporal simulado, (SBF).
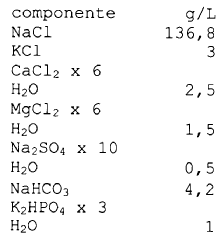
30. Procedimiento según la reivindicación 29, en el que el fluido corporal simulado presenta la siguiente composición taponada con acido clorhídrico y e hidrocloruro de tris (hidroximetil)aminometano (disolución de Kokubo modificada):
31. Procedimiento según cualquiera de las reivindicaciones 13 a 30, que comprende además una etapa de recubrimiento de las superficies internas de los macroporos y microporos, que comprende sumergir un soporte o un soporte bioactivo en un fluido corporal simulado para obtener un soporte híbrido.
32. Soporte obtenible según cualquiera de las reivindicaciones 13 a 31.
33. Soporte según cualquiera de las reivindicaciones 1 a 12 para su uso en la generación o regeneración de tejido.
34. Empleo del soporte según cualquiera de las reivindicaciones 1 a 12, para la generación o regeneración de tejido in vitro.
35. Empleo según la reivindicación 34, en la que el tejido es conectivo in vitro.
36. Empleo según las reivindicaciones 34 o 35 donde el soporte es bioactivo o híbrido in vitro.
37. Procedimiento para generar o regenerar tejido que comprende:
obtener un soporte bioactivo o un soporte híbrido, y
cultivar in vitro en dicho soporte células de un tejido,
y opcionalmente siembra con células del soporte previo a su cultivo.
Patentes similares o relacionadas:
Materiales compuestos biocompatibles anhidros, del 22 de Julio de 2020, de Kuros Biosciences B.V: Material compuesto biocompatible anhidro que comprende un material polimérico biodegradable y un material sintético granular, en donde el material polimérico […]
Matriz de soporte de injerto para reparación de cartílago y procedimiento de obtención de la misma, del 1 de Julio de 2020, de ETH ZURICH: Un procedimiento de proporción de una matriz de soporte de injerto para reparación de cartílagos, particularmente en un paciente humano, que comprende las etapas de: […]
Materiales cerámicos osteoinductivos moldeables e inyectables, del 24 de Junio de 2020, de NuVasive Netherlands B.V: Un material cerámico moldeable, maleable, amasable y/o inyectable que comprende fosfato de calcio poroso que tiene un tamaño de cristal de entre 0,1 y […]
Composiciones poliméricas reabsorbibles para su uso en medicina, odontología y cirugía, del 17 de Junio de 2020, de Syncera, Inc: Una composición polimérica fluida o maleable en forma esencialmente seca, que comprende: (a) un copolímero de bloques de poli(alquileno)-poli(etilen […]
Material plástico para dispositivos que se implantarán en el cuerpo humano o para espaciadores articulares, del 1 de Abril de 2020, de TECRES S.P.A.: Material cargado con antibiótico, biocompatible e implantable en el cuerpo humano, para la obtención de un dispositivo que pueda implantarse en el […]
Composición para la regeneración ósea, del 11 de Marzo de 2020, de ECOLE POLYTECHNIQUE FEDERALE DE LAUSANNE (EPFL): Composición para la regeneración ósea, la cual comprende a) una primera fase que comprende una pluralidad de fragmentos de hidrogel reticulados que tienen un diámetro […]
Composite auto-expandible de biopolímero-mineral, del 20 de Noviembre de 2019, de COLLAGEN MATRIX, INC: Un método para preparar un composite de implante óseo, comprendiendo el método: dispersar fibras biopoliméricas en una solución acuosa para formar una suspensión, […]
 Composiciones y métodos para mejorar la curación y la regeneración de huesos y tejidos blandos, del 25 de Septiembre de 2019, de The University of Memphis: Una composición que comprende:
a) 100 partes en peso de un polímero biodegradable;
b) una miel en una cantidad desde 1 a 300 partes en peso con respecto […]
Composiciones y métodos para mejorar la curación y la regeneración de huesos y tejidos blandos, del 25 de Septiembre de 2019, de The University of Memphis: Una composición que comprende:
a) 100 partes en peso de un polímero biodegradable;
b) una miel en una cantidad desde 1 a 300 partes en peso con respecto […]