SOPORTES BIOFUNCIONALIZADOS COVALENTEMENTE.
Soportes biofuncionalizados covalentemente.
La presente invención se refiere a un proceso para la funcionalización orientada y covalente de un soporte con una proteína (PROT) mediante enlaces de residuos de histidina con un grupo quelante de metales con grupos,
y a los soportes funcionalizados obtenidos por tal proceso.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200931092.
Solicitante: UNIVERSIDAD DE ZARAGOZA (Titular al 34%).
Nacionalidad solicitante: España.
Inventor/es: GRAZÚ BONAVIA,MARÍA VALERIA, MARTÍNEZ DE LA FUENTE,JESÚS, FERACCI,HELENE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/543 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › con un soporte insoluble para la inmovilización de compuestos inmunoquímicos.
PDF original: ES-2378936_A1.pdf
Fragmento de la descripción:
Soportes biofuncionalizados covalentemente.
La presente invención se refiere a un proceso para la funcionalización orientada y covalente de un soporte con una proteína (PROT), y a los soportes funcionalizados obtenidos. Por lo tanto pertenece al campo de la biomedicina.
Estado de la técnica anterior
Las superficies biofuncionales son ampliamente empleadas en terapia y diagnóstico mediante ensayos celulares (Geiger et al, 2009), ingeniería tisular (Curtis & Riehle, 2001), desarrollo de biosensores (Wong et al, 2009), bioelectrónica y de manera más general para el desarrollo de dispositivos médicos (Bettinger et al., 2009; Jonkheijm et al 2008). La superficie biofuncional ideal debe de ser fácil de preparar, caracterizar, sencilla de diseñar, biocompatible y eficaz. En este sentido, la incorporación de biomoléculas relevantes se ha publicado con anterioridad tanto para proteínas (Thery et al, 2005), péptidos (Perret et al, 2002a), carbohidratos (Fuss et al, 2008; Schatz et al, 2009), oligonucleótidos (Weisbrod & Marx, 2008) y otros (de la Fuente et al 2006; Song et al, 2009). Varias estrategias se han seguido para la modificación química de estos biomateriales. Estas aproximaciones a la hora de funcionalizar biomateriales pueden implicar uniones covalentes o no-covalentes. Ambas aproximaciones tienen aspectos positivos y negativos. La unión covalente asegura una unión fuerte y estable entre la biomolécula y la superficie, sin embargo requiere la modificación superficial y no garantiza generalmente una correcta orientación de la biomolécula, sobre todo cuando se trata de moléculas complejas tales como las proteínas. Cuando se inmovilizan proteínas no modificadas por esta estrategia suelen quedar unidas a la superficie de forma aleatoria. Por otro lado, las uniones inespecíficas constituyen una estrategia sencilla para la biofuncionalización de superficies, pero son uniones reversibles cuya estabilidad es muy dependiente de las condiciones del medio (pH, fuerza iónica, temperatura, etc.). Además, estas interacciones no controladas conducen con frecuencia a una pérdida de actividad de la proteína.
El estudio de los fenómenos de adhesión celular a biomateriales es un tema de gran interés desde un punto de vista de ingeniería tisular. Las interacciones de estas células con los materiales son capaces de modular la respuesta celular a los implantes artificiales o a soportes de cultivo celular (Chen et al, 1998; Stevens & George, 2005). Es por ello que el control de la adhesión celular sobre un material polimérico es clave para el desarrollo de nuevos biomateriales con estos fines. Datos bioquímicos resaltan la necesidad de funcionalizar estos materiales con proteínas de la matriz extracelular (ECM) para promocionar la adhesión celular a través de interacciones específicas. Las células, vía integrinas, son capaces de unirse a la secuencia específica RGD presente en proteínas del ECM tales como la fibronectina, vitronectina, y tromboespondina. Estas proteínas generan una red de uniones que controlan la adhesión y el crecimiento celular in vivo. Además de estas proteínas, otra familia de proteínas, las caderinas, están implicadas en estos eventos de adhesión célula-célula. Las caderinas clásicas son unas glicoproteínas transmembrana implicadas en el control de la especificidad, organización y dinámica de la adhesión celular, la cual es crucial para el desarrollo y mantenimiento de la arquitectura y función de los tejidos (Hartsock & Nelson, 2008; Larue et al, 1996; Nishimura & Takeichi, 2009). Las caderinas interaccionan con otras caderinas presentes en la superficie de células vecinas a través de subdominios extracelulares repetitivos (EC1-EC5) (Patel et al, 2003; Perret et al, 2002b; Perret et al, 2004). Estas uniones adhesivas inician las señales intracelulares que controlan la organización del citoesqueleto, la polaridad celular, proliferación y apoptosis, siempre a través de mecanismos de comunicación vía caderinas-citoesqueleto (Charrase et al, 2002; van Roy & Berx, 2008). Aun no se conoce bien el papel que estas fuerzas de adhesión tienen en los procesos de señalización celular, debido sobre todo a la dificultad existente en la interpretación de respuestas biológicas que implican organizaciones multimoleculares complejas y dinámicas (Thiery et al., 2003).
En las superficies de los biomateriales in vitro, se puede aplicar el mismo mecanismo. Cuando materiales extraños entran en contacto con un fluido biológico o con medio de cultivo celular, la respuesta inicial, es la adsorción de proteínas a la superficie del material. Una vez esto ocurre, el material interacciona con las células a través de la capa de proteínas previamente adsorbida. Además la composición y estructura de esta capa de proteínas juega un papel crítico en los subsiguientes desarrollos celulares (Arulanandam et al, 2009; Dupin et al, 2009; Ganz et al, 2006; Ostuni et al, 2009).
Descripción de la invención
La presente invención se refiere a un proceso para la biofuncionalización de la superficie de soportes que es fácil de llevar a cabo, eficientemente y produciendo materiales biocompatibles. Además también se refiere a los soportes biofuncionalizados. En la presente invención se presenta una estrategia sencilla para la modificación de superficies, por ejemplo de vidrio, usando una tecnología ya establecidas, pero cumpliendo con importantes requisitos, una correcta orientación de la biomolécula y una unión estable covalente con la superficie a funcionalizar. Además esta metodología se puede extender a un amplio abanico de materiales distintos. El procedimiento de la presente invención es eficaz, sencillo y directo para la preparación de superficies, nanopartículas o soportes funcionalizados con proteínas unidas covalentemente a la superficie y además garantizando la correcta orientación de estas proteínas sobre estos materiales. El proceso de la presente invención se podría emplear con cualquier proteína (enzimas, anticuerpos, lectinas, abzimas) o péptidos siempre que estén modificados con una cola de polihistidinas, o que presenten una zona de su superficie rica en residuo de histidinas muy expuesta al medio (en su secuencia peptídica nativa o generada por técnicas de biología molecular).
El proceso de la presente invención permite la obtención de soportes funcionalizados donde la proteína se une de forma orientada y covalente. Este proceso consiste en una unión en dos etapas: i) unión reversible y selectiva por afinidad a través de la cola de polihistidinas o zona rica en residuos de histidinas por los quelatos metálicos anclados al soporte, ii) posterior reacción covalente entre grupos nucleófilos (aminos, tioles, etc.), sólo de la zona de la superficie proteica por donde ha ocurrido la adsorción, y grupos carboxilos del agente quelante (anclados al soporte) activados previamente por el agente activante.
Al ser el mismo grupo quelante el que luego establece la unión covalente, esta estrategia presenta ventajas sobre las que utilizan dos grupos funcionales: i) grupos quelantes para unir por afinidad y ii) grupos reactivos (epóxido, aldehído, etc.) capaces de establecer una unión covalente con la proteína adsorbida (Mateo et al, 2007). La principal ventaja de esta nueva estrategia es que no se pierde capacidad de carga de la proteína a inmovilizar. Sin embargo, en el caso de soportes bifuncionales es necesario sacrificar la cantidad de grupos quelantes para introducir grupos capaces de unir covalentemente a la proteína.
Si bien la unión de la proteína se establece en dos etapas, al ser el grupo capaz de establecer uniones covalentes (grupo carboxilo del quelante activado con EDC y NHS) muy reactivo, la unión covalente es muy rápida después de la adsorción de la proteína por afinidad. Esto es una ventaja frente a soportes bifuncionales que contienen epóxido como grupos reactivos, dado que necesitan largas incubaciones a pH alcalinos, después de la unión de la proteína por afinidad, para que se establezca la unión covalente.
Por lo tanto un primer objeto de la presente invención es un proceso para la funcionalización orientada de un soporte con una proteína (PROT), que comprende acoplar covalentemente:
a) una proteína (PROT) la cual tiene una zona rica en residuos de histidina (Hp);
b) con un soporte biofuncionalizable cuya superficie se le ha unido de forma covalente... [Seguir leyendo]
Reivindicaciones:
1. Un proceso para la funcionalización orientada de un soporte con una proteína (PROT), que comprende acoplar covalentemente:
a) una proteína (PROT) la cual tiene una zona rica en residuos de histidina (Hp);
b) con un soporte biofuncionalizable cuya superficie se le ha unido de forma covalente un complejo quelante y este se ha cargado con un catión metálico, siendo la fórmula general:
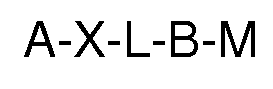
Siendo:
A el soporte;
X es un átomo de oxígeno, nitrógeno o azufre;
L es un grupo puente opcional entre el átomo X y el grupo B;
B un grupo quelante de metales con grupos carboxílicos;
M es un catión metálico, preferiblemente con valencia 2 ó superior;
c) en presencia de al menos un agente activante a un pH entre 4 y 10;
para la obtención de un soporte funcionalizado de fórmula:
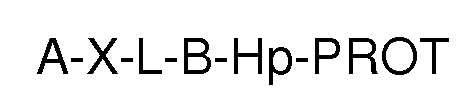
2. El proceso según la reivindicación 1, caracterizado porque después del acoplamiento con el agente activante el soporte funcionalizado se lava con un agente acoplante de metales, preferiblemente EDTA y/o imidazol.
3. El proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque la etapa de acoplamiento se hace en presencia de un disolvente.
4. El proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque la etapa de acoplamiento se lleva a cabo a una temperatura entre 5 y 70ºC.
5. El proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque se hace reaccionar entre 0,001 y 50 mg de proteína por cm2 de soporte biofuncionalizable, preferiblemente entre 0,1 y 2 mg de proteína por cm2.
6. El proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque comprende entre 0,1 y 10000 equivalentes de agente activante por mol de proteína, preferiblemente entre 1 y 100 equivalentes de agente activante por mol de proteína.
7. El proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque la etapa de acoplamiento se lleva a cabo a un pH entre 6 y 9, preferiblemente entre 6,5 y 8, más preferiblemente de un tampón acuoso principalmente Hepes (pH 7).
8. El proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque el soporte biofuncionalizable comprende grupos en la superficie tales como -OH, CHO, epóxidos, -NH2, -SH y -N3, preferentemente -OH.
9. El proceso según la reivindicación anterior, caracterizado porque el soporte biofuncionalizable es vidrio, silicio, sílica, oro, plata, carbono, soportes orgánicos, micropartículas, nanopartículas magnéticas, nanopartículas de oro, nanopartículas de sílica, nanopartículas poliméricas, dendrímeros, quantum dots, nanotubos de carbono, polisacáridos, nanopartículas de paladio, nanopartículas de platino, poliestireno, poliláctico, poliacrilamida, polimetacrilato, poliuretano, polivinilalcohol, resinas epoxiacrílicas o cualquiera de sus combinaciones.
10. El proceso según cualquiera de las dos reivindicaciones anteriores, caracterizado porque el soporte biofuncionalizable es vidrio, sílica, oro, plata, carbono, soportes orgánicos, micropartículas, nanopartículas magnéticas, nanopartículas de oro, nanopartículas de sílica, nanopartículas poliméricas, polisacáridos, dendrímeros, quantum dots, nanotubos de carbono o cualquiera de sus combinaciones.
11. El proceso según cualquiera de las reivindicaciones 8 a 10, caracterizado porque el soporte biofuncionalizable es vidrio, silicio o sílica.
12. El proceso según cualquiera de las reivindicaciones 8 a 10, caracterizado porque el soporte biofuncionalizable es oro.
13. El proceso según cualquiera de las reivindicaciones 8 a 10, caracterizado porque el soporte biofuncionalizable es nanopartículas de oro.
14. El proceso según cualquiera de las reivindicaciones 8 a 10, caracterizado porque el soporte biofuncionalizable es nanopartículas magnéticas.
15. El proceso según cualquiera de las reivindicaciones 8 a 10, caracterizado porque el soporte biofuncionalizable es quantum dots.
16. El proceso según cualquiera de las reivindicaciones 8 a 10, caracterizado porque el soporte biofuncionalizable es agarosa.
17. El proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque la zona rica en residuos de histidina de la proteína (PROT) ha sido introducida en forma de una cola de entre 4 y 10 histidinas (Hp) por su extremo carboxilo terminal o en su región oligosacarídica.
18. El proceso según cualquiera de las reivindicaciones anteriores caracterizado porque la zona rica en residuos de histidina de la proteína (PROT) ha sido introducida por modificación de varios residuos aminoacídicos de su superficie por técnicas de biología molecular, por ejemplo mutagénesis dirigida.
19. El proceso según cualquiera de las reivindicaciones 1 a 18, caracterizado porque la proteína es una caderina, un péptido, una lectina, una enzima, un anticuerpo, un minianticuerpo, una abzima, un receptor proteico o cualquiera de sus combinaciones.
20. El proceso según cualquiera de las reivindicaciones 1 a 19, caracterizado porque el anticuerpo es antiperoxidasa.
21. El proceso según cualquiera de las reivindicaciones 1 a 19, caracterizado porque la enzima es glucosidasa, peroxidada, lacasa, amilasa, lipasa o cualquiera de sus combinaciones.
22. El proceso según cualquiera de las reivindicaciones 1 a 19, caracterizado porque la lectina es concanavalina A.
23. El proceso según cualquiera de las reivindicaciones 1 a 19, caracterizado porque la proteína es una caderina, preferiblemente caderina E.
24. El proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque el complejo quelante es ácido nitriloacético (NTA), ácido iminodiacético (IDA), ácido aspártico carboximetilado (CM-Asp), tris(carboximetil)etilenodiamina (TED) o cualquiera de sus combinaciones.
25. El proceso según la reivindicación anterior, caracterizado porque el complejo quelante es ácido nitriloacético (NTA).
26. El proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque el agente quelatante está directamente unido a la superficie de soporte.
27. El proceso según cualquiera de las reivindicaciones 1 a 25, caracterizado porque hay un grupo puente L.
28. El proceso según la reivindicación anterior, caracterizado porque L es un grupo de fórmula:
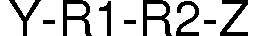
donde:
Y es seleccionada entre Si, C(=O), -C(OH)H- y -CH2-;
Z es seleccionada entre S, O, C(=O), -C(OH)H-, -C(OH)CH2- y -CH2-;
R1 y R2 pueden ser independientemente seleccionados entre: (CH2)a siendo "a" un numero entero entre 0 y 30, preferentemente entre 1 y 16; y (OCH2CH2)b siendo "b" un número entero entro a 0 y 100, preferentemente entre 1 y 40.
29. El proceso según la reivindicación 28, caracterizado porque Y es -C(OH)H-,
30. El proceso según la reivindicación 28, caracterizado porque Z es -C(OH)CH2-.
31. El proceso según la reivindicación 28, caracterizado porque L comprende un silano y el átomo de Si está directamente unido a la superficie del soporte.
32. El proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque el catión metálico es Ni2+, Cu2+, Zn2+, Co2+, Mn2+, Mg2+, Ag+, Ga3+, Fe3+, Al3+, Zr4+, Ca2+, Be2+, Mg2+, Ba2+, Ti4+, V3+, Cr2+, Cr3+ o cualquiera de sus combinaciones.
33. El proceso según la reivindicación anterior, caracterizado porque el catión metálico es Ni2+, Cu2+, Zn2+, Co2+, Mn2+, Mg2+, Ag+, Ga3+, Fe3+, Al3+, Zr4+ o cualquiera de sus combinaciones.
34. El proceso según la reivindicación anterior, caracterizado porque el catión metálico es Ni2+, Cu2+, Co2+ o cualquiera de sus combinaciones.
35. El proceso según cualquiera de las reivindicaciones anteriores, caracterizado porque el agente activante es Sulpho-NHS, NHS, EDC, HATU, CDI, DCC o cualquiera de sus combinaciones, preferiblemente NHS y EDC.
36. Un soporte funcionalizado de fórmula A-X-L-B-Hp-PROT, siendo A, X, L, B, Hp y PROT como se definen en las reivindicaciones precedentes, caracterizado porque todos los grupos están unidos por enlaces covalentes.
37. El soporte funcionalizado según la reivindicación anterior, obtenible por cualquiera de los procesos como se definen en las reivindicaciones 1 a 35.
38. El soporte según cualquiera de las dos reivindicaciones anteriores, caracterizado porque el soporte es un biochip, un implante, un scaffold 3D, un biosensor basados en superficies, nanopartículas o nanotubos de carbono biofuncionalizados, sistemas de separación basados en partículas magnéticas, sistemas de separación basados en partículas de metales nobles, columnas de purificación, biorreactor, microarrays, sistemas de liberación de fármacos (basados en partículas y dendrímeros) y agentes de contraste basados en nanopartículas magnéticas.
39. El soporte según cualquiera de la reivindicación anterior, caracterizado por que el soporte es un biochip, un implante, un biosensores basados en superficies, nanopartículas o nanotubos de carbono biofuncionalizados, sistemas de separación basados en partículas magnéticas, microarrays y sistemas de liberación de fármacos (basados en partículas y dendrímeros)
40. Un conjunto que comprende al menos:
a) una proteína (PROT) la cual tiene una zona rica en residuos de histidina (Hp);
b) un soporte biofuncionalizable cuya superficie se le ha unido de forma covalente un complejo quelante y este se ha cargado con un catión metálico, siendo la fórmula general;
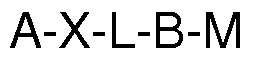
Siendo:
A el soporte;
X es un átomo de oxígeno, nitrógeno o azufre;
L es un grupo puente opcional entre el átomo de oxígeno del soporte y el grupo B;
B un grupo quelante de metales con grupos carboxílicos;
M es un catión metálico, preferiblemente con valencia 2 ó superior;
c) agente activante;
siendo la definición de los grupos la misma que para las reivindicaciones anteriores.
41. Uso del conjunto definido en la reivindicación anterior para la inmovilización de proteínas in situ.
Patentes similares o relacionadas:
Método de determinación de la presencia y/o cantidad de moléculas diana, del 22 de Julio de 2020, de Canopy Biosciences, LLC: Método para el análisis de células individuales en una muestra de sangre mediante la determinación de la presencia y/o cantidad de una o más moléculas […]
Un sustrato para inmovilizar sustancias funcionales y un método para preparar las mismas, del 15 de Julio de 2020, de Temasek Polytechnic: Un sustrato sólido que tiene compuestos dispuestos sobre el mismo, en donde se inmoviliza una molécula funcional sobre los compuestos, teniendo cada compuesto una cadena que […]
Kit de reactivos utilizado para detectar gastrina-17 y método de preparación y aplicación para el kit de reactivos, del 15 de Julio de 2020, de Shenzhen New Industries Biomedical Engineering Co., Ltd: Un kit para detectar gastrina-17, caracterizado porque comprende un componente A y un componente B, en donde el componente A es un primer […]
Análisis biológico autónomo de alta densidad, del 1 de Julio de 2020, de BioFire Diagnostics, LLC: Recipiente para realizar reacciones de amplificación en un sistema cerrado que comprende una porción flexible que tiene una serie de blísteres […]
Chip de análisis y aparato de análisis de muestras, del 1 de Julio de 2020, de Takano Co., Ltd: Un chip de análisis que comprende: un sustrato conformado sustancialmente en forma de disco; un puerto de inyección formado […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Estructuras para controlar la interacción de luz con dispositivos microfluídicos, del 3 de Junio de 2020, de Opko Diagnostics, LLC: Un sistema de ensayo múltiplex que comprende: un artículo que soporta ensayos en fase sólida, comprendiendo dicho artículo un sustrato plano rígido y comprendiendo […]
Uso de un estándar para la detección de agregados de proteínas de una enfermedad por plegamiento incorrecto de proteínas, del 27 de Mayo de 2020, de FORSCHUNGSZENTRUM JULICH GMBH: Uso de un estándar, que comprende una nanopartícula inorgánica con un tamaño de 2 a 200 nm, en cuya superficie ya sea mediante i) ácido carboxílico-espaciador-maleimida […]