SISTEMA PARA LA OBTENCION DE HIDROXIDO CALCICO A PARTIR DE SULFATO CALCICO.
Obtención de oxido e hidróxido cálcico a partir del sulfato cálcico.
Que consisten en la introducción de sulfato cálcico (2) y disolución de amoniaco en agua (4), en un depósito de reacción (1).Mediante un agitador mecánico y a tres mil revoluciones por minuto creamos una emulsión, para que reaccione el sulfato cálcico con el amoniaco en disolución. Se produce sulfato de amonio (6), quedando en disolución hidróxido cálcico que decanta (5) y es recuperado.Así mismo del sulfato amínico obtendremos por tratamiento de cristalización (7) por nebulización, ácido sulfúrico (8) y amoniaco en gas que se recupera para su reutilización (4)
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P200900317.
Solicitante: FUNDACIÓN INVESTIGACIÓN E INNOVACIÓN PARA EL DESARROLLO SOCIAL.
Nacionalidad solicitante: España.
Provincia: MADRID.
Inventor/es: PORCAR ORTI,JAVIER.
Fecha de Solicitud: 30 de Enero de 2009.
Fecha de Publicación: .
Fecha de Concesión: 13 de Octubre de 2011.
Clasificación PCT:
- C01F11/02 QUIMICA; METALURGIA. › C01 QUIMICA INORGANICA. › C01F COMPUESTOS DE BERILIO, MAGNESIO, ALUMINIO, CALCIO, ESTRONCIO, BARIO, RADIO, TORIO O COMPUESTOS DE LOS METALES DE LAS TIERRAS RARAS (hidruros metálicos C01B 6/00; sales de oxácidos de halógenos C01B 11/00; peróxidos, sales de los perácidos C01B 15/00; sulfuros o polisulfuros de magnesio, calcio, estroncio o bario C01B 17/42; tiosulfatos, ditionitos, politionatos C01B 17/64; compuestos que contienen selenio o teluro C01B 19/00; compuestos binarios del nitrógeno con metales C01B 21/06; azidas C01B 21/08; amidas metálicas C01B 21/092; nitritos C01B 21/50; fosfuros C01B 25/08; sales de los oxácidos del fósforo C01B 25/16; carburos C01B 32/90; compuestos que contienen silicio C01B 33/00; compuestos que contienen boro C01B 35/00; compuestos que tienen propiedades de tamices moleculares pero que no tienen propiedades de cambiadores de base C01B 37/00; compuestos que tienen propiedades de tamices moleculares y de cambiadores de base, p. ej. zeolitas cristalinas, C01B 39/00; cianuros C01C 3/08; sales del ácido ciánico C01C 3/14; sales de cianamida C01C 3/16; tiocianatos C01C 3/20; procesos de fermentación o procesos que utilizan enzimas para la preparación de elementos o de compuestos inorgánicos excepto anhídrido carbónico C12P 3/00; obtención a partir de mezclas, p. ej. a partir de minerales, de compuestos metálicos que son los compuestos intermedios de un proceso metalúrgico para la obtención de un metal libre C22B; producción de elementos no metálicos o de compuestos inorgánicos por electrólisis o electroforesis C25B). › C01F 11/00 Compuestos de calcio, estroncio o bario (C01F 7/00 tiene prioridad). › Oxidos o hidróxidos (producción de cal C04B 2/00).
- C04B2/00 C […] › C04 CEMENTOS; HORMIGON; PIEDRA ARTIFICIAL; CERAMICAS; REFRACTARIOS. › C04B LIMA; MAGNESIA; ESCORIAS; CEMENTOS; SUS COMPOSICIONES, p. ej. MORTEROS, HORMIGON O MATERIALES DE CONSTRUCCION SIMILARES; PIEDRA ARTIFICIAL; CERAMICAS (vitrocerámicas desvitrificadas C03C 10/00 ); REFRACTARIOS (aleaciones basadas en metales refractarios C22C ); TRATAMIENTO DE LA PIEDRA NATURAL. › Cal, magnesia o dolomita.
Fragmento de la descripción:
Sistema para la obtención de hidróxido cálcico a partir de sulfato cálcico.
La gran preocupación que implican las emisiones de CO2 a la atmósfera y la entrada en vigor de protocolos, como el de Kyoto, así como medidas gubernamentales en la materia encaminadas a penalizar a aquellas empresas que más CO2 emitan a la atmósfera, justifica de por sí la iniciativa de cualquier invención que sea capaz de reducir ó mitigar las emisiones de CO2 en los procesos industriales.
En el estado actual, la obtención del óxido cálcico -CaO- hidróxido cálcico -Ca(OH2)-, se realiza mediante la calcinación de la piedra caliza, compuesta mayoritariamente por carbonato cálcico -CaCO3-, de forma que se desprende CO2 que es emitido a la atmósfera y queda el óxido cálcico -CaO-, que previa su hidratación se convierte en hidróxido cálcico -Ca(OH)2-. El óxido e hidróxido cálcico -CaO y Ca(OH)2-, tienen multitud de aplicaciones especialmente en las cementeras para producir el cemento porlant, por lo que las emisiones de CO2 a la atmósfera para la obtención de óxido e hidróxido cálcico -CaO y Ca(OH)2- son de mucha importancia.
Es dentro de esta realidad, donde se encuadra la presente invención, que desarrolla un sistema para evitar las emisiones de CO2 en la producción del óxido e hidróxido cálcico -CaO y Ca(OH)2- y que se consigue mediante un proceso de reacciones químicas. La invención consiste en obtener el hidróxido cálcico -Ca(OH)2- tomando como materia prima el sulfato cálcico -CaSO4-, en lugar del carbonato cálcico -CaCO3-, evitando así la emisión de CO2 a la atmósfera, como ocurre en la actualidad.
Objeto de la invención
Por todo ello el motivo de la presente invención trata de reducir las emisiones de CO2 producido por calcinación del carbonato cálcico -CaCO3-, para obtener el hidróxido cálcico -Ca(OH)2- partiendo del sulfato cálcico -CaCO4- como materia prima, para la obtención de dicho producto.
La presente invención, tal y como expresa el enunciado de esta memoria descriptiva, consiste en un nuevo "Sistema para la obtención de hidróxido cálcico -Ca(OH)2- a partir del sulfato cálcico -CaCO4-", reduciendo las emisiones de CO2 que actualmente se emiten a la atmósfera cuando se obtiene el óxido cálcico -CaO- y por hidratación, el hidróxido cálcico -Ca(OH)2-, a cuando la materia prima de la que se parte es el carbonato cálcico -CaCO3-.
"El sistema para la obtención de hidróxido cálcico -Ca(OH)2- a partir del sulfato cálcico -CaCO4-", viene determinado por la trituración del mineral de sulfato cálcico -CaCO4-, con una granulometría inferior a cincuenta mieras. El sulfato cálcico -CaCO4- micronizado, lo introduciremos en un "depósito de reacción", a temperatura y presión ambiente.
En una torre de platos, disolveremos amoniaco -NH3- en agua, hasta su saturación, para formar el ion -NH4+- en la disolución.
Dicha agua saturada de amoniaco -NH3- la introduciremos en el deposito de reacción, con la finalidad de crear una emulsión dentro del mismo. La emulsión la realizamos mediante una agitación continua a tres mil vueltas por minuto, para favorecer la reacción química principal. El sulfato cálcico -CaCO4- micronizado, en combinación con el agua con el amoniaco -NH3- disuelto, producirá la siguiente reacción química:
De manera que el sulfato cálcico -CaCO4- se trasforma en sulfato amónico e hidróxido cálcico -Ca(OH)2-.
El hidróxido cálcico -Ca(OH)2-, que es insoluble, se recupera por decantación, del depósito de reacción. El sulfato de amonio -(NH4)2SO4-, que es soluble, queda en la disolución. La disolución del sulfato amónico -(NH4)SO4- se extrae del depósito y se somete a un tratamiento de cristalización por nebulización para conseguir la cristalización del sulfato amónico -(NH4)2SO4-. Una vez cristalizado el sulfato amónico, a una temperatura de 338 grados centígrados, se descompone térmicamente, en ácido sulfúrico concentrado -H2SO4- y amoniaco -NH3- en forma de gas. El amoniaco -NH3-, que se recupera, se reutiliza de nuevo en la reacción principal.
Descripción de la invención
"Sistema para la obtención de hidróxido cálcico Ca(OH)2 a partir del sulfato cálcico -CaCO4-", que consiste, tal como hemos indicado anteriormente, en la introducción de sulfato cálcico micronizado -CaCO4- en un depósito de reacción.
Con independencia de lo anterior, introducimos en una torre de platos agua y amoniaco -NH3- hasta su saturación, para que los iones resultantes en disolución sean iones amonio -NH4+-. Una vez disuelto el agua y el amoniaco -NH3-, lo introduciremos en el depósito de reacción, donde ya habíamos introducido el sulfato cálcico -CaCO4- micronizado.
Mediante un agitador mecánico y a tres mil revoluciones por minuto crearemos una emulsión dentro del depósito, para que reaccionen el sulfato cálcico -CaCO4- con el amoniaco -NH3- en disolución. La reacción produce -(NH4)2SO4- sulfato de amonio, que se queda en la disolución e hidróxido cálcico -Ca(OH)2- que decanta.
Finalizada esta fase del proceso en el depósito de reacción, el hidróxido cálcico -Ca(OH)2-, es recuperado por decantación y el sulfato de amonio -(NH4)2SO4- lo someteremos a un tratamiento de cristalización por nebulización para alcanzar su estado sólido.
Posteriormente y a una temperatura de 338 grados centígrados, por descomposición térmica, obtendremos el ácido sulfúrico concentrado -H2SO4- y amoniaco en gas -NH3-. El amoniaco -NH3-, que se recupera, vuelve a ser introducida dentro de la torre de platos para su reutilización de una forma continuada.
Breve enunciado de la figura
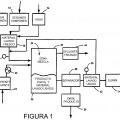
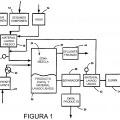
En la Figura número 1, se representa de forma gráfica, el conjunto de elementos que conforman el "Sistema para la obtención de hidróxido cálcico a partir del sulfato cálcico -CaCO4-" y donde (1) representa el deposito de reacción, donde se introduce el sulfato cálcico -CaCO4- micronizado (2).
El (3) y como proceso independiente representa una torre de platos, donde introducimos agua y amoniaco -NH3- (4) hasta su saturación, para que los iones resultantes en disolución sean NH4-.
El resultado se introduce en el depósito de reacción (1), donde ya habíamos introducido el sulfato cálcico -CaCO4- micronizado (2). Mediante un agitador mecánico y a tres mil revoluciones por minuto crearemos una emulsión dentro del deposito, para que reaccionen el sulfato cálcico -CaCO4- con el ion amonio -NH4+- en disolución.
La reacción que tiene lugar en el depósito de reacción, produce -(NH4)2SO4 - sulfato de amonio (6), que se queda en la disolución e hidróxido cálcico Ca(OH)2 que decanta y recupera (5).
El sulfato de amonio -(NH4)2SO4- (6), que como hemos comentado teníamos en disolución, lo someteremos a un tratamiento de cristalización por nebulización (7) para alcanzar su estado sólido, donde posteriormente y por descomposición térmica, obtendremos el ácido sulfúrico -H2SO4- (8) y amoniaco -NH3- en gas (4) que se recupera y vuelve a ser introducida dentro de la torre de platos para su reutilización de una forma continuada, concluyendo de esta forma el proceso de "Obtención de hidróxido cálcico a partir del sulfato cálcico".
Descripción de la forma de realización de la invención
A continuación se realiza una breve descripción de la...
Reivindicaciones:
1. Obtención de hidróxido cálcico a partir del sulfato cálcico -CaCO4-, que se caracteriza por la obtención de hidróxido cálcico -Ca(OH)2- utilizando como materia prima el sulfato cálcico -CaCO4-, mediante la disolución en agua de amoniaco -NH3- y sulfato cálcico -CaCO4-.
Se crea una emulsión mediante agitación a 3.000 rpm, que en la reacción química subsiguiente, produce sulfato amónico (NH4)2SO4 y hidróxido cálcico -Ca(OH)2-.
El hidróxido cálcico Ca(OH)2- precipita y por decantación es recogido del depósito de reacción.
2. Obtención del hidróxido cálcico a partir del sulfato cálcico -CaCO4, de acuerdo con la reivindicación primera, el sulfato amónico que se ha quedado en la disolución, se cristaliza por nebulización. Posteriormente y por descomposición térmica, obtendremos el ácido sulfúrico (H2SO4) (8) y amoniaco en gas -NH3- (4) que se recupera.
Patentes similares o relacionadas:
HORNO PRESURIZADO PARA LA CALCINACIÓN DE ARENAS CALIZAS MEDIANTE UNA CÁMARA SUBTERRÁNEA DE COMBUSTIÓN INTERNA, del 20 de Diciembre de 2018, de BRICIO OCHOA, Francisco Javier: La presente invención es un Horno para calcinar arenas calizas y dolomíticas y obtener cal viva (CaO), Además cuenta con un sistema para hidratar la cal viva […]
Dispersiones acuosas de polímero, del 26 de Julio de 2017, de SIKA TECHNOLOGY AG: Dispersión acuosa de polímero que contiene a) al menos un copolímero dispersado CP, que está constituido por al menos dos monomeros, que se seleccionan […]
 Sistema de secuestro de dióxido de carbono, del 20 de Agosto de 2014, de C-Quest Technologies International LLC: Un sistema para reducir las emisiones de dióxido de carbono que comprende:
una cámara de reacción seleccionada del grupo que consiste […]
Sistema de secuestro de dióxido de carbono, del 20 de Agosto de 2014, de C-Quest Technologies International LLC: Un sistema para reducir las emisiones de dióxido de carbono que comprende:
una cámara de reacción seleccionada del grupo que consiste […]
 Procedimiento de secuestro de dióxido de carbono para instalaciones de producción de cemento, del 20 de Agosto de 2014, de C-Quest Technologies International LLC: Un método para reducir las emisiones de dióxido de carbono de una instalación de producción de cemento, comprendiendo el método:
hacer reaccionar […]
Procedimiento de secuestro de dióxido de carbono para instalaciones de producción de cemento, del 20 de Agosto de 2014, de C-Quest Technologies International LLC: Un método para reducir las emisiones de dióxido de carbono de una instalación de producción de cemento, comprendiendo el método:
hacer reaccionar […]
Método para reciclar subproductos industriales, del 13 de Noviembre de 2013, de C-Quest Technologies International LLC: Un método para reciclar subproductos industriales que comprende: mezclar un primer componente producido que comprende una fuente de óxido […]
Procedimiento de secuestro de dióxido de carbono, del 25 de Septiembre de 2013, de C-Quest Technologies International LLC: Un método para eliminar dióxido de carbono de una corriente de fluido que comprende dióxido de carbono,comprendiendo el método: reducir una cantidad de dióxido […]
CUERPO MOLDEADO DE POROS ABIERTOS, METODO PARA SU PRODUCCION Y SU USO., del 1 de Noviembre de 2006, de INCO LIMITED FRAUNHOFER-GESELLSCHAFT ZUR FORDERUNG DER ANGEWANDTEN FORSCHUNG E.V.: Un método para fabricar un cuerpo moldeado, de poros abiertos, que se forma a partir de una solución sólida o de una fase intermetálica de níquel o de hierro, y al menos otro […]
CERAMICA CONDUCTORA PRETRATADA POR OXIDACION PARA UN ANODO DE ZINC, del 16 de Septiembre de 2007, de S.C.P.S. SOCIETE DE CONSEIL ET DE PROSPECTIVE SCIENTIFIQUE S.A.: Ánodo de zinc para generador electroquímico secundario alcalino que contiene en su masa activa un aditivo constituido por un polvo de cerámica conductora de partículas […]