SINTESIS DE PEPTIDOS INSULINOTROPICOS.
Un método para obtener un péptido insulinotrópico,
que comprende los siguientes pasos de a) a f):
a) proporcionar un primer fragmento peptídico que incluye la secuencia de aminoácidos HX8EX10 (Id. de Sec. Nº 6), en la que X8 y X10 son cada uno residuos de un aminoácido aquiral, incluyendo opcionalmente cada uno de H y E la protección de la cadena lateral;
b) proporcionar un segundo fragmento peptídico que incluye la secuencia de aminoácidos TFTSDVX17-18YLEG (Id. de Sec. Nº 8) en la que el residuo denotado mediante el símbolo X17-18 es un residuo dipeptídico de pseudoprolina, incluyendo opcionalmente dichos residuos de aminoácidos de la secuencia la protección de la cadena lateral;
c) acoplar el primer fragmento al segundo fragmento para proporcionar un tercer fragmento peptídico que incluye la secuencia de aminoácidos HX8EX10TFTSDVX17-18YLEG (Id. de Sec. Nº 11), incluyendo opcionalmente dichos residuos de aminoácidos de la secuencia la protección de la cadena lateral;
d) proporcionar un cuarto fragmento peptídico que incluye la secuencia de aminoácidos QAAKEFIAWLVKX35 (Id. de Sec. Nº 9), en el que X35 es un residuo de un aminoácido aquiral, incluyendo opcionalmente dichos residuos de aminoácidos de la secuencia la protección de la cadena lateral;
e) acoplar el cuarto fragmento peptídico a arginina para proporcionar un quinto fragmento peptídico que incluye la secuencia de aminoácidos QAAKEFIAWLVKX35R (Id. de Sec. Nº 12), incluyendo opcionalmente dichos residuos de la secuencia la protección de la cadena lateral; y
f) acoplar el quinto fragmento al tercer fragmento para proporcionar un péptido insulinotrópico que incluye la secuencia de aminoácidos HX8EX10TFTSDVX17-18YLEGQAAKEFIAWLVK X35R (Id. de Sec. Nº 13), incluyendo opcionalmente dichos residuos de la secuencia la protección de la cadena lateral
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/056052.
Solicitante: F. HOFFMANN-LA ROCHE AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 124,4070 BASEL.
Inventor/es: CHEN, LIN, HAN, YEUN-KWEI, ROBERTS, CHRISTOPHER, R.
Fecha de Publicación: .
Fecha Concesión Europea: 5 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C07K14/605 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Glucagones.
Clasificación PCT:
- A61K38/26 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Glucagón.
- C07K14/605 C07K 14/00 […] › Glucagones.
Fragmento de la descripción:
Síntesis de péptidos insulinotrópicos.
La invención se refiere a métodos para la preparación de péptidos insulinotrópicos, particularmente del péptido similar al glucagón 1 (GLP-1) y los homólogos del mismo, utilizando procesos en fase sólida y en solución. La presente invención además se refiere a los fragmentos de péptido intermedios que pueden utilizarse en estos métodos.
Se han descrito en la bibliografía muchos métodos para la síntesis de péptidos (por ejemplo, véase la Patente Estadounidense Nº 6.015.881; Mergler et al. (1988) Tetrahedron Letters 29:4005-4008; Mergler et al. (1988) Tetrahedron Letters 29:4009-4012; Kamber et al. (eds), Peptides, Chemistry and Biology, ESCOM, Leiden (1992) 525-526; Riniker et al. (1993) Tetrahedron Letters 49:9307-9320; Lloyd-Williams et al. (1993) Tetrahedron Letters 49:11065-11133; y Andersson et al. (2000) Biopolymers 55:227-250. Estos diferentes métodos de síntesis se distinguen por el estado físico de la fase en la que la síntesis tiene lugar, es decir fase líquida o fase sólida.
En la síntesis de péptidos en fase sólida (SPFS), se une un aminoácido o grupo peptídico a un soporte sólido de resina. Posteriormente, se unen sucesivos aminoácidos o grupos peptídicos al péptido unido al soporte hasta que el material peptídico de interés se ha formado. Entonces normalmente el péptido unido al soporte se escinde del soporte y se somete a un procesado y/o purificación posterior. En algunos casos, la síntesis en fase sólida proporciona un producto peptídico maduro; en otros casos el péptido escindido del soporte (es decir, un "fragmento de péptido intermedio") se utiliza en la preparación de un producto peptídico maduro más grande.
Los fragmentos de péptido intermedios generados en los procesos de fase sólida pueden acoplarse en un proceso sintético de fase sólida o de fase líquida (referido de ahora en adelante como "síntesis en fase en solución"). La síntesis en fase en solución puede ser particularmente útil en los casos en los que la síntesis de un péptido maduro útil en fase sólida es imposible o no es práctica. Por ejemplo, en la síntesis en fase sólida, los péptidos largos, pueden adoptar eventualmente una conformación irregular mientras aún están unidos al soporte sólido, haciendo difícil la adición de aminoácidos o material peptídico a la cadena creciente. A medida que la cadena de péptido se hace más larga en el soporte de resina, la eficiencia de los pasos del proceso, como el acoplamiento y la desprotección, pueden estar comprometidos. Esto, a su vez, puede resultar en tiempos de procesado más largos para compensar estos problemas, además del incremento de las pérdidas de materiales de partida, como los aminoácidos activables, co-reactivos y disolventes. Estos problemas pueden aumentar a medida que la longitud del péptido aumenta.
Por lo tanto, relativamente poco común encontrar péptidos maduros mayores de 30 aminoácidos de longitud sintetizados en un único fragmento utilizando solamente un procedimiento de fase sólida. En lugar de esto, pueden sintetizarse fragmentos individuales de forma separada en fase sólida, y después acoplarse en fase sólida y/o en solución para conseguir el producto peptídico deseado. Esta aproximación requiere una cuidadosa selección de los fragmentos candidatos. Aunque algunos principios generales pueden servir de guía en la selección de fragmentos, a menudo son necesarias pruebas empíricas de los fragmentos candidatos. Estrategias de fragmentos que funcionan en un contexto pueden no funcionar en otros. Aún cuando se encuentran fragmentos candidatos razonables, todavía pueden ser necesarias innovaciones del proceso para que la estrategia de síntesis para que funcione bajo condiciones razonables a nivel comercial. Por lo tanto, la síntesis de péptido utilizando esquemas híbridos es a menudo un reto, y en muchos casos es difícil predecir los problemas inherentes en un esquema de síntesis hasta que se realiza la síntesis real.
En el acoplamiento en fase en solución, se acoplan dos fragmentos de péptido intermedios, o un fragmento intermedio de péptido y un aminoácido reactivo, en un solvente apropiado, normalmente en presencia de reactivos adicionales que promueven la eficiencia y la calidad de la reacción de acoplamiento. Los fragmentos de péptido intermedios están dispuestos de forma reactiva de forma que el extremo N-terminal de un fragmento se acopla al extremo C-terminal del otro fragmento o viceversa. Además, los grupos protectores de cadenas laterales, que están presentes durante la síntesis en fase sólida, comúnmente se retienen en los fragmentos durante la fase de acoplamiento en solución para asegurar la reactividad específica de los extremos terminales de los fragmentos. Estos grupos protectores de cadenas laterales normalmente no se eliminan hasta que se ha formado un péptido maduro.
Pequeñas mejoras en uno o más pasos en el esquema sintético general pueden proporcionar una mejora significativa en la preparación del péptido maduro. Tales mejoras pueden resultar en un gran ahorro general de tiempo y reactivos, y también puede mejorar significativamente la pureza y el rendimiento del producto final.
Mientras la discusión de la importancia de las mejoras en la síntesis híbrida es aplicable a cualquier tipo de péptido producido utilizando estos procedimientos, esto es de una particular importancia en el contexto de los péptidos que son terapéuticamente útiles y que están elaborados a una escala para uso médico comercial. La síntesis de fármacos biomoleculares mayores, como los péptidos terapéuticos, puede ser muy cara. Debido al coste de los reactivos, el tiempo de síntesis, muchos pasos de síntesis, además de otros factores, pequeñas mejoras en el proceso sintético de estos fármacos biomoleculares grandes pueden tener un impacto significativo en sí es económicamente factible producir este medicamento. Tales mejoras son necesarias debido a estos altos costes de producción para medicamentos biomoleculares grandes como se sostiene en el hecho de que, en muchos casos, existen pocas alternativas terapéuticas adecuadas, si las hay, para estos tipos de fármacos biomoleculares grandes.
Esto se aprecia claramente en el caso del péptido similar al glucagón-1 (GLP-1) y sus homólogos. Estos péptidos se han implicado como posibles agentes terapéuticos en el tratamiento de diabetes mellitus no insulino-dependiente de tipo 2 así como en los trastornos metabólicos relacionados, como la obesidad. Gutniak, M.K. et al., Diabetes Care 1994:17:1039-44.
López et al. han determinado que el GLP-1 nativo tiene una longitud de 37 residuos aminoacídicos. López L. C. et al., Proc. Natl. Acad. Sci. USA., 80:5485-5489 (1983). Esta determinación se confirmó con el trabajo de Uttenthal, L. O. et al., J. Clin. Endocrinal. Metabol., 61:472-479 (1985). El GLP-1 nativo puede representarse mediante la anotación GLP-1(1-37). Esta anotación indica que el péptido posee todos los aminoácidos desde el 1 (N-terminal) hasta el 37 (C-terminal). El GLP-1 nativo posee la secuencia de aminoácidos de acuerdo con el Id. de Sec. Nº 1:
HDEFERHAEGTFTSDVSSYLEGQAAKEFIAWLVKGRG
Se ha descrito que el GLP-1 nativo (1-37) es generalmente incapaz de mediar en la biosíntesis de insulina, pero fragmentos biológicamente importantes de este péptido poseen propiedades insulinotrópicas. Por ejemplo, el péptido GLP-1(7-37) nativo de 31 aminoácidos de longitud de acuerdo con el Id. de Sec. Nº 2:
HAEGTFTSDVSSYLEGQAAKEFIAWLVKGRG
es insulinotrópico y posee los aminoácidos desde la posición 7 (N terminal) a la 37 (C terminal) del GLP-1 nativo. EL GLP-1 (7-37) posee una glicina terminal. Cuando esta glicina está ausente, el péptido resultante es aún insulinotrópicamente activo y se denomina GLP-1(7-36) de acuerdo con el Id. de Sec. Nº 3:
HAEGTFTSDVSSYLEGQAAKEFIAWLVKGR
El GLP-1(7-36) a menudo se encuentra con la arginina C-terminal en su forma amidada, y esta forma puede representarse mediante la anotación GLP-1(7-36)-NH2.
El GLP-1(1-37) generalmente se convierte in vivo en un homólogo insulinotrópicamente activo del mismo. Por ejemplo, el GLP-1(1-37) se convierte naturalmente en el GLP-1(7-37) in vivo. Este péptido, a su vez, puede también sufrir un procesado adicional mediante la eliminación proteolítica de la glicina C-terminal para producir el GLP-1(7-36), que a menudo existe en la forma amidada GLP-1(7-36)-NH2....
Reivindicaciones:
1. Un método para obtener un péptido insulinotrópico,
que comprende los siguientes pasos de a) a f):
a) proporcionar un primer fragmento peptídico que incluye la secuencia de aminoácidos HX8EX10 (Id. de Sec. Nº 6), en la que X8 y X10 son cada uno residuos de un aminoácido aquiral, incluyendo opcionalmente cada uno de H y E la protección de la cadena lateral;
b) proporcionar un segundo fragmento peptídico que incluye la secuencia de aminoácidos TFTSDVX17-18YLEG (Id. de Sec. Nº 8) en la que el residuo denotado mediante el símbolo X17-18 es un residuo dipeptídico de pseudoprolina, incluyendo opcionalmente dichos residuos de aminoácidos de la secuencia la protección de la cadena lateral;
c) acoplar el primer fragmento al segundo fragmento para proporcionar un tercer fragmento peptídico que incluye la secuencia de aminoácidos HX8EX10TFTSDVX17-18YLEG (Id. de Sec. Nº 11), incluyendo opcionalmente dichos residuos de aminoácidos de la secuencia la protección de la cadena lateral;
d) proporcionar un cuarto fragmento peptídico que incluye la secuencia de aminoácidos QAAKEFIAWLVKX35 (Id. de Sec. Nº 9), en el que X35 es un residuo de un aminoácido aquiral, incluyendo opcionalmente dichos residuos de aminoácidos de la secuencia la protección de la cadena lateral;
e) acoplar el cuarto fragmento peptídico a arginina para proporcionar un quinto fragmento peptídico que incluye la secuencia de aminoácidos QAAKEFIAWLVKX35R (Id. de Sec. Nº 12), incluyendo opcionalmente dichos residuos de la secuencia la protección de la cadena lateral; y
f) acoplar el quinto fragmento al tercer fragmento para proporcionar un péptido insulinotrópico que incluye la secuencia de aminoácidos HX8EX10TFTSDVX17-18YLEGQAAKEFIAWLVK X35R (Id. de Sec. Nº 13), incluyendo opcionalmente dichos residuos de la secuencia la protección de la cadena lateral.
2. El método de acuerdo con las reivindicación 1, que comprende otro paso de:
g) eliminar los grupos protectores de la cadena lateral para proporcionar un péptido insulinotrópico que incluye la secuencia de aminoácidos HX8EX10TFTSDVSSYLEGQAAKEFIAWLVKX35R (Id. de Sec. Nº 5) y los homólogos de la misma, en la que cada uno de los símbolos X en las posiciones, 8, 10 y 35 independientemente indican un residuo de aminoácido aquiral, opcionalmente obstaculizado estéricamente.
3. Un método para obtener un péptido insulinotrópico de acuerdo con la reivindicación 1, que comprende los pasos de:
a) proporcionar un primer fragmento peptídico que incluye la secuencia de aminoácidos HX8EX10 (Id. de Sec. Nº 6), en los que X8 es un residuo de aminoácido que corresponde a Aib y X10 es un residuo de aminoácido que corresponde a glicina, e incluyendo opcionalmente cada uno de H y E la protección de la cadena lateral;
b) proporcionar un segundo fragmento peptídico que incluye la secuencia de aminoácidos TFTSDVX17-18YLEG (Id. de Sec. Nº 8) en la que el residuo denotado mediante el símbolo X17-18 es un residuo dipeptídico de pseudoprolina, incluyendo opcionalmente dichos residuos de aminoácido de la secuencia la protección de la cadena lateral;
c) acoplar el primer fragmento al segundo fragmento para proporcionar un tercer fragmento peptídico que incluye la secuencia de aminoácidos HX8EX10 TFTSDV X17-18YLEG (Id. de Sec. Nº 11), incluyendo opcionalmente dichos residuos de aminoácido de la secuencia la protección de la cadena lateral;
d) proporcionar un cuarto fragmento peptídico que incluye la secuencia de aminoácidos QAAKEFIAWLVKX35 (Id. de Sec. Nº 9), en los que X35 es un residuo de aminoácido que corresponde a Aib, incluyendo opcionalmente dichos residuos de aminoácido de la secuencia la protección de la cadena lateral;
e) acoplar el cuarto fragmento peptídico a arginina para proporcionar un quinto fragmento peptídico que incluye la secuencia de aminoácidos QAAKEFIAWLVKX35R (Id. de Sec. Nº 12), incluyendo opcionalmente dichos residuos de la secuencia la protección de la cadena lateral; y
f) acoplar el quinto fragmento al tercer fragmento seguido de la eliminación de los grupos protectores de la cadena lateral para proporcionar un péptido insulinotrópico de fórmula HX8EX10TFTSDVSSYLEGQAAKEFIAWLVKX35R (Id. de Sec. Nº 5) y los homólogos de la misma, en la que X8 y X35 son residuos de aminoácido que corresponden a Aib, y X10 es un residuo de aminoácido que corresponde a glicina.
4. El método de acuerdo con las reivindicaciones 1 o 3, en el que X8 es un residuo de aminoácido que corresponde a metilalanina.
5. El método de acuerdo con las reivindicaciones 1 o 3, en el que X10 es un residuo de aminoácido que corresponde a glicina.
6. Un fragmento peptídico con la secuencia de aminoácidos HX8EX10 (Id. de Sec. Nº 6), en el que X8 y X10 son cada uno residuos de un aminoácido aquiral, tanto H como E, X8 y X10 incluyen opcionalmente la protección de la cadena lateral.
7. El fragmento peptídico de la reivindicación 6, en el que X8 es un residuo de aminoácido que corresponde a Aib y X10 es un residuo de aminoácido que corresponde a glicina.
8. El método de acuerdo con reivindicación 1, en el que el péptido insulinotrópico incluye la secuencia de aminoácidos (Id. de Sec. Nº 5)
y los homólogos de la misma, en la cada uno de los símbolos X en las posiciones 8, 10 y 35 indican de forma independiente un residuo de aminoácido aquiral, opcionalmente obstaculizado estéricamente; y en la que uno o más de los residuos de aminoácido incluye opcionalmente la protección de la cadena lateral.
9. El método de acuerdo con la reivindicación 8, en el que al menos uno de entre X8 y X35 es un residuo de Aib.
10. El método de acuerdo con la reivindicación 8, en el que X10 es un residuo de glicina.
11. El método de acuerdo con la reivindicación 1, en el que X17-18 tiene la fórmula
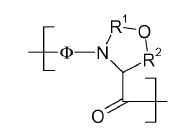
en la que F representa el residuo de cualquier aminoácido que opcionalmente incluye protección de la cadena lateral, y cada uno de R1 y R2 es independientemente una porción de unión divalente adecuada.
12. El método de acuerdo con la reivindicación 11, en el que F representa un residuo de Ser que incluye opcionalmente la protección de la cadena lateral.
13. El método de acuerdo con la reivindicación 11, en el que R2 es -CH2-.
14. El método de acuerdo con la reivindicación 11, en el que R1 es
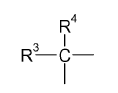
en donde cada uno de R3 y R4 es independientemente una porción monovalente seleccionada de entre H o alquilo inferior; o R3 y R4 pueden ser también co-miembros de una estructura en anillo.
15. El método de acuerdo con la reivindicación 14, en el que cada uno de R3 y R4 es metilo.
16. Un péptido o un homólogo del mismo que incluye la secuencia de aminoácidos TFTSDVX17-18YLEG (Id. de Sec. Nº 8) en la que el residuo denotado mediante el símbolo X17-18 es un residuo dipeptídico de pseudoprolina; incluyendo opcionalmente dichos residuos de aminoácidos la protección de la cadena lateral.
17. El método de acuerdo con la reivindicación 1, en el que X35 es un residuo de aminoácido de metilalanina.
18. El método de acuerdo con las reivindicaciones de 1 a 2, en el que el péptido insulinotrópico posee la secuencia de aminoácidos (Id. de Sec. Nº 4)
y homólogos de la misma.
19. El método de acuerdo con la reivindicación 18, en el que el péptido insulinotrópico posee la secuencia de aminoácidos (Id. de Sec. Nº 4)
y homólogos de la misma, que está amidada en el extremo C-terminal.
Patentes similares o relacionadas:
Agonistas del receptor de glucagón, del 24 de Junio de 2020, de ELI LILLY AND COMPANY: Un compuesto agonista del receptor de glucagón que comprende la fórmula: YX1QGTFX2SDYSKYLDX3KKAX4EFVX5WLLEX6X7 en la que X1 es Aib; X2 es T o L; X3 es Aib; […]
Profármacos de GLP-1, del 17 de Junio de 2020, de NOVO NORDISK A/S: Un compuesto de GLP-1 de la fórmula general I: R1 -(NHXaa1)-Xaa2-(OHis)-(péptido GLP-1) (Fórmula I) en donde el péptido GLP-1 es […]
Método para preparar semaglutida, del 13 de Mayo de 2020, de Hybio Pharmaceutical Co., Ltd: Método de preparación de semaglutida, que comprende las etapas de: etapa 1: acoplar Gly a una resina mediante síntesis en fase sólida para obtener Gly-resina; y […]
Coagonistas estables del receptor de GLP-1/glucagón basados en GLP-1, del 6 de Mayo de 2020, de NOVO NORDISK A/S: Un derivado de GLP-1 caracterizado por tener la fórmula: amida de Nε34-[2-[2-[2-[[2-[2-[2-[[(4S)-4-carboxi-4- [[(4S)-4-carboxi-4-(17- carboxiheptadecanoilamino)butanoil]amino]butanoil]amino]etoxi]etoxi]acetil]amino]etoxi]etoxi]acetil]- […]
Una composición para el tratamiento de la diabetes que comprende un análogo de oxintomodulina, del 11 de Marzo de 2020, de HANMI PHARM. CO., LTD.: Una composición para su uso en la prevención o el tratamiento de la diabetes, la composición comprende un conjugado de análogo de oxintomodulina como un ingrediente […]
Modificador de exenatida y uso del mismo, del 12 de Febrero de 2020, de BrightGene Bio-Medical Technology Co., Ltd: Un modificador de exenatida o sales farmacéuticamente aceptables del mismo que tienen actividad del agonista del receptor de GLP-1, como se muestra en la fórmula (I): (Ex-4)-L-Y […]
Derivados de GLP-1 doble-acilados, del 4 de Diciembre de 2019, de NOVO NORDISK A/S: Un derivado de un análogo de GLP-1, cuyo análogo comprende un primer residuo de K en una posición correspondiente a la posición 26 de GLP-1 […]
Análogos de glucagón, del 13 de Noviembre de 2019, de ZEALAND PHARMA A/S: Un compuesto que tiene la fórmula: R1-X-Z-R2 en donde R1 es H (es decir, hidrógeno), alquilo C1-4, acetilo, formilo, benzoílo o trifluoroacetilo; […]