SEPARACION CROMATOGRAFICA DE POLIPEPTIDOS TERAPEUTICOS.
Un método para purificar interferón-ß mediante cromatografía de exclusión de tamaño que comprende las etapas de:
preparar una solución de amortiguación que tiene un resistencia iónica de más de 50 mM y menos de 500 mM, dicha solución de amortiguación comprende adicionalmente un detergente iónico;
cargar una columna de cromatografía de tamaño de exclusión con dicho interferón-ß o interferón-ß1b;
eluir dicho interferón con solución de amortiguación de la columna de cromatografía de tamaño de exclusión;
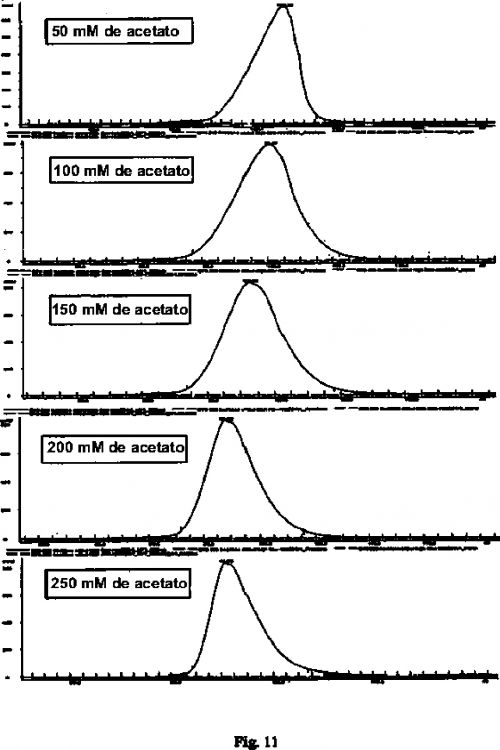
observar un perfil de elución y determinar el valor de asimetría del pico interferón del perfil de elución, en donde el valor de asimetría es la relación de amplitud de la mitad de una cola de un pico con una amplitud de una mitad delantera del pico medido en 10% de la altura del pico; y
recolectar las fracciones de elución cuando el valor de asimetría del pico interferón del perfil de elución está entre 0.4 y 1.6
Tipo: Resumen de patente/invención. Número de Solicitud: W04029774US.
Solicitante: NOVARTIS VACCINES AND DIAGNOSTICS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 4560 HORTON STREET,EMERYVILLE, CA 94608-2912.
Inventor/es: RIQUELME,PATRICIO T.,CHIRON CORPORATION, VICTA,CORAZON TERCIANO,CHIRON CORPORATION, CROSIER,WALTER JOSEPH,CHIRON CORPORATION, WENDELL,JOHN THARIN,CHIRON CORPORATION.
Fecha de Publicación: .
Fecha Concesión Europea: 28 de Octubre de 2009.
Clasificación Internacional de Patentes:
- C07K14/565 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › IFN beta.
Clasificación PCT:
- C07K1/16 C07K […] › C07K 1/00 Procedimientos generales de preparación de péptidos. › por cromatografía.
Clasificación antigua:
- C07K1/16 C07K 1/00 […] › por cromatografía.
Fragmento de la descripción:
Separación cromatográfica de polipéptidos terapéuticos.
Antecedente de la invención
La presente invención se dirige a la purificación y comercialización de polipéptidos que han demostrado valor terapéutico.
Las siguientes publicaciones bibliográficas se mencionan en esta sección.
Helenius, A., McCaslin, D.R., Fries, E. y Tanford, C. in "Properties of Detergents" Methods in Enzymology, vol. 56 (1979), Páginas 734-749.
Turro, N.J., Lei, X., Ananthapadmanabhan, K.P. y Aronson, M. in "Spectroscopic probe analysis of proteinsurfactant interactions: the BSA/SDS system" Langmuir (1995), vol. 11, Páginas 2525-2533.
Existen muchos polipéptidos terapéuticamente importantes comercializados actualmente para el tratamiento de una enfermedad. Los interferones, por ejemplo, son citoquinas importantes que exhiben actividades antivíricas, antiproliferativas e inmunomoduladoras. Tales actividades se han utilizado para derivar beneficios clínicos de los polipéptidos para un número de estados de enfermedad, tal como hepatitis, varios cánceres y esclerosis múltiples. Los interferones se clasifican por ser de dos tipos diferentes interferones a, ß, t y ? tipo I y tipo II. Los Interferones a, ß, t y ? son miembros de los interferones tipo I, aunque el interferón y es el único miembro conocido de la clase tipo II distinta.
El Interferón ß humano consiste de 166 residuos de aminoácido y tiene un peso molecular de aproximadamente 22 kDa. Se produce mediante la mayoría de células en el cuerpo, pero particularmente mediante fibroblastos en respuesta a una infección vírica u otro invasor biológico. El objetivo de unión de Interferón ß es un receptor de superficie celular multimérico, que, luego de unión, activa una cascada de eventos intracelulares que conducen a la expresión de características antivíricas, antiproliferativas e inmunomoduladoras.
Se han utilizado una variedad de diferentes técnicas para caracterizar la estructura de interferón ß humano. Por ejemplo, la secuencia de aminoácido de interferón humano se ha reportado (ver Taniguchi, Gene 10:11-15, 1980), así como también estructuras de cristal para interferón ß humano y de murino (ver respectivamente, Proc. Natl. Acad. Sci. USA 94: 11813-11818, 1997. J. Mol. Biol. 253:187-207, 1995). Tales datos estructurales también se han sometido a un artículo de revisión. (Ver, Cell Mol. Life Sci. 54:1203-1206, 1998.)
Las preparaciones de Interferón ß se venden bajo los nombres comerciales BETASERON®, AVONEXTM, y REBIF®. También se conoce BETASERON ® como Interferón ß-1b, que es una proteína no glucosilada que tiene una eliminación de metionina de terminal N. El interferón ß-1b es una muteína en la que la cisterna en la posición 17 ha mutado a una serina. Esto se produce utilizando células bacterianas recombinantes. AVONEXTM y REBIF®, que son diferentes formas comerciales de Interferón ß-1a, se glucosilan y se producen utilizando células de mamífero recombinantes. El Interferón ß-1a no contiene una mutación en la posición de aminoácido 17. Estos agentes se utilizan para tratar pacientes con esclerosis múltiple, y se han mostrado por ser efectivos en reducir la velocidad de exacerbación de la enfermedad.
El interferón ß ha sido mostrado por retrasar la progresión de esclerosis múltiple y por ser efectivo en el tratamiento de una variedad de otras enfermedades. Su mecanismo de acción para retrasar la esclerosis múltiple no es claro. Algunas actividades que pueden actuar en relación para dar cuenta del efecto terapéutico del compuesto, sin embargo, incluyen los siguientes: el Interferón ß tiene efectos inhibidores en la proliferación de leucocitos y la presentación de antígeno y puede modular el perfil de producción de citoquina hacia un fenotipo anti-inflamatorio; e, Interferón ß, a través de la inhibición de metaloproteasas de matriz de célula T, puede reducir la migración de célula T. (Ver, Neurol. 51:682-689, 1998.) Otras enfermedades que pueden utilizar Interferón ß para tratamiento incluyen osteosarcoma, carcinoma de célula basal, displasia cervical, glioma, leucemia mieloide agua, mieloma múltiple, enfermedad de Hodgkin, carcinoma de mama, melanoma, e infecciones víricas tal como virus de papiloma, hepatitis vírica, herpes genitalis, herpes zóster, queratitis herpética, herpes simplex, encefalitis vírica, neumonía citomegalovirus, y rinovirus.
Dada la importancia terapéutica del Interferón ß, es crucial obtener preparaciones comerciales del polipéptido en una forma eficiente y económica. Los métodos recombinantes de la preparación de Interferón ß producen cantidades sustanciales del compuesto, pero esta es solo la primera etapa. Después de producción, el Interferón ß se puede aislar y purificar a un grado que es médicamente aceptable. Es un objetivo de la invención objeto tal purificación del polipéptido, y otros polipéptidos como este.
Resumen de la invención
La presente invención se dirige a la purificación y comercialización de Interferón-ß que tiene valor terapéutico.
En un aspecto de un método de la invención, se proporciona un método para purificar Interferón ß-1b utilizando cromatografía de tamaño de exclusión en la presencia de un detergente iónico. En este método, se prepara una solución de amortiguación. La solución de amortiguación comprende más de 50 mM de sal y menos de 500 mM de sal. El Interferón ß-1b se carga en una columna de cromatografía de tamaño de exclusión. El Interferón ß-1b se carga preferiblemente en la columna utilizando la solución de amortiguación. Cuando el Interferón ß-1b se carga utilizando una solución de amortiguación, se puede preparar una mezcla que comprende Interferón ß-1b y la solución de amortiguación. El Interferón ß-1b se pasa a través de una columna que contiene un gel polimérico, y se recolectan las fracciones de elución que contienen interferón ß-1b purificado y solución de amortiguación. Durante la elución de Interferón ß-1b, se observa un perfil de elución y se determina un valor de asimetría del perfil de elución. Las fracciones de elución se recolectan cuando el valor de asimetría de un perfil de elución está entre 0.1 y 2.0. Preferiblemente, las fracciones de elución se recolectan cuando el valor de asimetría del perfil de elución está entre 0.2 y 1.9, entre 0.3 y 1.8, 0.4 y 1.7, 0.4 y 1.6, y 0.5 y 1.5. Aún más preferiblemente, las fracciones de elución se recolectan cuando el valor de asimetría del perfil de elución está entre 0.8 y 1.2 o entre 0.9 y 1.1.
Cualquier cantidad deseada de Interferón ß-1b se purifica utilizando el método. Las cantidades típicas, sin embargo, son más de 1.0 g, 2.5 g, 5.0 g, 10 g, 25 g, 50 g, 100 g, 150 g, 200 g, 250 g, o 300 g.
Este método proporciona el polipéptido purificado en donde la cantidad de un polipéptido contaminante (por ejemplo, una proteína anfitriona cuando el polipéptido deseado se produce recombinantemente) está presente en una concentración de menos de 1 µg por 1 mg del polipéptido deseado. Preferiblemente, la cantidad de polipéptido contaminante está presente en una concentración de menos de 500 ng por 1 mg del polipéptido deseado, menos de 250 ng por 1 mg del polipéptido deseado, 100 ng por 1 mg del polipéptido deseado, 75 ng por 1 mg del polipéptido deseado. Aún más preferiblemente, la cantidad de polipéptido contaminante está presente en una concentración de menos de 50 ng por 1 mg del polipéptido deseado, 25 ng por 1 mg del polipéptido deseado, y 10 ng por 1 mg del polipéptido deseado.
El gel polimérico es de cualquier composición adecuada. Típicamente, el gel se selecciona de un grupo de geles que incluyen dextrano (es decir, SEPHADEX®), agarosa (es decir, SEPHAROSE®), y poliacrilamida (SEPHACRIL®). Un gel que se utiliza frecuentemente es Sephadex G75 SF, que es un gel con base en dextrano que tiene un diámetro de partícula seca de 10 a 40 µm.
El volumen de la columna que contiene el gel polimérico es típicamente menos de 450 cm3. Algunas veces, el volumen es menos de 400 cm3, 350 cm3, o 300 cm3.
La sal de la solución de amortiguación...
Reivindicaciones:
1. Un método para purificar interferón-ß mediante cromatografía de exclusión de tamaño que comprende las etapas de:
preparar una solución de amortiguación que tiene un resistencia iónica de más de 50 mM y menos de 500 mM, dicha solución de amortiguación comprende adicionalmente un detergente iónico;
cargar una columna de cromatografía de tamaño de exclusión con dicho interferón-ß o interferón-ß1b;
eluir dicho interferón con solución de amortiguación de la columna de cromatografía de tamaño de exclusión;
observar un perfil de elución y determinar el valor de asimetría del pico interferón del perfil de elución, en donde el valor de asimetría es la relación de amplitud de la mitad de una cola de un pico con una amplitud de una mitad delantera del pico medido en 10% de la altura del pico; y
recolectar las fracciones de elución cuando el valor de asimetría del pico interferón del perfil de elución está entre 0.4 y 1.6
2. El método de la Reivindicación 1 en donde dicha solución de amortiguación tiene una resistencia iónica de más de 75 mM y menos de 250 mM.
3. El método de la Reivindicación 2 en donde dicha solución de amortiguación tiene una resistencia iónica de más de 100 mM y menos de 200 mM.
4. El método de la Reivindicación 2 en donde dicha solución de amortiguación tiene una resistencia iónica de 100 mM.
5. El método de la Reivindicación 2 en donde dicha solución de amortiguación tiene una resistencia iónica de 150 mM.
6. El método de la Reivindicación 2 en donde dicha solución de amortiguación tiene una resistencia iónica de 200 mM.
7. El método de cualquier reivindicación precedente en donde dicha solución de amortiguación comprende acetato de sodio.
8. El método de cualquier reivindicación precedente en donde dicho detergente iónico está presente en la solución de amortiguación en una concentración de entre 0.05% en peso y 0.25% en peso.
9. El método de la Reivindicación 8 en donde dicho detergente iónico está presente en la solución de amortiguación en una concentración de entre 0.075% en peso y 0.2% en peso
10. El método de la Reivindicación 9 en donde dicho detergente iónico está presente en la solución de amortiguación en una concentración de 0.1% en peso.
11. El método de cualquier reivindicación precedente en donde dicho detergente iónico es dodecilsulfato de sodio.
12. El método de cualquier reivindicación precedente en donde dicha solución de amortiguación comprende adicionalmente un quelador de metal.
13. El método de la Reivindicación 12 en donde dicho quelador de metal está presente en una concentración de entre 0.5 mM a 1.5 mM.
14. El método de la Reivindicación 12 o Reivindicación 13 en donde dicho quelador de metal es ácido etilenodiamina-tetraacético.
15. El método de una cualquiera de las Reivindicaciones 12 a 14 en donde dicho quelador de metal está presente en una concentración de 1 mM.
16. El método de cualquier reivindicación precedente en donde el valor de asimetría del perfil de elución está entre 0.5 y 1.5.
17. El método de la Reivindicación 16 en donde el valor de asimetría del perfil de elución está entre 0.6 y 1.4.
18. El método de la Reivindicación 17 en donde el valor de asimetría del perfil de elución está entre 0.8 y 1.2.
19. El método de la Reivindicación 18 en donde el valor de asimetría del perfil de elución está entre 0.9 y 1.1.
20. El método de cualquier reivindicación precedente en donde dicho interferón es interferón-ß1b.
21. El método de cualquier reivindicación precedente en donde la cantidad del interferón purificado es mayor de 1 gramo.
Patentes similares o relacionadas:
Nuevos análogos de la proteína IFN beta, del 22 de Mayo de 2019, de Ares Trading SA: Un método de desamidación de una proteína, que comprende: (a) incubar la proteína que se va a desamidar bajo condiciones alcalinas durante […]
Polipéptido presentando cadenas de azúcares sialiladas unidas al mismo, del 29 de Octubre de 2018, de Glytech, Inc: Un polipéptido glicosilado presentando actividad de interferón ß, caracterizado por que dicho polipéptido glicosilado es cualquier polipéptido seleccionado del grupo que consiste […]
 Un método para determinar biomarcadores relacionados con el síndrome de distrés respiratorio agudo (ARDS), un método para monitorizar el desarrollo y tratamiento de ARDS en un paciente, del 28 de Septiembre de 2018, de FARON PHARMACEUTICALS OY: Un método para monitorizar el desarrollo de ARDS en un paciente, en el que se han determinado 3-8 de los biomarcadores relacionados con ARDS en muestras de suero extraídas […]
Un método para determinar biomarcadores relacionados con el síndrome de distrés respiratorio agudo (ARDS), un método para monitorizar el desarrollo y tratamiento de ARDS en un paciente, del 28 de Septiembre de 2018, de FARON PHARMACEUTICALS OY: Un método para monitorizar el desarrollo de ARDS en un paciente, en el que se han determinado 3-8 de los biomarcadores relacionados con ARDS en muestras de suero extraídas […]
Procedimiento para la preparación del interferón beta glicosilado, del 21 de Marzo de 2018, de ARES TRADING S.A.: Un procedimiento para la fabricación de interferón beta recombinante humano glicosilado, que comprende una etapa de cultivar células CHO […]
Polipéptidos de acción prolongada y usos de estos, del 13 de Diciembre de 2017, de OPKO Biologics Ltd: Un polipéptido modificado con CTP que comprende un péptido de interferón-beta 1 (IFNß1) y dos péptidos carboxi terminal de la gonadotropina coriónica, en donde el […]
Conjugados poliméricos de interferón beta-1a y usos de los mismos, del 30 de Agosto de 2017, de Biogen MA Inc: Una composición que comprende un interferón-beta-1a o una proteína de fusión que comprende dicho interferón-beta-1a,donde el interferón-beta-1a consiste en la secuencia de aminoácidos […]
Método para producir proteína de interferón recombinante soluble sin desnaturalización, del 9 de Agosto de 2017, de Pfenex, Inc: Un método para producir una proteína interferón de tipo 1 recombinante, comprendiendo dicho método: expresar la proteína interferón recombinante cultivando […]
Remodelación y glucoconjugación del Factor IX, del 21 de Diciembre de 2016, de NOVO NORDISK A/S: Un conjugado covalente entre un Factor IX y un grupo modificador que altera una propiedad de dicho Factor IX, en el que dicho grupo modificador está unido por enlace […]