REDUCIR LAS EXPERIENCIAS ADVERSAS ASOCIADA CON LA TERAPIA DE OXIBUTININA.
El uso de oxibutinina para la preparación de un parche de matriz transdérmico para la administración a un mamífero para proporcionar un área de plasma por debajo de la proporción de la curva (AUC) de oxibutinina a N-desetiloxibutinina de 0,
5:1 a 5:1 para minimizar una experiencia adversa al medicamento asociada con la terapia de oxibutinina, el mencionado parche de matriz transdérmico tiene triacetina como un potenciador de la penetración
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2001/013135.
Solicitante: WATSON PHARMACEUTICALS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 311 BONNIE CIRCLE CORONA, CA 92880 ESTADOS UNIDOS DE AMERICA.
Inventor/es: EBERT, CHARLES, D., SANDERS,Steven,W.
Fecha de Publicación: .
Fecha Solicitud PCT: 24 de Abril de 2001.
Clasificación Internacional de Patentes:
- A61K31/216 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › de ácidos que tienen ciclos aromáticos, p. ej. benacticina, clofibrato.
- A61K47/10 A61K […] › A61K 47/00 Preparaciones medicinales caracterizadas por los ingredientes no activos utilizados, p. ej. portadores o aditivos inertes; Agentes de direccionamiento o agentes modificadores enlazados químicamente al ingrediente activo. › Alcoholes; Fenoles; Sus sales, p. ej. glicerol; Polietilenglicoles [PEG]; Poloxámeros; Éteres alquílicos PEG/POE.
- A61K47/14 A61K 47/00 […] › Esteres de ácidos carboxílicos, p. ej. monoglicéridos de ácidos grasos, triglicéridos de cadenas medianas, parabenos o ésteres de ácidos grasos y de polietilenglicol (PEG).
- A61K9/00M3
- A61K9/00M5
- A61K9/00M5D
Clasificación PCT:
- A61K31/216 A61K 31/00 […] › de ácidos que tienen ciclos aromáticos, p. ej. benacticina, clofibrato.
- A61K47/10 A61K 47/00 […] › Alcoholes; Fenoles; Sus sales, p. ej. glicerol; Polietilenglicoles [PEG]; Poloxámeros; Éteres alquílicos PEG/POE.
- A61K47/14 A61K 47/00 […] › Esteres de ácidos carboxílicos, p. ej. monoglicéridos de ácidos grasos, triglicéridos de cadenas medianas, parabenos o ésteres de ácidos grasos y de polietilenglicol (PEG).
- A61K9/70 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Bases para tiras, hojas o filamentos.
Clasificación antigua:
- A61F13/00 A61 […] › A61F FILTROS IMPLANTABLES EN LOS VASOS SANGUINEOS; PROTESIS; DISPOSITIVOS QUE MANTIENEN LA LUZ O QUE EVITAN EL COLAPSO DE ESTRUCTURAS TUBULARES, p. ej. STENTS; DISPOSITIVOS DE ORTOPEDIA, CURA O PARA LA CONTRACEPCION; FOMENTACION; TRATAMIENTO O PROTECCION DE OJOS Y OIDOS; VENDAJES, APOSITOS O COMPRESAS ABSORBENTES; BOTIQUINES DE PRIMEROS AUXILIOS (prótesis dentales A61C). › Vendas o apósitos (suspensorios A61F 5/40; apósitos radiactivos A61M 36/14 ); Compresas absorbentes (aspectos químicos de las vendas, apósitos o compresas absorbentes* A61L 15/00, A61L 26/00).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357699_T3.pdf




Fragmento de la descripción:
CAMPO DE LA INVENCION
La presente invención se refiere al uso de la oxibutinina para la preparación de un parche de matriz transdérmico para la administración a un mamífero para proporcionar un área de plasma por debajo de la proporción de la curva 5 (AUC) de oxibutinina a N-desetiloxibutinina de alrededor de 0,5:1 a alrededor de 5:1 para minimizar una experiencia adversa al medicamento asociada con la terapia de oxibutinina, el mencionado parche de matriz transdérmico tiene triacetina como un potenciador de la penetración. Por lo tanto, esta invención cubre los campos de las ciencias farmacéuticas, medicina y otras ciencias de la salud.
ANTECEDENTES DE LA INVENCION 10
La oxibutinina oral es actualmente utilizada para tratar varias formas de vejiga hiperactiva e incontinencia urinaria. Particularmente, la oxibutinina trata efectivamente desordenes de la vejiga causados neurogénicamente. El alivio de los mencionados desordenes se atribuye a la acción anticolinérgica y antiespasmódica que la oxibutinina imparte al sistema nervioso parasimpático y a las fibras musculares de la vejiga urinaria.
En general se cree que, mientras esta actividad anticolinérgica contribuye a la utilidad clínica de la oxibutinina, 15 también contribuye a ciertas experiencias adversas a medicamentos incómodas, como sequedad de boca, vértigos, visión borrosa, y estreñimiento. Más específicamente, estas experiencias han sido generalmente atribuidas a la presencia y cantidad de metabolitos activos de la oxibutinina, por ejemplo, N-desetiloxibutinina. Las experiencias adversas a medicamentos anteriormente mencionadas se observan en una mayoría de pacientes que utilizan las formulaciones actuales de oxibutinina. En algunos casos, estas experiencias adversas son lo suficientemente graves 20 para persuadir al paciente para interrumpir el tratamiento.
Gupta et al (Journal of Clinical Pharmacology vol. 39. No. 1999, páginas 289-296) se refiere a una administración oral de la oxibutinina con una composición de emisión controlada.
La WO 99/48493 (Schwartz Pharma) se refiere a un sistema de administración transdermal para evitar altas concentraciones de oxibutinina. 25
Buyse et al. (Journal of Urology, vol. 160. 1988, páginas 892-896) se refiere a una administración intravesical de oxibutinina.
La US 5.840.754 (Alza Corporation) se refiere a composiciones orales que contienen oxibutinina.
La US 5.500.222 (Alza Corporation) se refiere a la administración transdermal de oxibutinina en la forma de una capa de reservorios. 30
En vista de lo anterior, son extremadamente deseables compuestos y métodos para la administración de oxibutinina que ayuden a minimizar la incidencia y/o severidad de las experiencias adversas a medicamentos antes mencionadas.
RESUMEN DE LA INVENCION
Por lo tanto, la presente invención proporciona el uso de oxibutinina para la preparación de un parche de matriz 35 transdérmico para la administración a un mamífero para proporcionar un área de plasma por debajo de la proporción de la curva (AUC) de oxibutinina a N-desetiloxibutinina de alrededor de 0,5:1 a alrededor de 5:1 para minimizar una experiencia adversa al medicamento asociada con la terapia de oxibutinina, el mencionado parche de matriz transdérmico tiene triacetina como un potenciador de la penetración. Además se describe un método para minimizar una experiencia adversa al medicamento asociada con la terapia de oxibutinina que comprende el paso de 40 administrar una composición farmacéutica que comprende oxibutinina a un sujeto tal que la proporción del área por debajo de la curva de concentración-tiempo de plasma (AUC) de oxibutinina a un metabolito de oxibutinina es de alrededor de 0,5:1 a 5:1. La experiencia adversa al medicamento puede ser cualquier experiencia adversa resultante de la administración de oxibutinina, por ejemplo, anticolinérgico, y/o antimuscarínico de naturaleza.
Ejemplos específicos de experiencias adversas a la oxibutinina conocidas incluyen pero no están limitadas a: 45 experiencias gastrointestinales/genitourinarias, experiencias del sistema nervioso, experiencias cardiovasculares, experiencias dermatológicas, y experiencias oftálmicas, entre otras.
Las formulaciones de administración, pueden ser formulaciones orales, parenterales, transdérmicas, inhalantes, o implantables. De acuerdo a la invención, la formulación de administración es una formulación de administración transdérmica. 50
La oxibutinina tienen un centro molecular quiral, llevando a la presencia de isómeros (R)- y (S)-. Cuando se metaboliza, la oxibutinina da lugar a metabolitos como la N-desetiloxibutinina, que puede presentar también isómeros (R)- y (S)- o una combinación de los mismos. El método de la presente invención abarca específicamente cada isómero para la oxibutinina y sus metabolitos correspondientes. Por ejemplo, en un aspecto, la proporción AUC
de plasma media de (R)-oxibutinina a (S)-oxibutinina es de alrededor de 0,7:1. En otro aspecto, la proporción AUC media de (R)-N-desetiloxibutinina a (R)-oxibutinina es de alrededor de 0,4:1 a alrededor de 1,6:1. En un aspecto, esta proporción AUC media puede ser de alrededor de 1:1. En otro aspecto, la proporción AUC media de (R)-N-desetiloxibutinina a (S)-N-desetiloxibutinina es de alrededor de 0,5:1 a alrededor de 1,3:1. Por ejemplo, esta proporción AUC media puede ser de alrededor de 0,9:1. En otro aspecto, el metabolito puede tener una 5 concentración de plasma máxima media de menos de alrededor de 8 ng/ml. Se proporciona también una composición farmacéutica para administrar oxibutinina a un sujeto, comprendiendo oxibutinina que proporciona una proporción AUC de oxibutinina a un metabolito de oxibutinina de alrededor de 0,5:1 a alrededor de 5:1.
Ejemplos de formulaciones de dosificación adecuadas para la composición incluyen: composiciones de tipo oral, parenteral, transdérmica, inhalante, o implantable. De acuerdo al aspecto de la composición es una composición 10 transdérmica.
Las composiciones pueden contener oxibutinina en sus varias formas isoméricas (R)- y (S)-, o mezclas de las mismas. Además, las composiciones pueden incluir también metabolitos de oxibutinina de formas isoméricas (R)- y (S)-. En un aspecto de la presente invención, la composición resulta en una proporción AUC media de (R)-oxibutinina a (S)-oxibutinina de alrededor de 0,7:1. En otro aspecto, la composición de la presente invención resulta 15 en una proporción AUC media de (R)-N-desetiloxioxibutinina a (R)-oxibutinina de alrededor de 0,4:1 a alrededor de 1,6:1. En un aspecto adicional, esta proporción es de alrededor de 1:1. En otro aspecto, la proporción AUC media de (R)-N-desetiloxibutinina a (S)-N-desetiloxibutinina puede ser de alrededor de 0,5:1 a alrededor de 1,3:1. En un aspecto, la proporción es de alrededor de 0,9:1. En aún otro aspecto, la concentración de plasma del metabolito máxima media puede ser menos de alrededor de 8 ng/ml. 20
La composición de la presente invención puede incluir un portador farmacéuticamente aceptable, y otros ingredientes como se dicte por las necesidades particulares de la formulación de la dosis específica. Tales ingredientes son bien conocidos para aquellos expertos en la materia. Ver por ejemplo, Gennaro, A. Remington: The Science and Practice of Pharmacy 19 ed. (1995), que se incorpora por referencia, en su totalidad. Por ejemplo, una formulación transdérmica incluye, pero no está limitada a, potenciadores de la penetración, anti-irritantes, 25 ajustadores de adhesión, y combinaciones de los mismos.
Se han perfilado por tanto, con bastante amplitud, las características más importantes de la invención de tal forma que la descripción detallada de la misma que sigue pueda ser entendida mejor, y de tal forma que la presente contribución a la técnica pueda ser apreciada mejor. Otras características de la presente invención quedarán más claras de la siguiente descripción detallada de la invención, tomadas con los dibujos acompañantes y las 30 reivindicaciones, o pueden ser aprendidas por la práctica de la invención.
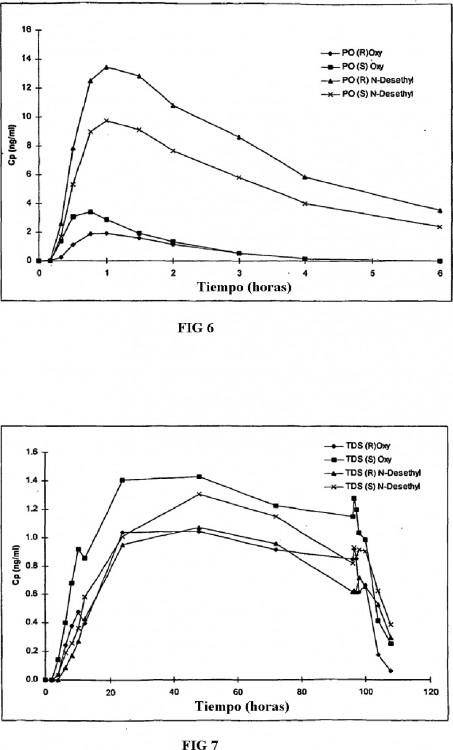
Breve Descripción de los Dibujos
La FIG. 1 es una representación gráfica de las concentraciones de plasma de oxibutinina y N-desetiloxibutinina totales medidas siguiendo una formulación de dosificación oral de administración inmediata de 5 mg de oxibutinina.
La FIG. 2 es una representación gráfica de las concentraciones de plasma... [Seguir leyendo]
Reivindicaciones:
1. El uso de oxibutinina para la preparación de un parche de matriz transdérmico para la administración a un mamífero para proporcionar un área de plasma por debajo de la proporción de la curva (AUC) de oxibutinina a N-desetiloxibutinina de 0,5:1 a 5:1 para minimizar una experiencia adversa al medicamento asociada con la terapia de oxibutinina, el mencionado parche de matriz transdérmico tiene triacetina como un potenciador de la penetración. 5
2. El uso de acuerdo a la reivindicación 1, donde la experiencia adversa al medicamento asociada con la terapia de oxibutinina es sequedad de boca.
3. El uso de acuerdo a la reivindicación 1 ó 2, donde la proporción AUC de oxibutinina a N-desetiloxibutinina es 0,5: 1 a 2:1.
4. El uso de acuerdo a la reivindicación 1 ó 2, donde la proporción AUC de oxibutinina a N-desetiloxibutinina es 1:1 10 a 5:1.
5. El uso de acuerdo a la reivindicación 1 ó 2, donde la proporción AUC de oxibutinina a N-desetiloxibutinina es 0,8:1 a 5:1.
6. El uso de acuerdo a la reivindicación 1, donde la oxibutinina en plasma es (R)-oxibutinina, (S)-oxibutinina, o una combinación de las mismas. 15
7. El uso de acuerdo a la reivindicación 1, donde la N-desetiloxibutinina es (R)-N-desetiloxibutinina, (S)-N-desetiloxibutinina, o una combinación de las mismas.
8. El uso de acuerdo a la reivindicación 6, donde la proporción AUC de (R)-oxibutinina a (S)-oxibutinina es 0,7:1.
9. El uso de acuerdo a la reivindicación 7, donde la proporción AUC de (R)-N-destiloxibutinina a (R)-oxibutinina es de 0,4:1 a 1,6:1. 20
10. El uso de acuerdo a la reivindicación 9, donde la proporción AUC de (R)-N-desetiloxibutinina a (R)-oxibutinina es 1:1.
11. El uso de acuerdo a la reivindicación 7, donde la proporción AUC de (R)-N-desetiloxibutinina a (S)-N-desetiloxibutinina es 0,5:1 a 1,3:1.
12. El uso de acuerdo a la reivindicación 7, donde la proporción AUC de (R)-N-desetiloxibutinina a (S)-N-25 desetiloxibutinina es 0,9:1.
13. El uso de acuerdo a la reivindicación 1, donde la concentración de plasma de N-desetiloxibutinina alcanza un valor máximo de menos de 8 ng/ml.
14. El uso de acuerdo a la reivindicación 1, donde la concentración de plasma de N-desetiloxibutinina alcanza un valor máximo de menos de 5 ng/ml. 30
15. El uso de acuerdo a la reivindicación 1, donde el parche de matriz transdérmico es una composición de administración prolongada.
16. El uso de acuerdo a la reivindicación 1, donde el parche de matriz transdérmico además comprende un ingrediente seleccionado de un anti-irritante, un ajustador de adhesión, o una combinación de los mismos.
17. El uso de acuerdo a la reivindicación 1, donde la experiencia adversa al medicamento asociada con la terapia de 35 oxibutinina es una experiencia seleccionada de experiencias gastrointestinales/genitourinarias, del sistema nervioso, cardiovasculares, dermatológicas, y oftálmicas, o una combinación de las mismas.
18. El uso de acuerdo a la reivindicación 17, donde la experiencia adversa en una experiencia adversa anticolinérgica, o una experiencia adversa antimuscarínica.
Patentes similares o relacionadas:
Preparación sólida que contiene colorante, del 29 de Julio de 2020, de DAIICHI SANKYO COMPANY, LIMITED: Preparación farmacéutica sólida que comprende monobencenosulfonato de ácido [(1R,5S,6S)-6-(aminometil)-3- etilbiciclo[3.2.0]hept-3-en-6-il]acético […]
Preparación externa líquida, del 29 de Julio de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Una preparación tópica líquida, que comprende: agua; oxibutinina o una sal farmacéuticamente aceptable de la misma; y un éster de ácido dicarboxílico, […]
Método de tratamiento del cáncer, del 22 de Julio de 2020, de Intensity Therapeutics, Inc: Una composición que comprende una cantidad terapéuticamente efectiva de un agente terapéutico y un agente mejorador de la permeación intracelular para uso en el tratamiento […]
Preparaciones ácidas de insulina con estabilidad mejorada, del 15 de Julio de 2020, de SANOFI-AVENTIS DEUTSCHLAND GMBH: Formulación farmacéutica que contiene insulina humana Gly(A21),Arg(B31),Arg(B32) y un tensioactivo, elegido de un grupo que contiene Tween 20® y Tween 80®; siendo […]
Cápsulas blandas entéricas de liberación controlada de ésteres de fumarato, del 1 de Julio de 2020, de Banner Life Sciences LLC: Una composición farmacéutica oral que comprende una cápsula blanda entérica que encapsula fumarato de monometilo suspendido en una matriz líquida […]
Composiciones de mentol líquido, del 1 de Julio de 2020, de Ddrops Company: Una composición para usar como remedio en el tratamiento de la tos o síntomas de resfriados, con o sin síntomas de gripe, donde dicha composición comprende: […]
Composiciones tópicas que comprenden un corticosteroide y un retinoide para tratar la psoriasis, del 1 de Julio de 2020, de Bausch Health Ireland Limited: Una composición farmacéutica tópica para usar en el tratamiento de la psoriasis, la composición que comprende: (a) propionato de halobetasol […]
Composición autoemulsionante de ácidos grasos omega-3, del 24 de Junio de 2020, de MOCHIDA PHARMACEUTICAL CO., LTD.: Una preparación autoemulsionante encapsulada que tiene una composición autoemulsionante que comprende, cuando se define que la composición autoemulsionante […]