QUIMERA MULTICOMPONENTE PARA SU USO COMO VACUNA FRENTE A LA INFECCION POR LEISHMANIA SPP. EN MAMIFEROS.
La presente invención se relaciona con una quimera multicomponente,
HISA70, que comprende 6 genes procedentes de Leishmania infantum: H2A, H2B, H3, H4, A2 y HSP70. Así mismo, se relaciona con una composición inmunogénica que comprende dicha quimera multicomponente y con el uso de dicha composición en la elaboración de una vacuna frente a Leishmania spp., para conferir protección frente a la leishmaniosis, incluidas la leishmaniosis cutánea y la leishmaniosis visceral, a mamíferos.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201101355.
Solicitante: UNIVERSIDAD COMPLUTENSE DE MADRID.
Nacionalidad solicitante: España.
Inventor/es: ORDEN GUTIERREZ, JOSE ANTONIO, DOMINGUEZ BERNAL,GUSTAVO, CARRIÓN HERRERO,Fco. Javier, FUENTE LÓPEZ,Ricardo De La.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K39/008 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Antígenos de Leishmania.
- C07K19/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N15/30 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Genes que codifican proteínas de protozoos, p. ej. Plasmodium, Trypanosoma, Eimeria.
Fragmento de la descripción:
Quimera multicomponente para su uso como vacuna frente a la infección por
Leishmania spp. en mamiferos CAMPO T~CNICO
La presenle invención se encuadra dentro del campo de la Sanidad Animal.
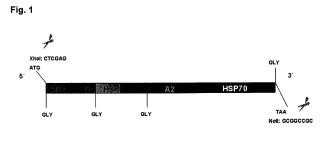
De forma más concreta, la invención se refiere a una construcción genética,
denominada HISA70, que contiene 6 genes que codifican 6 antígenos de Leishmania infanlum implicados en la aparición de los síntomas clfnicos de la leishmaniosis, y al empleo de dicha construcción en la elaboración de una vacuna para su uso frente a la infección por Leishmania spp.
ESTADO DE LA TÉCNICA
Las leishmaniosis constituyen un grupo de enfermedades con distribución mundial y causadas por parásilos protozoos intracelulares del género Leishmania, que son transmitidos por un insecto vector conocido como flebótomo. Esta enfermedad presenta cuadros cHnicos y epidemiológicos diversos. Según datos procedentes de la OMS, la prevalencia de la enfermedad es de 12 millones de casos y actualmente amenaza a 350 millones de personas en 88 paises diferentes (http://www.who.inVtopics/leishmaniasis/en/index.hlmll.principalmente en paises subdesarrollados de zonas tropicales y sublropicales (Sudán, India, Bangladesh, Nepal y Brasil) , pero también en el área mediterránea (700 casos al año en el sur de Europa) . Atendiendo a los sintomas clínicos de la enfermedad, las leishmaniosis han sido clasificadas en varios tipos: leishmaniosis visceral (LV) Y el resto de leishmaniosis con manifestaciones cutáneas: leishmaniosis cutánea (Le) , cutáneo-difusa (LCD) y muco-cutánea (LMC o espundia) . Leishmania infanlum es el principal agente causal de la LV en la región Mediterránea donde, además, el perro doméstico está considerado como el principal reservorio, jugando un papel clave en la transmisión del parásito a seres humanos. Por otro lado, L. major es una de
las especies con mayor repercusión en el Viejo Mundo causando LC
(Gramiccia M., Gradoni L., The current status of zoonotic leishmaniases and approaches to disease control. Int J Parasitol. 2005. 35: 1169-1180) .
En la actualidad, no existe ningún método profiláctico completamente eficaz contra la leishmaniosis. El tratamiento quimioterapéutico, en concreto la terapia con compuestos antim'oniales pentavalentes (Glucantime® y Pentostam®) que interfieren con las rutas metabólicas del parásito, es la más ampliamente utilizada por su capa, cidad de acelerar la curación, disminuir el tamaño de las cicatrices y prevenir posibles recaldas en pacientes con LC. En el caso de la LV, la terapia antimon'ial alcanza una tasa de curación clínica del 90%. Pero el uso de compuestos antimoniales no está exento de efectos secundarios. La anfotericina B ha demostrado que tiene una alta eficacia, y
sus efectos adversos pueden evitarse mediante su administración en liposomas, sin embargo su elevado coste limita su empleo en paises en desarrollo.
Por otro lado, existen evidencias c:llnicas y experimentales que demuestran que la vacunación puede prevenir la leishmaniosis. De hecho, en los últimos años, los esfuerzos de los laboratorios se centran en la búsqueda de nuevos antígenos y adyuvantes, vacunas vivas-atenuadas, antígenos recombinantes en forma de proteina o en forma de DNA, bacterias que expresan antlgenos leishmaniales y estrategias vacuna les con células dendríticas (CD) . Entre los antlgenos que se han ensayado SE' encuentran: la proteína A2 especifica de amastigote, la esterol-24-c-metiltransferasa (SMT) , varias histonas, la proteína ribosomal PO, la proteína inducible por estrés LmSTI1 y la proteína homóloga al receptor de la kinasa C activada de mamíferos (LACK) (de Oliveira C.I., Naseimento I.P., Barral A., Soto M., Barral-Netto M., Challenges and perspectives in vaceination against leishmaniasis, Parasitol Int. 2009. 58:319-324) . En referencia a la leishmaniosis canina, en Brasil se ha empezado a comercializar una vacuna, Leishmune®, compuesta por el ligando Fucosa-Manosa que es administrado en presencia o ausencia del
adyuvante QuilA (W02006122382A2) . También en Brasil, ya registrada, se encuentra otra vacuna, LeishTeC®, . compuesta por el antígeno recombinante A2 procedente de L. donovani (W02009089605A1) . Sin embargo, en el caso de las vacunas desarrolladas en Brasil, no superan el 43-75% de protección y, además, los mecanismos inmunológicos todavia no se conocen en detalle. Finalmente, cabe destacar otra vaGuna (CaniLesh) compuesta por anligenos secretados y excretados de promastigotes de L. infanfum (ES2260440T3) ,
cuya comercialización ha sido autorizada por la Comisión Europea en toda la Unión Europea el 14 de marzo de 2.011.
De hecho, el desarrollo de vacunas frente a enfermedades parasitarias, no sólo frente a leishmaniosis, tiene que superar grandes obstáculos debido a distintos motivos. Entre ellos, se pueden mencionar los siguientes: se trata de infecciones que tienden a convertirse en crónicas dependiendo del estado inmunitario del hospedador y de' la especie de parásito implicada; los parásitos despliegan una enorme variedad de mecanismos de evasión de la respuesta inmunológica; y la locallización intracelular del parásito muchas veces dificulta el grado de efectividad de las respuestas efectoras por parte del hospedador.
Existe, por tanto, la necesidad de seguir trabajando en el desarrollo de nuevas estrategias de vacunación enfocadas hacia el ámbito mediterráneo de distribución de L. infanfum. Se trata de inducir un equilibrio adecuado entre las respuestas inmunitarias Leishmania-específicas de tipo celular y humoral,
asi como la generación de células de memoria efectivas frente a posibles reinfecciones. Entre las diversas metodologías de inmunización, la vacunación genética (vacunas de tercera generación) es una de la más eficientes. Es capaz de inducir la síntesis de la proteína que codifica y de generar una respuesta inmunitaria específica en el hospedador de larga duración y, además, no genera reacciones adversas en el sitio de inoculación,
a diferencia de las administraciones proteicas. Otra alternativa de gran interés que se ha empezado a analizar re~cientemente es la vacunación basada en CD para inducir respuestas inmunitarias protectivas frente a leishmaniosis.
Muchas de estas estrategias se basan en la transferencia adoptiva en ratones BALB/c de CD cargadas con antige, nos leishmaniales. Otra alternativa que ha demostrado su eficacia es el empleo de diversos vehículos vacunales recombinantes de carácter atenuado o no patogénico en seres humanos; por ejemplo, Salmonefla atenuada frente a LC o una especie recombinante de Le;shman;a no patogénica en seres humanos en la que se había integrado el
antígeno A2 de L. donovani (Costa CH, Peters NC, Maruyama SR, de Brito EC Jr, Santos IK. Vaccines for the leishmaniases: proposals for a research
agenda. PLoS Ne91 Trap Dis. 2011 Mar 29;5 (3) :e943.) .
En el proceso de infección, diversos componentes parasitarios de Leishmania pueden desencadenar una respuesta inmunológica como determinantes de superficie o como determinantes intracelulares. Los primeros consiguen ser
invisibles para el sistema inmunológico del hospedador para establecer la infección. Los determinantes intracelulares, inicialmente, tampoco son visibles para el sistema inmunitario, y así, logran entrar en el hospedador, sin embargo, quedan expuestos en el momento en el que se produce la lisis de los parásitos. Estos determinantes están muy conservados a lo largo de la evolución y contienen epitopos e:gt;peclficos de células T y células B. Su localización intracelular les hace inaccesibles a los anticuerpos producidos y, además, generan un fenotipo virulento causante de patologla, por lo que se denominan quot;patoantígenosquot; (Chanq KP, Reed SG, McGwire BS, Soon9 L. Le;shmania model for microbial virulence: the relevance of parasite multiplication and pathoantigenicity. Acta Trop. 2003 Mar;85 (3) :375-90.)
Existe una necesidad urgente de desarrollar estrategias de vacunación genética o bien empleando CD o usando bacterias vivas atenuadas como vehiculo vacunal, que se constituyan como herramientas potenciales de primer orden en la lucha contra las diferentes formas de leishmaniosis.
DESCRIPCIÚN DE LA INVENCIÚN
La invención se enfrenta con el problema de desarrollar nuevos elementos y
estrategias con los que elaborar vacunas capaces de conferir protección frente a la infección causada por LEúshmania spp.
La solución proporcionada por esta invención se basa en una quimera,
HISA70, que se puede insertar en un plásmido de expresión eucariota o en un plásmido de expresión proGariota, y cuya administración confiere protección...
Reivindicaciones:
SEQIO NO: 2 25 Secuencia artificial, protelna: nucleótidos del 7 al 4095 de SEa ID NO: 1
1. Quimera multicomponente que comprende una secuencia con, al menos,
un 75% de identidad con SEO ID NO: 1.
2. Quimera multicomponente según la reivindicación 1 en que la secuencia es SEO ID NO: 1.
3. Ouimera multicomponente según cualquiera de las reivindicaciones 1-2 en que los genes comprendidos en la secuencia están en fase.
4. Ouimera multicomponente según cualquiera de las reivindicaciones 1-3 en
que los genes proceden de Leishmtmia spp.
5. Quimera multicomponente segün la reivindicación 4 en que los genes proceden de Leishmania infanlum.
6. Quimera multicomponente segün cualquiera de las reivindicaciones 1-5
que incluye entre 1 y 7 tripletes que codifican glicina, localizados al principio y/o al final de la quimera, y/o al inicio de cada gen.
7. Quimera multicomponente según la reivindicación 6 en que el número de tripletes que codifican glicina que seo incluyen es de 4.
8. Plásmido de expresión eucariota o de expresión procariota que comprende la quimera de las reivindicaciones 1-7.
9. Proteína quimérica que comprende una secuencia con, al menos, un 85% 30 de identidad con SEO ID NO: 2.
10. Proteina quimérica según la reivindicación 9 en que la secuencia es SEO
IDNO: 2.
. Proteína quimérica según la reivindicación 10 que incluye entre 1 y 7
glicinas al principio y/o al final de la proteína quimérica, y/o al inicio del
péptido resultante de la traducción de cada gen.
12. Composición inmunogénica que comprende la quimera de las reivindicaciones 1-7 o el plásmido de la reivindicación 8 o la proteína quimérica de las reivindicaciones 9-·11 .
13. Uso de la composición inmunogénica de la reivindicación 12 en la elaboración de una vacuna para su administración a un mamífero para conferirle protección frente a enfermedades causadas por Leishmania spp.
14. Uso según la reivindicación 13 en que la especie de Leishmania es L. infantum o L. major.
15. Uso según cualquiera de las reivindicaciones 13-14 en que la enfermedad
causada por Leishmania es leishmaniosis visceral o leishmaniosis cutánea.
16. Uso según cualquiera de las quot;, ivindicaciones 13-15 en que el mamifero es el perro o el hombre.
Patentes similares o relacionadas:
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Cadena alfa del receptor de IgE de alta afinidad de fusión Fc, del 13 de Mayo de 2020, de KISSEI PHARMACEUTICAL CO., LTD.: Una proteína de fusión Fc que comprende: (i) una cadena α del receptor de IgE de alta afinidad; y (ii) la región Fc de IgG1, en donde la región del fragmento […]
Construcción de nuevas variantes de dextransacarasa DSR-S por ingeniería genética, del 6 de Mayo de 2020, de CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE: 1. Una dextransacarasa que consiste en una secuencia que tiene el 90 %, el 95 % o el 98 % de similitud de secuencia con una secuencia de aminoácidos seleccionada del fragmento […]
Receptores de antígeno quimérico dirigidos a antígeno de maduración de células B, del 6 de Mayo de 2020, de PFIZER INC.: Un receptor de antígeno quimérico específico de antígeno de maduración de células B (BCMA) (CAR) que comprende un dominio de unión a ligando extracelular, […]
Procedimiento para diagnosticar cáncer y kit de diagnóstico a través de la medición de actividad de células NK, del 6 de Mayo de 2020, de NKMAX Co., Ltd: Un procedimiento para medir la actividad de los linfocitos citolíticos naturales (NK), que comprende: estimular las células NK en una muestra de sangre entera incubando […]
Proteínas de fusión para la inhibición de angiogénesis, del 29 de Abril de 2020, de Allgenesis Biotherapeutics Inc: Una proteína de fusión que comprende: un péptido de unión a integrina que comprende unión de desintegrina a integrina αvβx […]