UNA PROTEINA IMPLICADA EN EL CANCER DE OVARIO.
Un anticuerpo anti-CDCP1 o fragmento de éste de unión a epítopo,
para usarse en el tratamiento y/o profilaxis del cáncer de ovario o el cribado de y/o diagnóstico o pronóstico del cáncer de ovario
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2004/004502.
Solicitante: UCB PHARMA, S.A..
Nacionalidad solicitante: Bélgica.
Dirección: ALLEE DE LA RECHERCHE 60,1070 BRUSSELS.
Inventor/es: BURGESS,NICOLA ANNE,CELLTECH R & D LIMITED.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61K38/17A2
- C07K16/30P
Clasificación PCT:
- A61K39/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53).
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
Clasificación antigua:
- A61P35/00 A61P […] › Agentes antineoplásicos.
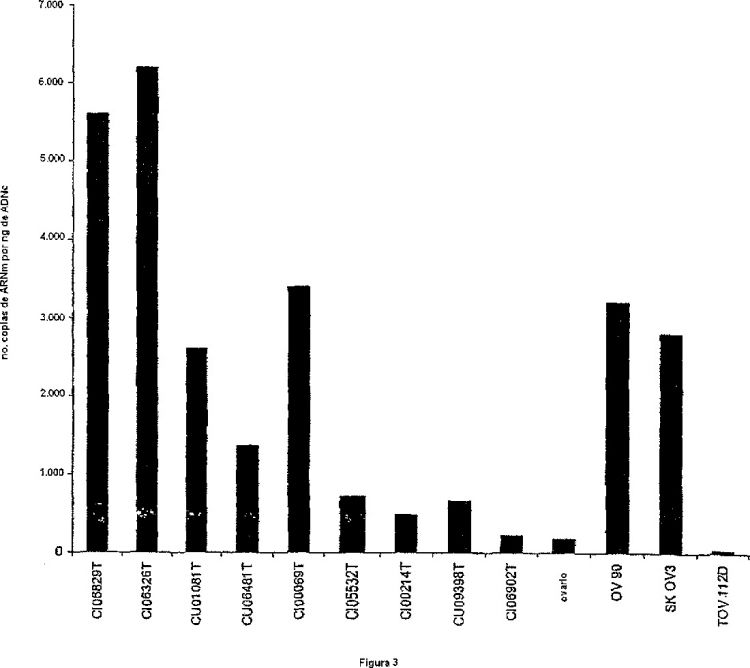
Fragmento de la descripción:
Una proteína implicada en el cáncer de ovario.
La presente invención se refiere a agentes tales como anticuerpos para el tratamiento y/o profilaxis del cáncer de ovario que comprende tomar como diana el polipéptido CDCP1, tales como inhibidores de la actividad del polipéptido, a métodos para la identificación de los mismos y al uso de CDCP1 en el tratamiento y/o diagnóstico del cáncer de ovario.
El cáncer de ovario es el más mortal de los cánceres ginecológicos presentando inicialmente aproximadamente el 70% de los que padecen el cáncer de ovario epitelial más común la enfermedad en estadio tardío en el que el cáncer puede haberse diseminado desde los ovarios a otros órganos pélvicos y abdominales o nódulos linfáticos en la pelvis, ingle o abdomen (Estadio III) o se ha diseminado hacia fuera al hígado o fuera del abdomen, lo más común hacia el recubrimiento que está alrededor de los pulmones. La proporción de supervivencia de dichos pacientes se reduce significativamente comparada con aquellos que presentan la enfermedad en un estadio más temprano. El cáncer de ovario se ha tratado generalmente con quimioterapia basada en cisplatino y a menudo recurre debido a resistencia adquirida al cisplatino (Yahata, H. et al., 2002, J. Cancer Res. Clin. Oncol. 128:621-6), de ahí la necesidad de nuevos fármacos y nuevas dianas terapéuticas. También existe una necesidad de nuevos marcadores del cáncer de ovario ya que los marcadores actuales carecen de la sensibilidad y especificidad adecuadas para ser aplicables a grandes poblaciones (Rai, A. et al., 2002, Arch. PathoL Lab. Med. 126:1518-26).
Así, existen necesidades importantes de nuevos agentes terapéuticos para el tratamiento del cáncer de ovario. Además, existe una necesidad clara de identificar nuevas proteínas asociadas al cáncer de ovario para usarlas como biomarcadores sensibles y específicos para el diagnóstico del cáncer de ovario en sujetos vivos.
Un ácido nucleico que codifica un polipéptido que comparte 834 aminoácidos de los 836 aminoácidos con CDCP1 se describe en WO 02/70539, US2002/0142003 y WO 02/04508, de los que los dos últimos describen una implicación potencial de ese polipéptido en los cánceres de pulmón y colon.
La presente invención se basa en el descubrimiento de que CDCP I representa una diana terapéutica nueva para el tratamiento y/o profilaxis del cáncer de ovario.
De acuerdo con esto, la invención proporciona un anticuerpo anti-CDCP1 o fragmento de éste funcionalmente activo, para el tratamiento y/o profilaxis del cáncer de ovario o el cribado y/o diagnóstico o pronóstico del cáncer de ovario.
En un aspecto adicional, la invención proporciona un polipéptido CDCP1 para el tratamiento y/o profilaxis del cáncer de ovario.
El término "polipéptidos" incluye péptidos, polipéptidos y proteínas. Estos términos se utilizan de modo intercambiable, a menos que se indique lo contrario.
Así, la invención también proporciona el uso de un anticuerpo, que interacciona con o modula la expresión o actividad de un polipéptido CDCP1 para la fabricación de un medicamento para el tratamiento y/o profilaxis del cáncer de ovario.
Lo más preferiblemente, el agente para usarse en el tratamiento y/o profilaxis del cáncer de ovario es un anticuerpo que interacciona con (es decir, se une a o reconoce) o modula la actividad de un polipéptido CDCP1. De acuerdo con esto, se proporciona el uso de un anticuerpo que interacciona con un polipéptido CDCP1 para usarse en la fabricación de un medicamento para usarse en el tratamiento y/o profilaxis del cáncer de ovario. También se proporciona un método de tratamiento y/o profilaxis del cáncer de ovario en un sujeto, que comprende administrar a dicho sujeto una cantidad terapéuticamente eficaz de un anticuerpo que interacciona con CDCP1. En una realización, puede usarse un anticuerpo que interacciona con un polipéptido CDCP1 para mediar la citotoxicidad celular dependiente de anticuerpo (ADCC) y la citotoxicidad dependiente del complemento (CDC). En dicho caso, el anticuerpo es preferiblemente un anticuerpo desnudo de longitud completa. En otro aspecto de la invención, puede usarse un anticuerpo que interacciona con polipéptidos CDCP1 para inhibir la actividad de dichos polipéptidos.
Los anticuerpos más preferidos son anticuerpos que interaccionan específicamente con un polipéptido CDCP1. Interaccionar (por ejemplo, reconocer o unirse) específicamente significa que los anticuerpos tienen una mayor afinidad por los polipéptidos CDCP1 que por otros polipéptidos.
Puede usarse un anticuerpo, conjugado opcionalmente con un resto terapéutico, terapéuticamente solo o en combinación con uno o más factores citotóxicos y/o citoquina(s). En particular, los anticuerpos CDCP1 pueden conjugarse con un agente terapéutico, tal como un agente citotóxico, un radionúclido o resto de fármaco para modificar una respuesta biológica dada. El agente terapéutico no debe interpretarse limitado a los agentes químicos terapéuticos clásicos. Por ejemplo, el agente terapéutico puede ser un resto de fármaco que puede ser una proteína o polipéptido que posea una actividad biológica deseada. Estos restos pueden incluir, por ejemplo y sin limitación, una toxina, tal como abrina, ricina A, la exotoxina de Pseudomonas o la toxina de la difteria, una proteína, tal como el factor de necrosis tumoral, a-interferón, ß-interferón, el factor del crecimiento nervioso, el factor del crecimiento derivado de plaquetas o el activador del plasminógeno tisular, un agente trombótico o un agente antiangiogénico, por ejemplo, angiostatina o endostatina, o un modificador de la respuesta biológica, tal como una linfoquina, interleuquina-1 (IL-1), interleuquina-2 (IL-2), interleuquina-6 (IL-6), el factor estimulante de colonias de macrófagos granulocitos (GM-CSF), el factor estimulante de colonias de granulocitos (G-CSF), el factor del crecimiento nervioso (NGF) u otro factor del crecimiento.
Los agentes terapéuticos también incluyen citotoxinas o agentes citotóxicos incluyendo cualquier agente que es perjudicial para (p. ej. mata) las células. Los ejemplos incluyen taxol, citocalasina B, gramicidina D, bromuro de etidio, emetina, mitomicina, etopósido, tenopósido, vincristina, vinblastina, colchicina, doxorrubicina, daunorrubicina, dihidroxiantracindiona, mitoxantrona, mitramicina, actinomicina D, 1-deshidrotestosterona, glucocorticoides, procaína, tetracaína, lidocaína, propranolol, y puromicina y sus análogos u homólogos. Los agentes terapéuticos también incluyen, pero no se limitan a antimetabolitos (por ejemplo, metotrexato, 6-mercaptopurina, 6-tioguanina, citarabina, 5-fluorouracil descarbazina), agentes alquilantes (por ejemplo, mecloretamina, tioepa cloranbucilo, melfalano, carmustina (BSNU) y lomustina (CCNU), ciclotosfamida, busulfano, dibromomanitol, estreptozotocina, mitomicina C, y cis-diclorodiamina-platino (II) (DDP), cisplatino), antraciclinas (por ejemplo, daunorrubicina (antes denominada daunomicina) y doxorrubicina), antibióticos (por ejemplo, dactinomicina (antes denominada actinomicina), bleomicina, mitramicina, antramicina (AMC), caliqueamicinas o duocarmicinas), y agentes antimitóticos (por ejemplo, vincristina y vinblastina).
Otros restos terapéuticos pueden incluir radionúclidos tales como 111In y 90Y, Lu177, Bismuto213, Californio252, Iridio192 y Tungsteno188/Renio188; o fármacos, tales como, pero sin limitarse a alquilfosfocolinas, inhibidores de la topoisomerasa I, taxoides y suramina.
Las técnicas para conjugar dichos agentes terapéuticos con anticuerpos son muy conocidas en la técnica (véase, p. ej., Amon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", en Monoclonal Antibodies And Cancer Therapy, Reisfeld et al., eds., 1985 p. 243-56, ed. Alan R. Liss, Inc; Hellstrom et al., "Antibodies For Drug Delivery", en Controlled Drug Delivery, 2a Ed., Robinson et al., eds., 1987, p. 623-53, Marcel Dekker, Inc.; Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", en Monoclonal Antibodies '84: Biological And Clinical Applications; Pinchera et al., 1985, eds., p. 475-506; "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabelled Antibody In Cancer Therapy", en Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al. (eds.), 1985, p. 303-16, Academic Press; Thorpe et al., 1982 "The Preparation And Cytotoxic Properties Of Antibody-Toxin...
Reivindicaciones:
1. Un anticuerpo anti-CDCP1 o fragmento de éste de unión a epítopo, para usarse en el tratamiento y/o profilaxis del cáncer de ovario o el cribado de y/o diagnóstico o pronóstico del cáncer de ovario.
2. Un anticuerpo según la reivindicación 1 ó 2 en el que CDCP1:
3. Un anticuerpo según la reivindicación 1 ó 2 para el cribado de y/o diagnóstico o pronóstico del cáncer de ovario.
4. Un anticuerpo según la reivindicación 3, en el que el anticuerpo es monoclonal.
5. Un anticuerpo según la reivindicación 3 ó 4, acoplado a un marcador detectable o a un segundo anticuerpo.
6. Un anticuerpo según la reivindicación 1 ó 2, en el que el anticuerpo es monoclonal, policlonal, quimérico, humanizado o biespecífico.
7. Un anticuerpo según una cualquiera de las reivindicaciones 1, 2, ó 6, en el que el anticuerpo está conjugado con un resto terapéutico, marcador detectable, segundo anticuerpo o un fragmento de éste, una molécula efectora o informadora, un agente citotóxico o citoquina, o está fusionado a través de un enlace covalente a una proteína.
8. Un anticuerpo según una cualquiera de las reivindicaciones 1, 2, 6 ó 7, en el que dicho anticuerpo es un inhibidor de la actividad del polipéptido CDCP1.
9. Un anticuerpo según una cualquiera de las reivindicaciones 1, 2, 6, 7 u 8, en el que el fragmento del anticuerpo se modifica uniendo una molécula de polímero seleccionada de poli(etilenglicol) o metoxipoli(etilenglicol).
10. Una composición farmacéutica adecuada para administración parenteral que comprende un anticuerpo como se ha definido en una cualquiera de las reivindicaciones 1, 2, 6 a 9, para usarse en el tratamiento y/o profilaxis del cáncer de ovario.
11. Polipéptido CDCP1 para usarse en el tratamiento y/o profilaxis del cáncer de ovario.
12. El uso según la reivindicación 11, en el que el polipéptido CDCP1:
13. Una composición farmacéutica que comprende un polipéptido como se ha definido en la reivindicación 11 ó 12 para usarse en el tratamiento y/o profilaxis del cáncer de ovario.
14. Una composición farmacéutica para usarse según la reivindicación 13, en la que la composición es una composición de vacuna.
15. Un método de cribado para un agente anti-cáncer de ovario, en el que dicho agente es un anticuerpo o un fragmento de éste de unión a epítopo comprendiendo dicho método:
16. El método según la reivindicación 15, en el que la etapa b) comprende la detección cuantitativa de la unión.
17. Un método de cribado para un agente anti-cáncer de ovario, en el que dicho agente comprende un anticuerpo o un fragmento de éste de unión a epítopo, comprendiendo dicho método:
18. El método según la reivindicación 17, en el que la expresión o actividad de dicho polipéptido se compara con un intervalo de referencia predeterminado.
19. Un método de cribado y/o diagnóstico o pronóstico del cáncer de ovario en un sujeto, y/o monitorización de la eficacia de la terapia del cáncer de ovario, que comprende la etapa de detectar y/o cuantificar en una muestra biológica obtenida de dicho sujeto, la expresión de un polipéptido CDCP1.
20. El método según la reivindicación 19, en el que la expresión de dicho polipéptido se compara con un intervalo de referencia determinado previamente o control.
21. El método según la reivindicación 19 ó 20, en el que la etapa de detectar comprende:
22. El método según la reivindicación 21, en el que la etapa (b) comprende detectar el polipéptido capturado usando un reactivo de detección marcado directamente o indirectamente.
23. El método según la reivindicación 21 ó 22, en el que el anticuerpo se inmoviliza en una fase sólida.
24. El método según una cualquiera de las reivindicaciones 19 a 23, en el que el polipéptido se detecta y/o cuantifica usando un anticuerpo que se une específicamente a un polipéptido CDCP1.
25. El método según la reivindicación 24, en el que el anticuerpo se conjuga con un marcador detectable, o un segundo anticuerpo o un fragmento de éste.
26. Un kit de diagnóstico adecuado para el cribado, diagnóstico, pronóstico y/o monitorización terapéutica del cáncer de ovario, comprendiendo dicho kit un anticuerpo específico para un polipéptido CDCP1, reactivos e instrucciones de uso.
Patentes similares o relacionadas:
COMPOSICIÓN PARA EL TRATAMIENTO DEL DOLOR Y/O LA INFLAMACIÓN, del 22 de Febrero de 2012, de BCN PEPTIDES, S.A. DIVERDRUGS, S.L: Composiciones para el tratamiento del dolor y/o la inflamación que comprenden al menos un péptido de fórmula general (I)R1-AA-R2(I)sus estereoisómeros, […]
ENTRENAMIENTO COGNITIVO AUMENTADO, del 6 de Febrero de 2012, de COLD SPRING HARBOR LABORATORY: Un agente de aumento de CREB para su uso en un procedimiento para tratar pérdida de función cognitiva del procedimiento dependiente de traumatismo, […]
MÉTODOS Y COMPUESTOS PARA TRATAR LA DIABETES, del 9 de Diciembre de 2011, de BIOCRINE AB: Uso de una cantidad eficaz del tetrámero de transtiretina para la fabricación de un medicamento para tratar la diabetes de tipo I o para prevenir la […]
USO DE LA PROTEÍNA RGS-14 PARA POTENCIAR LA MEMORIA, del 15 de Septiembre de 2011, de UNIVERSIDAD DE MALAGA: Uso de la proteína RGS-14 para potenciar la memoria.La administración de la proteína RGS-14, también conocida como regulador de la proteína-G señalizadora 14, en cerebro provoca […]
USO DE UN GEN ASOCIADO A LA DIFERENCIACIÓN DEL MELANOMA (MDA-7) PARA INVERTIR UN FENOTIPO CANCEROSO, del 5 de Septiembre de 2011, de THE TRUSTEES OF COLUMBIA UNIVERSITY IN THE CITY OF NEW YORK: Uso de un ácido nucleico que comprende un gen asociado a la diferenciación del melanoma (mda-7) para la preparación de una composición farmacéutica para […]
DETERMINANTES MOLECULARES DE LA OSTEOPATÍA POR MIELOMA Y USO DE LOS MISMOS, del 11 de Julio de 2011, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ARKANSAS: Método ex vivo para determinar el potencial de desarrollar una osteopatía lítica en un paciente con mieloma múltiple, comprendiendo el método la etapa […]
TRATAMIENTO DE LA INSUFICIENCIA RENAL AGUDA CON TROMBOMODULINA SOLUBLE, del 7 de Junio de 2011, de ELI LILLY AND COMPANY INDIANA UNIVERSITY RESEARCH AND TECHNOLOGY CORPORATION: Trombomodulina soluble para usar en el tratamiento de un sujeto humano que tiene insuficiencia renal aguda, en el que dicha trombomodulina soluble […]
COMPLEJOS DE CASEÍNA, del 10 de Mayo de 2011, de DSM IP ASSETS B.V.: Un complejo que comprende (i) un compuesto abarcado por la fórmula general en donde A significa un enlace sencillo o doble de carbono-carbono, pudiendo estar este […]