PROCESO PARA LA PURIFICACION DE PROTEINAS EN UNA FRACCION DE FLUJO-DIRECTO DE CROMATOGRAFIA DE INTERACCION HIDROFOBICA.
Un proceso para separar una proteína diana a partir de una mezcla que contiene la proteína diana y los contaminantes,
que comprende:
a) el contacto de la mezcla con un adsorbente hidrofóbico que comprende grupos funcionales hidrocarburo ramificados en una solución acuosa de sal a un pH de al menos 5.5, en condiciones que permiten que los contaminantes se unan al adsorbente y que la proteína diana pase a través del adsorbente en una fracción flujo directo sin unirse al adsorbente hidrofóbico; y
b) la recolección de la fracción flujo directo de la mezcla que contiene la proteína diana que no se une al adsorbente hidrofóbico
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/035007.
Solicitante: AMGEN INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE AMGEN CENTER DRIVE,THOUSAND OAKS, CA 91320-1799.
Inventor/es: SHUKLA,ABHINAV,A, GHOSE,SANCHAYITA.
Fecha de Publicación: .
Fecha Concesión Europea: 31 de Marzo de 2010.
Clasificación Internacional de Patentes:
- C07K1/20 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 1/00 Procedimientos generales de preparación de péptidos. › Cromatografía de partición, fase inversa o hidrófoba.
- C07K14/00 C07K […] › Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
Clasificación PCT:
- C07K14/00 C07K […] › Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados.
- C12P21/06 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › preparados por hidrólisis de un enlace peptídico, p. ej. hidrolizados.
Clasificación antigua:
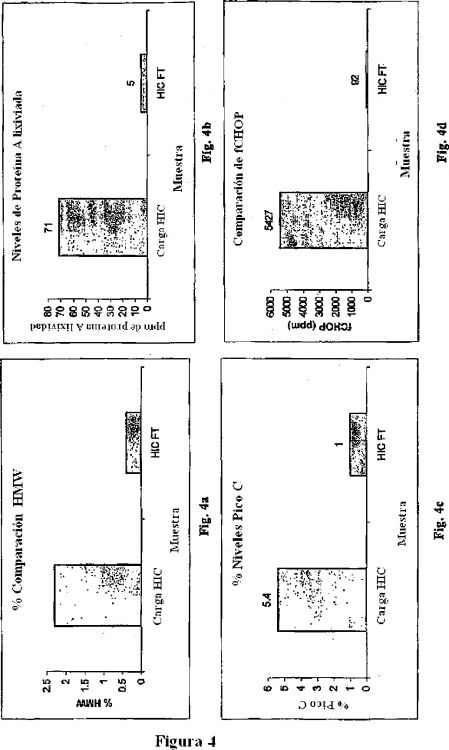
Fragmento de la descripción:
Proceso para la purificación de proteínas en una fracción de flujo-directo de cromatografía de interacción hidrofóbica.
Campo técnico
La presente invención se relaciona con la purificación de proteínas utilizando la cromatografía de interacción hidrofóbica.
Antecedentes
La cromatografía de interacción hidrofóbica (HIC), es un método de separación de proteínas basado en la fuerza de sus interacciones hidrofóbicas relativas con un adsorbente hidrofóbico. La hidrofobicidad generalmente se define como la repulsión entre un compuesto no-polar y un ambiente polar, tal como el agua.
Las "interacciones" hidrofóbicas son esencialmente la tendencia de un ambiente polar a excluir los compuestos no-polares (i.e., hidrofóbicos) del ambiente polar y la fuerza de agregación del hidrófobo entre ellos mismos. El fenómeno de las interacciones hidrofóbicas se aplica a la separación de proteínas, mediante el uso de una solución acuosa de sal, para forzar una proteína hidrofóbica en una muestra a agregarse con o unirse adsortivamente a los grupos funcionales hidrofóbicos (el adsorbente) fijados a un soporte sólido. Las proteínas adsorbidas se liberan del adsorbente mediante la elución con menores concentraciones de sal, invirtiendo el ambiente que promueve las interacciones hidrofóbicas, lo que conduce a la pérdida de interacciones hidrofóbicas entre las proteínas y el soporte y la liberación de la proteína del soporte con el fin de aumentar la hidrofobicidad (con las proteínas hidrofóbicas menos considerables siendo liberadas primero).
Las proteínas recombinantes, por lo general contienen una variedad de impurezas que necesitan que se eliminen antes de que el producto sea farmacéuticamente aceptable. Algunas de estas impurezas pueden incluir proteínas de células huésped (HCPs) a partir del sistema de célula huésped en el cual se expresan. Para un sistema CHO, estas impurezas se denominan como Proteínas de Células Huésped CHO (CHOP). Además a estas impurezas, la proteína según se expresa durante el cultivo celular, también puede contener formas variantes de la proteína del producto, por ejemplo, una forma plegada incorrectamente de la proteína diana. Otras impurezas se pueden adicionar al flujo del producto o generar como un resultado del proceso de purificación, tal como agregados de peso molecular más alto de la proteína o la Proteína A lixiviada. Estas impurezas tienen un amplio rango de retenciones en diferentes tipos de cromatografía y la eliminación de dicho amplio espectro de impurezas es difícil, por lo general se necesitan múltiples etapas que involucran diferentes tipos de cromatografía.
La HIC se puede utilizar para separar proteínas empleando dos diferentes metodologías. En la primera metodología de HIC, denominada como el modo de "enlace y eluido", la mezcla que contiene la proteína diana se pone en contacto con el adsorbente hidrofóbico bajo condiciones donde la proteína diana se une al adsorbente, mientras que los contaminantes (o la mayor cantidad de contaminantes como sea posible) no se unen y fluyen completamente. En el modo "enlace y eluido", la proteína se puede recuperar aplicando al complejo proteína/adsorbente una concentración de sal aplicada en un gradiente gradual o reducido de manera escalonada, para liberar selectivamente las diferentes proteínas unidas y los contaminantes y recolectando las fracciones discretas hasta que se obtiene la fracción que contiene la proteína más purificada. En un proceso donde una proteína diana se une a la columna (mientras se permite que los contaminantes fluyan completamente), los adsorbentes que tienen mayor hidrofobicidad se utilizan generalmente para unir un amplio rango de proteínas que serán recolectadas en una fracción específica, se liberan a una concentración de sal en el curso de la aplicación del gradiente de sal. En la segunda metodología de HIC, se denomina como el modo "flujo directo", la mezcla que contiene la proteína diana se pone en contacto con el adsorbente hidrofóbico donde los contaminantes (o la mayor cantidad de contaminantes como sea posible) se unen al adsorbente, mientras que la proteína diana (y tan pocos contaminantes como sea posible) no se unen y fluyen completamente. En este modo, el uso de adsorbentes menos hidrofóbicos, tales como aquellos que tienen grupos alquilo de menor peso molecular, se prefieren, dado que una menor capacidad de enlace se necesita para las condiciones bajo las cuales la proteína diana no se une. Como se debería esperar, sin embargo, el uso de HIC en el modo flujo directo, ha sido de utilidad limitada debido a que las condiciones necesarias para permitir que la proteína diana fluya completamente, intrínsecamente resultan en una menor capacidad de enlace, lo que conduce a una eliminación temprana de la proteína diana, o a la eliminación de la proteína diana junto con los contaminantes.
Mientras que diferentes modalidades de cromatografía se pueden emplear para eliminar una clase particular de impurezas, muy pocas etapas cromatográficas son capaces de eliminar todas estas impurezas a partir de un producto. De esta manera, existe la necesidad de un proceso de purificación que se pueda emplear genéricamente para la eliminación de estas impurezas de una proteína recombinante.
Divulgación de la invención
De acuerdo con la presente invención, se ha descubierto que la cromatografía de interacción hidrofóbica utilizando un adsorbente hidrofóbico que comprende grupos funcionales hidrocarburo ramificados, tales como grupos alquilo ramificados, es altamente selectiva en el enlace de los contaminantes de proteína, mientras que la proteína diana no se une, permitiendo así que la proteína diana se recupere en la fracción flujo directo. El uso de HIC en flujo directo se ha encontrado que es sorprendentemente eficiente, dando lugar a una significantemente mayor recuperación de la proteína diana en una única etapa, de esta manera, simplificando y mejorando la eficiencia y el costo del proceso de purificación de proteínas.
La presente invención incluye un proceso para separar una proteína diana (tal como una proteína recombinante producida en un cultivo celular) a partir de una mezcla que contiene la proteína diana y los contaminantes que comprenden: el contacto de la mezcla con un adsorbente hidrofóbico que comprende grupos funcionales de hidrocarburos ramificados en una solución acuosa de sal, y la recolección de la porción de la mezcla que no se une al adsorbente hidrofóbico, que contiene la proteína diana.
Una modalidad de la presente invención incluye un proceso para separar una proteína diana de una mezcla que contiene la proteína diana y los contaminantes, que comprende:
a) el contacto de la mezcla con un adsorbente hidrofóbico que comprende grupos funcionales hidrocarburo ramificados en una solución acuosa de sal a un pH de al menos 5.5, bajo condiciones que permiten que los contaminantes se unan al adsorbente y la proteína diana pase a través del adsorbente en una fracción flujo directo sin unirse al adsorbente hidrofóbico; y
b) la recolección de la fracción flujo directo de la mezcla que contiene la proteína diana que no se une al adsorbente hidrofóbico.
En otra modalidad, la presente invención incluye un proceso para la separación de una proteína recombinante, producida como un producto de la expresión de cultivo celular en una célula huésped, a partir de una mezcla que contiene la proteína y los contaminantes del cultivo celular que comprende: el contacto de la mezcla con un adsorbente hidrofóbico que comprende grupos funcionales hidrocarburo ramificados en una solución acuosa de sal, y la recolección de la porción de la mezcla que no se une al adsorbente hidrofóbico, la cual contiene la proteína diana.
En otra modalidad, la presente invención incluye un proceso para separar una proteína de fusión FC recombinante, producida como un producto de la expresión del cultivo celular en una célula huésped, a partir de una mezcla que contiene la proteína y los contaminantes del cultivo celular, que comprende: el contacto de la mezcla con un adsorbente hidrofóbico que comprende grupos hidrocarburo ramificados en una solución acuosa de sal, y la recolección de la porción de la mezcla que no se une al adsorbente hidrofóbico, la cual contiene la proteína diana.
En incluso otra modalidad, la presente invención incluye un proceso de separación de una proteína diana recombinante, producida como un producto de la expresión de cultivo celular en una célula huésped, a partir de una mezcla que contiene...
Reivindicaciones:
1. Un proceso para separar una proteína diana a partir de una mezcla que contiene la proteína diana y los contaminantes, que comprende:
a) el contacto de la mezcla con un adsorbente hidrofóbico que comprende grupos funcionales hidrocarburo ramificados en una solución acuosa de sal a un pH de al menos 5.5, en condiciones que permiten que los contaminantes se unan al adsorbente y que la proteína diana pase a través del adsorbente en una fracción flujo directo sin unirse al adsorbente hidrofóbico; y
b) la recolección de la fracción flujo directo de la mezcla que contiene la proteína diana que no se une al adsorbente hidrofóbico.
2. El proceso de la reivindicación 1, en donde la proteína diana es una proteína diana recombinante, producida como un producto de la expresión del cultivo celular en una célula huésped.
3. El proceso de la reivindicación 2, en donde la proteína diana recombinante es una proteína diana de fusión FC recombinante.
4. El proceso de cualquiera de las reivindicaciones 1-3, en donde la proteína diana es una proteína diana recombinante, y en donde dichos contaminantes comprenden contaminantes del cultivo celular producidos por la expresión del cultivo celular de la proteína recombinante en una célula huésped de Ovario de Hámster Chino.
5. El proceso de la reivindicación 1, para la separación de una proteína diana recombinante, producida como un producto de la expresión del cultivo celular en una célula huésped, a partir de una mezcla que contiene una proteína diana y los contaminantes, que además comprende, antes de la etapa (a) las etapas:
i) preparación de una columna de cromatografía que tiene un soporte que comprende los grupos funcionales alquilo ramificados hidrofóbicos, en donde los grupos funcionales alquilo ramificados tienen de 4 a 8 átomos de carbono, uno de los cuales al menos es un átomo de carbono terciario.
ii) preparación de la mezcla en una solución acuosa a un pH de al menso 5.5 que tiene a una concentración de sal tal que los contaminantes se unan a la columna mientras que la proteína diana en la mezcla no se une a la columna;
en donde la etapa (a) comprende el contacto de la mezcla con la columna bajo dichas condiciones; y
en donde la etapa (b) comprende la recolección de la columna de la fracción flujo directo de la mezcla que contiene la proteína diana que no se une a la columna.
6. El proceso de cualquiera de las reivindicaciones 1-4 para eliminar la proteína A, a partir de una mezcla que contiene la proteína diana y la Proteína A, en donde dichos contaminantes comprenden dicha Proteína A.
7. El proceso de cualquiera de las reivindicaciones 1-4 para eliminar una variante plegada incorrectamente de una proteína diana recombinante a partir de una mezcla que contiene una combinación de variantes plegadas correctamente y variantes plegadas incorrectamente de la proteína diana, en donde dichos contaminantes comprenden la citada variante plegada incorrectamente de la proteína diana, y en donde en la etapa (b) del proceso de la fracción flujo directo de la mezcla contiene una variante plegada correctamente de la proteína diana que no se une al adsorbente hidrofóbico.
8. El proceso de cualquiera de las reivindicaciones 1-4 para eliminar las formas agregadas de una proteína diana recombinante a partir de una mezcla que contiene formas individuales y formas de agregados de la proteína diana, en donde dichos contaminantes comprenden las citadas formas de agregados de la proteína diana, y en donde en la etapa (b) del proceso la fracción flujo directo de la mezcla contiene una forma individual de la proteína diana que no se une al adsorbente hidrofóbico.
9. El proceso de cualquiera de las reivindicaciones 1-4 y 6-8, en donde el adsorbente hidrofóbico comprende un grupo funcional alquilo ramificado.
10. El proceso de la reivindicación 9, en donde el grupo funcional alquilo ramificado tiene de 3 a 8 átomos de carbono.
11. El proceso de la reivindicación 10, en donde el grupo funcional alquilo ramificado comprende un átomo de carbono terciario.
12. El proceso de las reivindicaciones 5 u 11, en donde el grupo funcional alquilo ramificado es el ter-butilo.
Patentes similares o relacionadas:
Polipéptidos de unión específica novedosos y usos de los mismos, del 15 de Julio de 2020, de Pieris Pharmaceuticals GmbH: Muteína de lipocalina lagrimal humana que tiene especificidad de unión para IL-17A, en la que la muteína se une a IL-17A con una KD de aproximadamente 1 nM o menos, en la que […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Péptidos de unión beta amiloide y sus usos para el tratamiento y el diagnóstico de la demencia de Alzheimer, del 17 de Junio de 2020, de Priavoid GmbH: Péptido que contiene al menos una secuencia de aminoácidos que se une a especies beta amiloides y en el que la carga negativa del grupo carboxilo presente […]
Composiciones y métodos utilizando andamios de lisofosfatidilcolina, del 6 de Mayo de 2020, de NATIONAL UNIVERSITY OF SINGAPORE: Un método para seleccionar uno o más compuestos o ácidos grasos para determinar el transporte mediado por lisofosfatidilcolina (LPC) del uno o más compuestos o ácidos […]
Arginina desiminasa con reactividad cruzada reducida hacia anticuerpos para ADI - PEG 20 para el tratamiento del cáncer, del 6 de Mayo de 2020, de TDW Group: Una composición terapéutica que comprende una arginina desiminasa (ADI) aislada y un vehículo farmacéuticamente aceptable, en donde la ADI aislada comprende la secuencia de […]
Péptidos antimicrobianos y composiciones de los mismos, del 29 de Abril de 2020, de REVANCE THERAPEUTICS, INC: Composición farmacéutica o cosmética que comprende un péptido, en donde dicho péptido consiste en la secuencia de aminoácidos SEQ ID NO: 3 correspondiente […]
COMPOSICIÓN PARA LA ESTIMULACIÓN DEL SISTEMA INMUNE EN PECES QUE CONTIENE PÉPTIDOS RECOMBINANTES, PÉPTIDOS RECOMBINANTES INMUNOESTIMULANTES Y SECUENCIAS NUCLEOTÍDICAS QUE LOS CODIFICAN, del 23 de Abril de 2020, de UNIVERSIDAD DE CONCEPCION: La presente invención se refiere a una composición, una micropartícula y una formulación alimenticia que comprende péptidos recombinantes que estimulan el sistema inmune […]
Nuevo péptido con cuatro epítopos CTL unidos, del 15 de Abril de 2020, de TAIHO PHARMACEUTICAL CO., LTD.: Un péptido que consiste en 4 epítopos unidos, en el que los 4 péptidos de epítopo se seleccionan del grupo que consiste en los péptidos de epítopo CTL: el péptido como […]