Procedimientos para tratar carcinoma de células renales.
IL-2 para su uso en el tratamiento de un paciente humano renalmente insuficiente que tiene carcinoma de células renales,
en el que
a) una dosis de 9-18 MUI de IL-2 por día se administra subcutáneamente, en 1-3 dosis al día, durante 3-6 días a la semana, repetida durante 1-24 semanas; y
b) no se administra IL-2 durante 1-4 semanas.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/003116.
Solicitante: NOVARTIS VACCINES AND DIAGNOSTICS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: INTELLECTUAL PROPERTY - R440 P.O. BOX 8097 EMERYVILLE, CA 94662-8097 ESTADOS UNIDOS DE AMERICA.
Inventor/es: ELIAS,LAURENCE, WITHERELL,GARY.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K38/20 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Interleuquinas.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- A61P35/04 A61P […] › A61P 35/00 Agentes antineoplásicos. › específicos para la metástasis.
PDF original: ES-2432141_T3.pdf
Fragmento de la descripción:
Procedimientos para tratar carcinoma de celulas renales.
CAMPO TECNICO
La presente invencion se refiere generalmente a procedimientos para tratar carcinoma de celulas renales con IL-2. En particular, la invencion se refiere a procedimientos para tratar carcinoma de celulas renales en pacientes que son renalmente insuficientes o intolerantes a terapia con IL-2 a alta dosis.
ANTECEDENTES
La interleucina-2 (IL-2) es un potente estimulante de la proliferacion y funcion de linfocitos citoliticos espontaneos (NK) y T (Morgan y col. (1976) Science 193:1007-1011) . Se ha mostrado que estas linfocinas que se producen naturalmente tienen actividad antitumoral contra una variedad de tumores malignos tanto solas como cuando se combinan con linfocitos citoliticos activados por linfocinas (LAK) o linfocitos infiltrantes de tumores (TIL) (vease, por ejemplo, Rosenberg y col., N. Engl. J. Med. (1987) 316:889-897; Rosenberg, Ann. Surg. (1988) 208:121-135; Topalian y col., J. Clin. Oncol. (1988) 6:839-853; Rosenberg y col., N. Engl. J. Med. (1988) 319:1676-1680; y Weber y col., J. Clin. Oncol. (1992) 10:33-40) . La actividad antitumoral de IL-2 se ha descrito mejor en pacientes con melanoma metastasico y carcinoma de celulas renales usando Proleukin®, una formulacion de IL-2 comercialmente disponible de Chiron Corporation, Emer y ville, CA. Otras enfermedades, que incluyen linfoma, tambien parece que responden a tratamiento con IL-2 (Gisselbrecht y col., Blood (1994) 83:2020-2022) . Sin embargo, altas dosis de IL-2 usadas para lograr resultados terapeuticos positivos con respecto a crecimiento tumoral frecuentemente producen graves efectos secundarios, que incluyen fiebre y escalofrios, hipotension y fuga capilar (sindrome de fuga vascular
o SFV) , y cambios neurologicos (vease, por ejemplo, Duggan y col., J. Immunotherapy (1992) 12:115-122; Gisselbrecht y col., Blood (1994) 83:2081-2085; y Sznol y Parkinson, Blood (1994) 83:2020-2022) . El carcinoma de celulas renales metastasico (CCR) es generalmente resistente a quimioterapia, tanto con agentes individuales como con multiples agentes en combinacion. Se ha observado mayor exito con inmunoterapia, particularmente con el uso de IL-2. La terapia con IL-2 intravenosa a alta dosis ha producido respuestas tumorales objetivas en aproximadamente el 15% de los pacientes, algunas con durabilidad larga. Sin embargo, la administracion de IL-2 a alta dosis esta asociada a sindrome de fuga capilar, que produce hipotension y reducida perfusion de organos, que puede ser grave y algunas veces mortal. Estas toxicidades se han limitado generalmente al uso de IL-2 a un grupo altamente seleccionado de pacientes administrados por medicos con experiencia significativa en su administracion. El uso de menores dosis y pautas subcutaneamente administradas de IL-2 sola o en combinacion con otros agentes biologicos, tales como interferon-a, se ha explorado en un esfuerzo por desarrollar una terapia mas ampliamente aplicable para esta enfermedad (vease, por ejemplo, Nieken y col., Cancer Biother. Radiopharm. (1996) 11:289-295; Sleijfer y col., J. Clin. Oncol. (1992) 10:1119-1123; Lessoni y col., Anticancer Res. (2002) 22:1061-1-1064; Tourani y col., J. Clin. Oncol. (1998) 16:2505; y Schiller y col. Cancer Res. (1993) 53:1286-1292) . Sigue existiendo la necesidad de una terapia mejorada para tratar pacientes que tienen carcinoma de celulas renales que reduzca la toxicidad y mejore la eficacia terapeutica.
RESUMEN DE LA INVENCION
La presente invencion proporciona un procedimiento eficaz para tratar carcinoma de celulas renales con IL-2. El procedimiento utiliza una dosis relativamente baja de IL-2 en comparacion con dosificaciones previamente usadas en terapias con IL-2 a alta dosis con el fin de reducir la toxicidad. Como se muestra en los ejemplos en el presente documento, esta pauta terapeutica inhibe significativamente el crecimiento tumoral con efectos secundarios adversos reducidos y proporciona un tratamiento alternativo para pacientes que no pueden tolerar la terapia con IL-2 a alta dosis. El objetivo de la invencion se define en las reivindicaciones. En un aspecto, la invencion proporciona un procedimiento para tratar un paciente humano que tiene carcinoma de celulas renales. En ciertas realizaciones, el paciente es renalmente insuficiente. En ciertas realizaciones, el carcinoma de celulas renales es metastasico. En ciertas realizaciones, el paciente es intolerante a tratamiento con IL-2 a alta dosis. En otro aspecto, el procedimiento comprende: a) administrar una dosis de 9-18 MUI de IL-2 por dia, en 1-3 dosis al dia, durante 3-6 dias a la semana, repetida durante 1-24 semanas; b) no administrar IL-2 durante 1-4 semanas; c) administrar una dosis de 9 MUI de IL-2 por dia, en 1-3 dosis al dia, durante 3-6 dias a la semana, repetida durante 124 semanas; y d) no administrar IL-2 durante 1-4 semanas. En otro aspecto mas, el procedimiento comprende: a) primero, administrar una dosis de 18 MUI de IL-2 por dia durante 5 dias durante una semana; b) segundo, administrar una dosis de 9 MUI de IL-2 por dia durante 2 dias, seguido de administrar una dosis de 18 MUI de IL-2 por dia durante 3 dias durante cada semana, repetida durante 5 semanas; c) tercero, no administrar IL-2 durante 3 semanas; d) cuarto, administrar una dosis de 9 MUI de IL-2 por dia durante 5 dias de cada semana, repetida durante 6 semanas; y e) quinto, no administrar IL-2 durante 3 semanas.
En cualquiera de los procedimientos descritos en el presente documento, la IL-2 puede ser IL-2 recombinantemente producida. La IL-2 puede incluir IL-2 humana o variantes de la misma que comprenden una secuencia que tiene al menos aproximadamente el 70-100% de identidad de secuencias con la secuencia de IL-2 humana (SEC ID N°: 1) , que incluye cualquier identidad en porcentaje dentro de estos intervalos, tales como el 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100% de identidad de secuencias con la misma. En ciertas realizaciones, la IL-2 es una muteina de IL-2, por ejemplo, pero no se limita a, Ala104 Ser125 IL-2; des-Ala1 des-Pro2 des-Thr3 des-Ser4 Ala104 Ser125 IL-2; y des-Ala1 des-Pro2 des-Thr3 des-Ser4 des-Ser5 des-Ser6 IL-2. En una realizacion preferida, la muteina de IL-2 es des-alanil-1, serina-125-interleucina-2 humana (aldesleucina) .
En ciertas realizaciones, la IL-2 esta conjugada con un polietilenglicol. Polietilenglicoles a modo de ejemplo incluyen, pero no se limitan a, un polietilenglicol que tiene un peso molecular promedio de 1.000 a 40.000 daltons, un polietilenglicol que tiene un peso molecular promedio de 2.000 a 20.000 daltons y un polietilenglicol que tiene un peso molecular promedio de 3.000 a 12.000 daltons.
En otras realizaciones, la IL-2 esta covalentemente conjugada con un poliol polioxietilado. Polioles polioxietilados a modo de ejemplo incluyen, pero no se limitan a, sorbitol polioxietilado, glucosa polioxietilada y glicerol polioxietilado. En ciertas realizaciones, el poliol polioxietilado es un glicerol polioxietilado que tiene un peso molecular promedio de 1.000 a 40.000.
En cualquiera de los procedimientos descritos en el presente documento, multiples ciclos del procedimiento de tratamiento pueden administrarse al sujeto durante un periodo de tiempo suficiente para efectuar al menos una respuesta tumoral parcial. En ciertas realizaciones, el periodo de tiempo es al menos 6 meses. En ciertas realizaciones, el periodo de tiempo es al menos 12 meses. En ciertas realizaciones, el periodo de tiempo es suficiente para efectuar una respuesta tumoral completa.
En ciertos aspectos, el procedimiento de tratamiento comprende ademas multiples ciclos de un tratamiento que comprende: a) administrar una dosis de 9 MUI de IL-2 por dia, en 1-3 dosis al dia, durante 3-6 dias a la semana, repetida durante 1-24 semanas; y b) no administrar IL-2 durante 1-4 semanas; administrada a dicho sujeto durante un periodo de tiempo suficiente para efectuar al menos una respuesta tumoral parcial.
En cualquiera de los procedimientos descritos en el presente documento, la IL-2 puede administrarse por administracion subcutanea, intraperitoneal, intramuscular, intravenosa, oral, pulmonar, nasal, topica o transdermica,
o por infusion o supositorios. En una realizacion preferida, la IL-2 se administra subcutaneamente.
Estas y otras realizaciones de la invencion objeto se produciran facilmente para aquellos expertos en la materia en vista de la divulgacion en el presente documento.
BREVE DESCRIPCION DE LAS FIGURAS
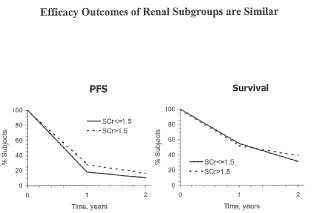
La Figura 1 compara la eficacia relativa de IL-2 a baja dosis en pacientes con carcinoma de celulas renales metastasico que tienen funcion renal normal (creatinina en suero (SCr) : 1, 5 mg/dl) y alterada (SCr >1, 5 mg/dl) tras la... [Seguir leyendo]
Reivindicaciones:
1. IL-2 para su uso en el tratamiento de un paciente humano renalmente insuficiente que tiene carcinoma de celulas renales, en el que
a) una dosis de 9-18 MUI de IL-2 por dia se administra subcutaneamente, en 1-3 dosis al dia, durante 3-6 dias a la semana, repetida durante 1-24 semanas; y b) no se administra IL-2 durante 1-4 semanas.
2. IL-2 para su uso en el tratamiento de un paciente humano renalmente insuficiente que tiene carcinoma de celulas renales, en el que:
a) una dosis de 9-18 MUI de IL-2 se administra subcutaneamente por dia, en 1-3 dosis al dia, durante 3-6 dias a la semana, repetida durante 1-24 semanas; b) no se administra IL-2 durante 1-4 semanas; c) una dosis de 9 MUI de IL-2 se administra subcutaneamente por dia, en 1-3 dosis al dia, durante 3-6 dias a la semana, repetida durante 1-24 semanas; y d) no se administra IL-2 durante 1-4 semanas.
3. IL-2 para su uso segun la reivindicacion 2, en el que:
a) primero, 2 una dosis de 18 MUI de IL-2 se administra subcutaneamente por dia durante 5 dias durante una semana; b) segundo, una dosis de 9 MUI de IL-2 se administra subcutaneamente por dia durante 2 dias seguido de administracion subcutanea de una dosis de 18 MUI de IL-2 por dia durante 3 dias durante cada semana, repetida durante 5 semanas; c) tercero, no se administra IL-2 durante 3 semanas; d) cuarto, una dosis de 9 MUI de IL-2 se administra subcutaneamente por dia durante 5 dias de cada semana, repetida durante 6 semanas; y e) quinto, no se administra IL-2 durante 3 semanas.
4. IL-2 para su uso como se reivindica en una cualquiera de las reivindicaciones 1-2, en el que dicha IL-2 es IL-2 recombinantemente producida que comprende una secuencia de aminoacidos que tiene al menos el 70% de identidad de secuencias con la secuencia de aminoacidos de IL-2 humana.
5. IL-2 para su uso segun la reivindicacion 4, en el que dicha IL-2 comprende una secuencia de aminoacidos que tiene al menos el 80% de identidad de secuencias con la secuencia de aminoacidos de IL-2 humana.
6. IL-2 para su uso segun la reivindicacion 5, en el que dicha IL-2 comprende una secuencia de aminoacidos que tiene al menos el 90% de identidad de secuencias con la secuencia de aminoacidos de IL-2 humana.
7. IL-2 para su uso segun la reivindicacion 6, en el que dicha IL-2 comprende una secuencia de aminoacidos que tiene al menos el 95% de identidad de secuencias con la secuencia de aminoacidos de IL-2 humana.
8. IL-2 para su uso como se reivindica en una cualquiera de las reivindicaciones 1-2, en el que dicha IL-2 es una muteina de IL-2.
9. IL-2 para su uso segun la reivindicacion 8, en el que dicha IL-2 es des-alanil-1, serina-125-interleucina-2 humana (aldesleucina) .
10. IL-2 para su uso segun la reivindicacion 8, en el que dicha IL-2 esta seleccionada del grupo que consiste en Ala104 Ser125 IL-2; des-Ala1 des-Pro2 des-Thr3 des-Ser4 Ala104 Ser125 IL-2; y des-Ala1 des-Pro2 des-Thr3 des-Ser4 des-Ser5 des-Ser6 IL-2.
11. IL-2 para su uso como se reivindica en una cualquiera de las reivindicaciones 1-2, en el que dicho carcinoma de celulas renales es metastasico.
12. IL-2 para su uso segun la reivindicacion 2, en el que se administran multiples ciclos de tratamiento a dicho sujeto durante un periodo de tiempo suficiente para efectuar al menos una respuesta tumoral parcial.
13. IL-2 para su uso segun la reivindicacion 2, que comprende ademas multiples ciclos de un tratamiento que comprende:
a) una dosis de 9 MUI de IL-2 se administra subcutaneamente por dia, en 1-3 dosis al dia, durante 3-6 dias a la semana, repetida durante 1-24 semanas; y b) no se administra IL-2 durante 1-4 semanas; administrada a dicho sujeto durante un periodo de tiempo suficiente para efectuar al menos una respuesta tumoral parcial.
14. IL-2 para su uso como se reivindica en cualquier reivindicacion 12 o 13, en el que el periodo de tiempo es al 5 menos 6 meses.
15. IL-2 para su uso como se reivindica en cualquier reivindicacion 12 o 13, en el que el periodo de tiempo es al menos 12 meses.
16. IL-2 para su uso como se reivindica en cualquier reivindicacion 12 o 13, en el que se efectua una respuesta tumoral completa.
17. IL-2 para su uso segun la reivindicacion 2, en el que dicho paciente es intolerante al tratamiento con IL-2 a alta dosis. 15
18. Uso de IL-2 en la fabricacion de un medicamento para tratar un paciente humano renalmente insuficiente que tiene carcinoma de celulas renales segun una cualquiera de las reivindicaciones precedentes.
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Derivado heteroarilo o sal farmacéuticamente aceptable del mismo, método de preparación del mismo y composición farmacéutica para prevenir o tratar enfermedades asociadas con PI3 quinasas, que contiene el mismo como principio activo, del 22 de Julio de 2020, de KOREA RESEARCH INSTITUTE OF CHEMICAL TECHNOLOGY: Un compuesto representado por la fórmula 1, un isómero óptico del mismo o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la fórmula […]