PROCEDIMIENTOS INMUNOHISTOQUIMICOS PARA SUPERVISAR LOS NIVELES DE PERK.
Un procedimiento para supervisar la respuesta de un paciente que es tratado de cáncer,
a la administración de una molécula pequeña inhibidora de la quinasa Raf, que comprende las etapas de:
a. determinar el nivel de fosforilación de pERK en una primera muestra biológica obtenida del paciente antes del tratamiento con la molécula pequeña inhibidora de la quinasa Raf:
b. determinar el nivel de fosforilación de pERK en al menos una segunda muestra biológica obtenida del paciente después del tratamiento con la molécula pequeña inhibidora de la quinasa Raf; y
c. comparar el nivel de fosforilación en la segunda muestra biológica con el nivel de fosforilación en la primera muestra biológica; en el que el nivel de fosforilación de pERK se evalúa por inmunohistoquímica, y en el que un cambio en el nivel de fosforilación de las proteínas pERK en la segunda muestra biológica comparada con el nivel de fosforilación de pERK en la primera muestra biológica, indica la eficacia del tratamiento con la molécula pequeña inhibidora de la quinasa Raf
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2004/036977.
Solicitante: BAYER PHARMACEUTICALS CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 400 MORGAN LANE,WEST HAVEN, CT 06516.
Inventor/es: WILHELM,SCOTT, TAYLOR,IAN.
Fecha de Publicación: .
Fecha Concesión Europea: 31 de Marzo de 2010.
Clasificación Internacional de Patentes:
- G01N33/574V
Clasificación PCT:
- G01N33/50 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/574 G01N 33/00 […] › para el cáncer.
Clasificación antigua:
- C07D217/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › Compuestos heterocíclicos que contienen isoquinoleína o isoquinoleína hidrogenada en el sistema cíclico.
Fragmento de la descripción:
Procedimientos inmunohistoquímicos para supervisar los niveles de pERK.
Campo de la invención
La presente invención se refiere a procedimientos inmunohistoquímicos para identificar biomarcadores. Por ejemplo, esta invención se refiere al uso de los niveles de fosfo-ERK (pERK) en las células tumorales como un biomarcador para un inhibidor de la quinasa Raf.
Antecedentes de la invención
Muchos estados patológicos se caracterizan por diferencias en los niveles de fosforilación de diferentes proteínas de señalización a través de los cambios en la actividad de proteína quinasas o fosfatasas. Los compuestos que se usan como productos terapéuticos para tratar diferentes enfermedades (p. ej., cáncer) probablemente invierten alguna o todas estas modulaciones del nivel de fosforilación de proteínas. Por lo tanto, el nivel o cambio de nivel de fosforilación de al menos algunas de estas proteínas se puede usar como un procedimiento para controlar o incluso predecir, la eficacia de dichos productos terapéuticos. Como resultado, algunos o todos estos niveles o cambios de nivel de fosforilación de proteínas se puede considerar que son, y se pueden usar como, un biomarcador. Además de usarlos para controlar o predecir la eficacia de un producto terapéutico, los biomarcadores también se pueden usar para seleccionar pacientes que se prevé que responderán positivamente a la administración del producto terapéutico y aquellos que pueden volver a un estado no sensible. El análisis de estos niveles o cambios de nivel de fosforilación de proteínas se puede llevar a cabo en el tejido diana de interés (p. ej., tumor) o en alguna población de células secundarias (p. ej., leucocitos de la sangre periférica). En este último caso, la correlación de los niveles o cambios de nivel de fosforilación de proteínas con la eficacia (p. ej., reducción o no crecimiento del tumor) debe ser especialmente fuerte para usar el patrón del cambio de expresión como un marcador para la eficacia.
La quinasa Raf es una proteína implicada en la ruta de transducción de señales de Ras. Ras regula varias rutas que inducen de forma sinérgica la transformación celular, incluyendo la cascada Raf/Mek/Erk y las rutas de rac y rho. En particular, Ras activa la ruta de Raf/MEK localizando primero Raf en la membrana plasmática, donde Raf inicia una cascada de quinasas mitógenas (Hall, Science 264:1413-1414, 1994). Raf activado fosforila y activa MEK (un sustrato conocido secuencia abajo), que a su vez fosforila y activa ERK. Después, la ERK activada se transloca del citoplasma al núcleo y modula la expresión de genes a través de la fosforilación de factores de transcripción. Por lo tanto, la activación de la quinasa Raf, por activación de Ras, se considera un mecanismo importante por el cual se desarrolla el cáncer humano.
Una serie de estudios han sugerido que la inhibición de la quinasa Raf es una diana importante para la terapia del cáncer. Por ejemplo, los mutantes negativos dominantes de la actividad de Raf, MEK o ERK reducen significativamente la capacidad transformante de Ras mutante en un contexto de fibroblastos de roedor. Además, las líneas de células tumorales humanas que expresan una MEK negativa dominante, eran deficientes en su capacidad para crecer tanto en cultivo tisular como en ensayos de crecimiento de anclaje independientes, comparado con la línea celular original. Dichos mutantes también inhibían tanto el crecimiento primario como metastático de xenoinjertos de tumores humanos in vivo. Un apoyo adicional para dirigirse a la quinasa Raf viene del trabajo con oligonucleótidos antisentido. Se encontró que ISIS 5132, un oligonucleótido antisentido fosforotioato diseñado para dirigirse a c-Raf, inhibía el crecimiento del xenoinjerto de pulmón humano A549 in vivo (Monia, y col., Proc. Natl. Acad. Sci 93:15481-15484, 1996). Cuando se consideran juntos, estos datos sugieren que la proteína quinasa Raf es un contribuyente significativo del fenotipo maligno dirigido por la señalización de Ras activado. Además, los datos también sugieren que las moléculas pequeñas inhibidoras de la actividad de la quinasa raf serán un mecanismo terapéutico importante en el tratamiento del cáncer.
Sin embargo, debido a la red de receptores de factores de crecimiento, ligandos y moléculas efectoras de la proliferación celular y supervivencia celular corriente abajo, la inhibición de quinasas específicas puede no ser una estrategia terapéutica eficaz en todos los individuos con cáncer, ya que pueden existir diferentes rutas compensatorias para superar la inhibición terapéutica. Por consiguiente, será útil identificar marcadores biológicos que indiquen, en un paciente individual, si el tumor del paciente está respondiendo a una intervención terapéutica particular. Aunque tradicionalmente se ha usado el tamaño del tumor o la evolución de la enfermedad para determinar si un individuo estaba respondiendo a una terapia particular, el uso de marcadores moleculares puede permitir la identificación más temprana de los pacientes que responden y los que no responden. Así pues, a los pacientes que no responden se les puede ofrecer una terapia alternativa, y ahorrarse los potenciales efectos secundarios de una terapia que no es eficaz para su tumor específico.
Sería útil identificar uno o más o una combinación de marcadores moleculares capaces de indicar si el tumor de un individuo responde al tratamiento (p. ej., tratamiento con un inhibidor de la quinasa Raf). Dichos marcadores ayudarían (i) a identificar en que marco clínico y que poblaciones de pacientes es más probable que el procedimiento terapéutico sea eficaz, y (ii) a evaluar, en pacientes individuales, si el tumor del paciente está respondiendo a un tratamiento específico.
Puesto que el tejido normal tiene un aspecto característico, a menudo se usa el examen histológico para identificar el tejido enfermo. La inmunohistoquímica (IHC) es una herramienta útil en el diagnóstico histológico. La IHC se puede usar para detectar una entidad en una muestra usando agentes de unión específicos capaces de unirse a la entidad detectable. El agente de unión específico puede comprender un anticuerpo, y la entidad detectable puede comprender un polipéptido, proteína o epítopo. La capacidad creciente de dichos anticuerpos puede ayudar al diagnóstico diferencial del tejido enfermo y normal. Los procedimientos IHC los describen con detalle Harlow y Lane (Antibodies: A Laboratory Manual).
Las técnicas de IHC requieren una serie de etapas que se pueden llevar a cabo en una sección de tejido montada en un portaobjetos de vidrio u otro soporte plano. Algunos indicadores morfológicos de estados patológicos pueden destacarse mediante tinción selectiva. Por ejemplo, se toma una muestra de un paciente y después se fija y se expone a anticuerpos contra un antígeno de interés. Pueden ser necesarias etapas de procesamiento adicionales, por ejemplo, recuperación del antígeno, exposición a anticuerpos secundarios (normalmente acoplados a una enzima adecuada) y a sustratos enzimáticos cromogénicos, para poner de manifiesto el patrón de unión del antígeno.
En general, hay dos categorías de materiales histológicos: (a) preparaciones que comprenden tejidos y/o células recientemente obtenidos, que no se fijan con fijadores basados en aldehído, y (b) muestras de tejido insertadas y fijadas, a menudo material de archivo. Se conocen muchos procedimientos para fijar e insertar muestras de tejido (p. ej., fijación en alcohol). Sin embargo, la técnica de fijación/inserción más ampliamente usada, usa la fijación con formalina y posterior inserción en parafina (FFPE). Un procedimiento de tinción IHC de FFPE típico puede implicar las etapas de: corte y recorte tejido, fijación, deshidratación, infiltración en parafina, corte en secciones finas, montaje sobre portaobjetos de vidrio, horneado, desparafinización, rehidratación, recuperación del antígeno, etapas de bloqueo, aplicación de anticuerpo primario, lavado, aplicación de conjugado de anticuerpo secundario-enzima, lavado, aplicación de sustrato cromógeno enzimático, lavado, tinción de contraste, deslizamiento de la cubierta y examen al microscopio.
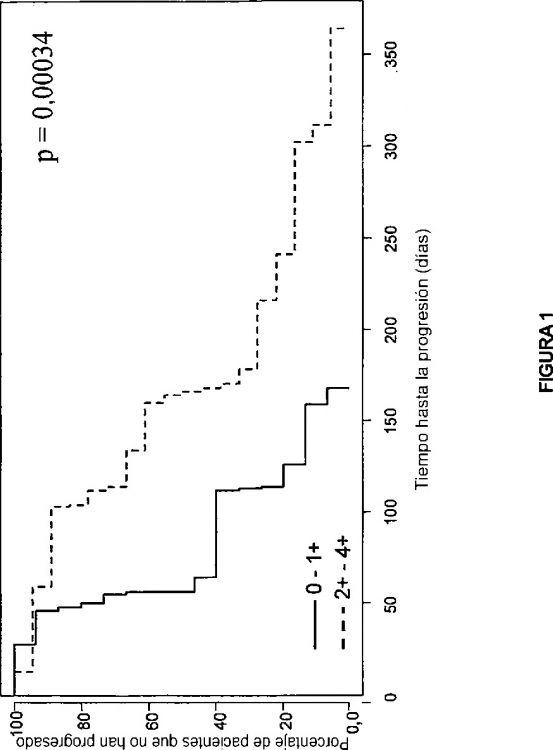
Como se ha descrito antes, la fosforilación de ERK es corriente abajo de la ruta de ras/raf/MEK/ERK. En el carcinoma de células renales (CCR), están presentes niveles mayores de proteínas raf y ERK fosforiladas (es decir, activadas) aproximadamente el 50% del tiempo (Oka, y col., Cancer Res. 55:4182-4187, 1995). Como tal, los pacientes con ERK fosforilada elevada tienen más probabilidad de beneficiarse...
Reivindicaciones:
1. Un procedimiento para supervisar la respuesta de un paciente que es tratado de cáncer, a la administración de una molécula pequeña inhibidora de la quinasa Raf, que comprende las etapas de:
a. determinar el nivel de fosforilación de pERK en una primera muestra biológica obtenida del paciente antes del tratamiento con la molécula pequeña inhibidora de la quinasa Raf:
b. determinar el nivel de fosforilación de pERK en al menos una segunda muestra biológica obtenida del paciente después del tratamiento con la molécula pequeña inhibidora de la quinasa Raf; y
c. comparar el nivel de fosforilación en la segunda muestra biológica con el nivel de fosforilación en la primera muestra biológica; en el que el nivel de fosforilación de pERK se evalúa por inmunohistoquímica, y en el que un cambio en el nivel de fosforilación de las proteínas pERK en la segunda muestra biológica comparada con el nivel de fosforilación de pERK en la primera muestra biológica, indica la eficacia del tratamiento con la molécula pequeña inhibidora de la quinasa Raf.
2. El procedimiento de la reivindicación 1, en el que dicho cáncer se selecciona de cáncer de pulmón, cáncer renal, cáncer pancreático, cáncer de hígado, cáncer gastrointestinal, cáncer de tiroides, cáncer de ovario, cáncer de mama, cáncer de próstata y melanoma.
3. El procedimiento de la reivindicación 1, en el que dicha muestra es una biopsia de tumor.
4. Un procedimiento para seleccionar un paciente de cáncer sensible a una molécula pequeña inhibidora de la quinasa Raf, que comprende las etapas de:
a) determinar el nivel de fosforilación de pERK en una primera muestra biológica obtenida de un paciente de cáncer, habiéndose administrado a dicho paciente una molécula pequeña inhibidora de la quinasa Raf;
b) comparar el nivel de fosforilación de pERK en la primera muestra biológica con el nivel de fosforilación de pERK en una segunda muestra biológica obtenida de un sujeto normal, habiendo administrado a dicho sujeto normal una molécula pequeña inhibidora de la quinasa Raf; en el que el nivel de fosforilación de pERK se evalúa por inmunohistoquímica, y un cambio en el nivel de fosforilación de pERK en la primera muestra biológica comparada con el nivel de fosforilación de pERK en la segunda muestra biológica es un pronóstico de la respuesta del paciente al tratamiento con la molécula pequeña inhibidora de la quinasa Raf.
5. El procedimiento de la reivindicación 4, en el que se ha diagnosticado al paciente cáncer seleccionado de cáncer de pulmón, cáncer renal, cáncer pancreático, cáncer de hígado, cáncer gastrointestinal, cáncer de tiroides, cáncer de ovario, cáncer de mama, cáncer de próstata y melanoma.
6. El procedimiento de la reivindicación 4, en el que dicha muestra es una biopsia de tumor.
Patentes similares o relacionadas:
EXPRESIÓN DIFERENCIAL DE LA CITOCINA EN CÁNCER HUMANO, del 29 de Diciembre de 2011, de APOGENIX GMBH: Un método in vitro para diagnosticar un tipo de cáncer, que comprende las etapas: (a) proporcionar una muestra procedente de un tumor epitelial que comprende células tumorales, […]
 MÉTODO DE TERAPIA, del 26 de Abril de 2011, de IMMUNAID PTY LTD: Un método para analizar el ciclo del sistema inmune para determinar cuándo se debe administrar un agente a un paciente que sufre de una enfermedad caracterizado […]
MÉTODO DE TERAPIA, del 26 de Abril de 2011, de IMMUNAID PTY LTD: Un método para analizar el ciclo del sistema inmune para determinar cuándo se debe administrar un agente a un paciente que sufre de una enfermedad caracterizado […]
 ANTICUERPOS DIRIGIDOS CONTRA EPHA2 COMO UN DIAGNÓSTICO DE CÁNCER, del 25 de Abril de 2011, de PURDUE RESEARCH FOUNDATION: Un procedimiento in vitro de detección de la presencia de células cancerosas metastásicas en una población de células seleccionada que comprende: ensayar al menos una porción […]
ANTICUERPOS DIRIGIDOS CONTRA EPHA2 COMO UN DIAGNÓSTICO DE CÁNCER, del 25 de Abril de 2011, de PURDUE RESEARCH FOUNDATION: Un procedimiento in vitro de detección de la presencia de células cancerosas metastásicas en una población de células seleccionada que comprende: ensayar al menos una porción […]
PERFILES DE ANTÍGENOS ASOCIADOS A TUMORES EN EL DIAGNÓSTICO DE CÁNCER E INMUNOTERAPIA, del 14 de Febrero de 2011, de MANNKIND CORPORATION: Un método de compatibilizar un estado canceroso en un paciente con uno o más agentes inmunoterapéuticos para usos en un régimen inmunoterapéutico, que comprende las etapas […]
ANTÍGENO TUMORAL SECRETADO, del 10 de Enero de 2011, de AGENSYS, INC.: Un método para detectar la presencia de cáncer de próstata en un individuo, cuyo método comprende determinar el nivel de expresión de la proteína […]
 PROCEDIMIENTOL PARA DETECTAR AFECCIONES DE RELEVANCIA MEDICA EN UNA MUESTRA DE LBC SOLUBILIZADA, del 8 de Julio de 2010, de MTM LABORATORIES AG: Un procedimiento para evaluar el diagnóstico de un tumor seleccionado del grupo que consiste en tumores del tracto anogenital, tumores del tracto gastrointestinal, tumores […]
PROCEDIMIENTOL PARA DETECTAR AFECCIONES DE RELEVANCIA MEDICA EN UNA MUESTRA DE LBC SOLUBILIZADA, del 8 de Julio de 2010, de MTM LABORATORIES AG: Un procedimiento para evaluar el diagnóstico de un tumor seleccionado del grupo que consiste en tumores del tracto anogenital, tumores del tracto gastrointestinal, tumores […]
 SISTEMA PARA LA VALIDACION CUANTITATIVA Y CUALITATIVA INTERNA DE INDICES DE MARCADORES, del 2 de Marzo de 2010, de DAKO A/S: Un pseudo-tejido que comprende una mezcla sustancialmente homogénea de dos o más poblaciones de células de células fijas incluidas en una matriz, […]
SISTEMA PARA LA VALIDACION CUANTITATIVA Y CUALITATIVA INTERNA DE INDICES DE MARCADORES, del 2 de Marzo de 2010, de DAKO A/S: Un pseudo-tejido que comprende una mezcla sustancialmente homogénea de dos o más poblaciones de células de células fijas incluidas en una matriz, […]
Cultivo de tejido tridimensional heterogéneamente diferenciado, del 22 de Julio de 2020, de IMBA-INSTITUT FÜR MOLEKULARE BIOTECHNOLOGIE GMBH: Un cultivo de tejido neuronal tridimensional artificial cultivado in vitro que comprende una población heterogénea de células humanas o células de primate no humanas […]