PROCEDIMIENTO PARA LA PROTECCIÓN DE BIOCATALIZADORES ENZIMÁTICOS INSOLUBLES, BIOCATALIZADOR OBTENIDO DEL MISMO Y BIORREACTOR CON EL BIOCATALIZADOR INMOVILIZADO.
Procedimiento para fabricar un biocatalizador insoluble mediante a) inmovilizar una enzima biocatalizadora covalentemente sobre un soporte primario,
y b) encapsular el soporte primario mediante una matriz secundaria que es un gel, en el que el biocatalizador conserva su integridad física y actividad catalítica en aplicaciones a largo plazo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/BR2003/000173.
Solicitante: FUNDACAO UNIVERSIDADE FEDERAL DE SAO CARLOS
FUNDACAO DE AMPARO A PESQUISA DO ESTADO DE SAO PAULO - FAPESP.
Nacionalidad solicitante: Brasil.
Dirección: VIA. WASHINGTON LUIZ, KM 235, CP 676 13565-905 SAO CARLOS, SAO PAUL BRASIL.
Inventor/es: GIORDANO de Campos,Roberto , GIORDANO de Lima,Raquel Camargo , FERREIRA de Oliveira,Andrea Lopes.
Fecha de Publicación: .
Fecha Solicitud PCT: 24 de Noviembre de 2003.
Clasificación Internacional de Patentes:
- C12M1/02 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12M EQUIPOS PARA ENZIMOLOGIA O MICROBIOLOGIA (instalaciones para la fermentación de estiércoles A01C 3/02; conservación de partes vivas de cuerpos humanos o animales A01N 1/02; aparatos de cervecería C12C; equipos para la fermentación del vino C12G; aparatos para preparar el vinagre C12J 1/10). › C12M 1/00 Equipos para enzimología o microbiología. › con medios de agitación; con medios de intercambio de calor.
- C12M1/04 C12M 1/00 […] › con medios de introducción de gas.
- C12M1/40 C12M 1/00 […] › Equipos especialmente destinados a la utilización de enzimas libres, inmovilizadas o unidas a un soporte, p. ej. aparatos que contienen un lecho fluidizado de enzimas inmovilizadas.
- C12N11/10 C12 […] › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 11/00 Enzimas fijadas sobre un soporte o inmovilizadas; Células microbianas fijadas sobre un soporte o inmovilizadas; Su preparación. › siendo el soporte un hidrato de carbono.
- C12N9/84 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Penicilinamidasa.
- C12P35/00 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › Preparación de compuestos que contienen un sistema cíclico 5-tia, 1-aza biciclo [4.2.0] octano, p. ej. cefalosporina.
- C12P37/00 C12P […] › Preparación de compuestos que contienen un sistema cíclico 4-tia 1-aza biciclo [3.2.0] heptano, p. ej. penicilina.
Clasificación PCT:
- C12M1/02 C12M 1/00 […] › con medios de agitación; con medios de intercambio de calor.
- C12M1/04 C12M 1/00 […] › con medios de introducción de gas.
- C12P35/00 C12P […] › Preparación de compuestos que contienen un sistema cíclico 5-tia, 1-aza biciclo [4.2.0] octano, p. ej. cefalosporina.
- C12P37/00 C12P […] › Preparación de compuestos que contienen un sistema cíclico 4-tia 1-aza biciclo [3.2.0] heptano, p. ej. penicilina.
Clasificación antigua:
- C12M1/02 C12M 1/00 […] › con medios de agitación; con medios de intercambio de calor.
- C12M1/04 C12M 1/00 […] › con medios de introducción de gas.
- C12P35/00 C12P […] › Preparación de compuestos que contienen un sistema cíclico 5-tia, 1-aza biciclo [4.2.0] octano, p. ej. cefalosporina.
- C12P37/00 C12P […] › Preparación de compuestos que contienen un sistema cíclico 4-tia 1-aza biciclo [3.2.0] heptano, p. ej. penicilina.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Campo de la invención
La presente invención notifica un procedimiento para la preparación de biocatalizadores, compuestos por 5 un soporte primario activado al que se unen enzimas. El soporte primario, a su vez, está envuelto por una matriz secundaria, que proporcionará protección mecánica y un aumento del tamaño de partícula, haciendo especialmente más fácil la separación de productos de reacción que cristalizan durante el procedimiento. Esta invención también se refiere a un reactor que promueve una agitación eficaz, sin dañar el biocatalizador, usando vórtices de Taylor-Couette y/o la inyección de un gas inerte. 10
Antecedentes de la invención
La enorme competencia mundial en la industria de procedimientos biotecnológicos plantea varios desafíos. Uno de ellos está relacionado con las demandas siempre crecientes de las agencias gubernamentales que controlan los impactos ambientales. Por tanto, la búsqueda de nuevos procedimientos bioquímicos que sean sostenibles y, al 15 mismo tiempo, competitivos desde un punto de vista económico, es una fuerza impulsora principal para esta industria.
En este contexto, el uso de enzimas en la industria es cada vez más intensa. La catálisis enzimática presenta ventajas en comparación con procedimientos clásicos:
(i) las reacciones se producen a presión y temperatura ambiente; 20
(ii) tiene lugar una reacción específica (especificidad de reacción) en un sitio particular (especificidad de sitio). Por tanto, puede obtenerse el producto deseado con altos rendimientos;
(iii) puesto que la especificidad de sustrato es alta, sólo se hace reaccionar selectivamente el compuesto deseado, aunque haya otras especies presentes en el mismo entorno.
Sin embargo, los biocatalizadores enzimáticos presentan desventajas, concretamente: 25
(i) si se emplea(n) enzima(s) libre(s), su reutilización en lotes sucesivos, o su recirculación en reactores continuos no es económica, porque son solubles en agua y están presentes a baja concentración;
(ii) por otro lado, si la(s) enzima(s) está(n) inmovilizada(s) sobre soportes insolubles, haciendo posible el uso en periodos prolongados (lotes repetidos o procedimientos continuos), las matrices de 30 soporte tienen, en términos generales, radios del orden de micras, para reducir los efectos de difusión de poros. Estos biocatalizadores (en este caso se entiende que son el conjunto soporte-enzima) tienen, en muchos casos, baja resistencia a la tensión de corte;
(iii) tales biocatalizadores de pequeñas dimensiones son difíciles de separar de productos precipitados, siempre que estén presentes en el procedimiento. 35
Adicionalmente, la actividad enzimática puede reducirse, algunas veces de manera irreversible, por calor, por disolventes orgánicos, por ácidos o bases, o incluso por los productos de reacción. Sin embargo, la ingeniería apropiada del biocatalizador (enzima-soporte) puede proporcionar importantes aumentos en la vida del catalizador.
La investigación sobre biocatalizadores inmovilizados se ha realizado desde la mitad de la década de 1950. En la actualidad, pueden usarse los siguientes métodos para la inmovilización de enzimas: (i) unión covalente, 40 adsorción o unión iónica al soporte; (ii) reticulación, cuando las moléculas de enzima se entrecruzan mediante reactantes polifuncionales, y se vuelven insolubles; (iii) encapsulación, por ejemplo en gel polimérico, microcápsulas o membranas líquidas lipídicas y (d) combinaciones de los métodos anteriores.
Entre estos métodos, la encapsulación en gel es más común, aplicándose en la inmovilización de varios biocatalizadores. 45
La patente estadounidense 4.975.375 describe un método para preparar un biocatalizador que consiste en las siguientes etapas: (i) reducir la temperatura de un gel polimérico reticulado, que tiene una temperatura de transición de fase específica, y que puede expandirse o contraerse de manera reversible, expandiéndose a temperaturas inferiores a su temperatura de transición de fase; (ii) añadir el gel en el estado expandido mencionado a un medio líquido con la enzima, dejando que la enzima migre en el mismo y (iii) calentar al menos una parte del 50
gel referido hasta o por encima de su temperatura de transición, lo que provocará su contracción y, posteriormente, el atrapamiento de la enzima.
No obstante, debe indicarse que los métodos clásicos tienen desventajas, tales como: (i) reducción de la actividad enzimática tras la inmovilización; (ii) falta de estabilidad durante la inmovilización, lo que hace que al menos parte de las moléculas se desnaturalicen o cambien su conformación todavía fuera del soporte; (iii) 5 reactivación difícil del catalizador; (iv) complicaciones adicionales relacionadas con las reacciones de inmovilización, que pueden ser difíciles de controlar o exigir reactantes tóxicos, difíciles de manejar y (v) dificultades para lograr la orientación espacial correcta y la colocación precisa de la enzima en los sitios de interés del soporte.
La asociación de un nuevo método para la inmovilización de enzimas con nuevas configuraciones de biorreactores integrados es esencial para hacer que los procesos enzimáticos sean viables, cumpliendo con la 10 reducción de los impactos ambientales mientras que, al mismo tiempo, permitan un alto rendimiento del procedimiento.
Los biorreactores deben integrar preferiblemente, en el mismo equipo, la reacción bioquímica deseada, y etapas de separación y purificación del producto deseado, tal como su cristalización.
En el caso de la producción de anticuerpos -lactámicos semisintéticos, una de las mayores desventajas 15 de la ruta enzimática es su baja selectividad, debido a la hidrólisis competitiva de los precursores (ésteres o amidas) que reaccionarían con los núcleos -lactámicos, y a la hidrólisis del propio antibiótico. La misma enzima que promueve la síntesis cataliza ambas reacciones no deseadas.
El primer antibiótico -lactámico semisintético, derivado tras la sustitución de la cadena lateral de la penicilina G, fue la ampicilina (patentada por Beecham, en 1961), seguida por la amoxicilina (patente de Beecham, 20 1972) y por las cefalexinas semisintéticas (cefalexina, Lilly, 1970, cefazolina, Fujisawa, 1974, cefadroxilo, BMS, 1977, entre otros). La evolución del mercado mundial de estos fármacos fue impresionante desde entonces, desde 1.000 toneladas/año en 1970 hasta 45.000 toneladas/año en 2000 (Moody H, Hogenboom A, Lange B, Heemskerk D, Dooren TV, Boesten W, Roos E. Enzymatic Production of Cephadroxyl. Comunicación oral y Abstract Book of the 10th European Congress on Biotechnology, CAT 12, Madrid, España, 8-11 de julio de 2001). Estos procedimientos 25 usan rutas químicas para la síntesis de las cadenas laterales y para la condensación del antibiótico, uniendo esas cadenas a los núcleos -lactámicos apropiados (6-APA, obtenido en la actualidad enzimáticamente a partir de penicilina G, 7-ACA a partir de cefalosporina C y 7-ADCA, producido tras la expansión, también mediante ruta química, del anillo de tiazolidina de 6-APA). Todos estos procedimientos convencionales están consolidados, aunque la investigación es intensa en este campo, tanto en la industria como en círculos académicos, para 30 establecer una ruta enzimática eficaz.
Para potenciar la selectividad de la reacción, deben aplicarse reactores integrados, con un biocatalizador constituido por la enzima inmovilizada. En estos reactores, las concentraciones de antibiótico exceden sus límites de solubilidad en las condiciones del procedimiento. De este modo, el producto deseado (en este caso, el antibiótico), precipitará antes de ser atacado por la enzima. 35
En reactores convencionales, este procedimiento presenta una serie de desventajas. En un reactor con buen mezclado, la agitación será demasiado agresiva para las frágiles partículas de biocatalizador. Los reactores de lecho fluidizado exigirán altos flujos de recirculación, para mantener la fluidización. Los reactores de lecho fijo pueden tener importantes restricciones de transferencia de masa en la película en el exterior de la partícula, disminuyendo las velocidades de reacción aparentes y, por tanto, la productividad del procedimiento. 40
Por tanto, es necesario desarrollar procedimientos para fabricar enzimas inmovilizadas, asociadas...
Reivindicaciones:
1. Procedimiento para fabricar un biocatalizador insoluble mediante
a) inmovilizar una enzima biocatalizadora covalentemente sobre un soporte primario, y
b) encapsular el soporte primario mediante una matriz secundaria que es un gel,
en el que el biocatalizador conserva su integridad física y actividad catalítica en aplicaciones a largo plazo.
2. Procedimiento, según la reivindicación 1, en el que la matriz secundaria se selecciona del grupo que 5 consiste en pectina cítrica, alginato, carragenanos, entre otros.
3. Procedimiento según la reivindicación 1, en el que la razón entre la masa de la matriz primaria y secundaria oscila entre 1:5 y 1:20.
4. Procedimiento según la reivindicación 1, en el que la razón entre la masa de la matriz primaria y secundaria es de 1:10. 10
5. Procedimiento según las reivindicaciones 1 y 4, en el que la suspensión resultante se extruye en forma esférica, con un diámetro de partícula final que oscila entre 0,50,1 mm y 2,00,1 mm.
6. Procedimiento según la reivindicación 5, en el que la gota de la suspensión formada con la matriz primaria y la suspensión polimérica se pone en contacto con una disolución salina que contiene al menos un catión bivalente. 15
7. Procedimiento según la reivindicación 6, en el que el catión bivalente se selecciona entre calcio, magnesio, zinc o metales de transición.
8. Procedimiento según la reivindicación 7, en el que la disolución es CaCl2 0,2 M con un tiempo de curado igual a 2 h.
9. Biocatalizador que comprende una enzima inmovilizada covalentemente en un soporte primario y 20 encapsulada mediante una matriz secundaria compuesta por un gel polimérico, conservando el biocatalizador su integridad física y actividad catalítica en aplicaciones a largo plazo.
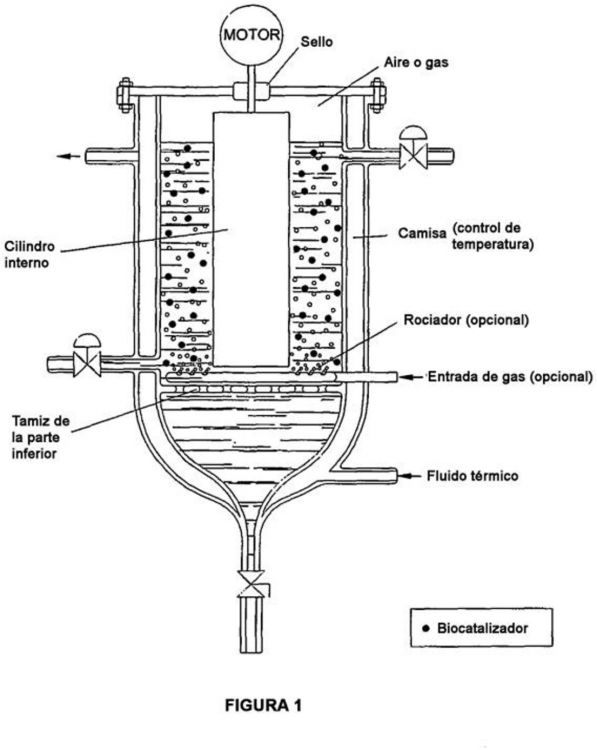
10. Biorreactor con biocatalizador inmovilizado según la reivindicación 9, que tiene una configuración que promueve una agitación adecuada, suficiente para homogeneizar el medio y eliminar o reducir la resistencia en el exterior de la partícula al transporte de masa. 25
11. Biorreactor según la reivindicación 10, en el que la agitación se promueve mediante vórtices de Taylor-Couette y/o haciendo burbujear gas inerte.
12. Biorreactor según la reivindicación 11, en el que la agitación se promueve mediante vórtices de Taylor-Couette.
13. Biorreactor según la reivindicación 12, que comprende un cilindro interno mantenido en equilibrio y 30 soportado sólo sobre su extremo superior.
14. Biorreactor según la reivindicación 13, que tiene un pequeño espacio de cabeza de aire o gas inerte que está presente por encima de la superficie del líquido, en la parte superior del reactor.
15. Biorreactor según la reivindicación 13, en el que la rotación del cilindro interior oscila entre 200 y 2000 rpm.
16. Biorreactor según la reivindicación 13, en el que las partículas quedan atrapadas en el espacio anular entre 35 el cilindro giratorio interior y el inmóvil exterior, en el que la razón entre los radios interior y exterior oscila entre 0,20 y 0,60.
17. Biorreactor según la reivindicación 12, en el que otras geometrías pueden reemplazar al cilindro giratorio interior, que pueden seleccionarse como secciones cónicas u otras superficies de revolución.
18. Biorreactor según la reivindicación 11, en el que la agitación se proporciona con el burbujeo de un gas 40 inerte.
19. Biorreactor según la reivindicación 18, en el que se promueve el mezclado mediante un rociador en la parte inferior del reactor y, opcionalmente mediante la adición de un cilindro interno interior.
20. Uso del biorreactor según cualquiera de las reivindicaciones 10 a 19, para la síntesis de antibióticos -lactámicos, en el que el biorreactor comprende catalizadores enzimáticos insolubles, que tienen su matriz 45
de inmovilización primaria encapsulada por una matriz secundaria, que puede mantener el 100% de su integridad física y aprox. el 100% de su integridad catalítica.
21. Uso del biorreactor según la reivindicación 20, en el que los antibióticos -lactámicos se seleccionan entre los obtenidos mediante la reacción de un éster o una amina con un núcleo -lactámico tal como 6-APA, 7-ADCA, 7-ACA, que produce antibióticos tales como ampicilina, amoxicilina, cefalexina, cefadroxilo, entre 5 otros.
22. Uso del biorreactor según la reivindicación 21, en el que los productos, en fase sólida, se retiran por la parte inferior, superior o lateral del reactor, opcionalmente con reflujo parcial o total de la fase líquida.
23. Uso del biorreactor según la reivindicación 21, en el que el biocatalizador conserva el 100% de su actividad y una integridad física completa tras aproximadamente 100 h de funcionamiento. 10
Patentes similares o relacionadas:
Reactor compacto para tratamiento enzimático, del 25 de Marzo de 2020, de Nuas Technology AS: Reactor para la hidrólisis enzimática de un material que comprende en secuencia: - un primer intercambiador de calor (HEX1) adaptado para […]
Equipo de prueba para cultivos celulares basado en pocillos múltiples para microfluidos, del 14 de Agosto de 2019, de Quanta Matrix Co., Ltd: Un dispositivo de prueba de cultivo celular en microfluidos basado en múltiples pocillos que tiene una estructura de matriz de una pluralidad de unidades […]
Procedimiento para la producción de una solución que contiene azúcar, del 16 de Noviembre de 2018, de TORAY INDUSTRIES, INC.: Procedimiento para proporcionar un líquido que contiene azúcar repitiendo un proceso de producción de líquido que contiene azúcar, comprendiendo el proceso de producción […]
Microestructura para la captura y liberación de microorganismos, del 11 de Mayo de 2016, de Quanta Matrix Co., Ltd: Una estructura para la captura y liberación de microorganismos que comprende: una microestructura que tiene un área superficial que es suficientemente grande para capturar […]
Reactor o mezclador enzimático de alto contenido en sólidos y procedimiento, del 4 de Mayo de 2016, de ANDRITZ TECHNOLOGY AND ASSET MANAGEMENT GMBH: Un aparato reactor que comprende: - una cámara de mezcla interna que incluye una primera sección de cámara que tiene un área transversal […]
 Aparato para preparar perlas de enzimas inmovilizadas y método para preparar perlas de enzimas inmovilizadas usándolo, del 23 de Diciembre de 2015, de CJ CHEILJEDANG CORPORATION: Un aparato para preparar perlas de enzimas inmovilizadas, incluyendo:
a) un primer depósito al que se inyecta un líquido mezclado conteniendo un material conteniendo […]
Aparato para preparar perlas de enzimas inmovilizadas y método para preparar perlas de enzimas inmovilizadas usándolo, del 23 de Diciembre de 2015, de CJ CHEILJEDANG CORPORATION: Un aparato para preparar perlas de enzimas inmovilizadas, incluyendo:
a) un primer depósito al que se inyecta un líquido mezclado conteniendo un material conteniendo […]
Procedimiento de una sola etapa para separar componentes de la biomasa, del 29 de Octubre de 2013, de NAGARJUNA ENERGY PRIVATE LIMITED: Un procedimiento para la obtención de celulosa de la biomasa en una forma susceptible de sufrir hidrólisisenzimática, comprendiendo dicho procedimiento poner en contacto la […]
Método y aparato para producir microconjuntos de muestras biológicas, del 9 de Mayo de 2012, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: SE PRESENTAN UN METODO Y UN APARATO PARA LA FORMACION DE MICROMATRICES DE MUESTRAS BIOLOGICAS SOBRE UN SOPORTE. EL METODO CONSISTE EN DISTRIBUIR UN VOLUMEN CONOCIDO DE UN […]